서 언
재료 및 방법
실험 재료
Genomic DNA 추출
SSR markers 탐색 및 분석
결과 및 고찰
‘비룡’ 탱자에서 자가수정 및 주심배 유래 판별 SSR의 선발
일반 탱자에서 자가수정 및 주심배 유래 판별 SSR의 적용
SSR을 이용한 일반 탱자 종자의 기내발아 특성 평가
서 언
감귤은 국내 과실 생산량의 1위(31.7%)를 차지하고 있고 1인당 연간 소비량은 12.6kg으로 가장 많이 소비되고 있어 감귤산업은 국가 및 지역 경제에 기여하는 바가 매우 크다(KOSIS, 2021; MAFRA, 2021). 감귤은 대부분의 과수와 마찬가지로 근권부 구성의 대목 위에 재배 품종의 접수를 접목한 형태로 재배된다. 대목에 따라서는 과실의 개화 및 결실을 앞당길 수 있으며 과실의 수량과 품질의 개선, 생물학적 및 비생물학적 스트레스에 대한 저항성의 증진을 도모할 수 있다. 국내에서의 감귤 대목은 거의 대부분 탱자(Poncirus trifoliata)가 사용되고 있다. 탱자는 운향과(Rutaceae)의 감귤류에 분류되는 낙엽과수이며, 온주밀감 등 많은 감귤에 대해 접목 친화성이 높고 내한성이 강하며 병저항성 및 바이러스와 선충 저항성 등 대목 특성이 매우 우수한 편이다(Chae et al., 2013).
탱자는 종자로 번식한다. 탱자를 비롯한 감귤류 종자는 배의 수에 따라 단배성 또는 다배성으로 나누어지는데, 단배 종자를 갖는 재배형의 감귤류는 소수이고 대다수가 다배성 종자를 갖는다. 다배성 종자에서는 다수의 배가 생기는데, 그 중 수정된 배는 퇴화되는 경향이 강하고 주심조직에서 무성적으로 발생한 무성배가 우세하게 발달하기 때문에 실생의 대부분은 모본과 동일한 유전형질을 갖는다. 이들 무성배는 주심세포로부터 체세포분열에 의해서 형성되었기 때문에 주심배라고 하는데, 대목 등 균일한 생육을 하는 개체가 다수 필요한 경우 매우 유용할 수 있다(Andrade-Rodriguez et al., 2005; Kepiro and Roose, 2007; Kishore et al., 2012). 탱자는 다배성이며, 대부분의 실생은 주심배 유래로 알려져 있다. 그러나 낮은 비율로 자가수정 또는 타가수정 유래가 혼재하여 번식하기도 하며, 이를 육안으로 구별하기는 거의 불가능한 실정이다. 자가수정 유래의 탱자묘가 혼재하여 대목으로 이용하게 되면 접수 품종의 생육에 차이를 나타낼 수 있기 때문에 과수 품질의 균일성을 저해하는 문제점을 야기한다(Gill et al., 2002). 이를 개선하기 위해서는 탱자 실생묘에서 자가수정 및 주심배 유래를 구분할 수 있어야 하고, 이에 따른 분자표지의 개발이 필요한 실정이다.
Simple sequence repeat(SSR)은 microsatellite라고 불리며 1–6bp의 반복서열이다. 식물의 서로 다른 종이나 개체 사이에는 microsatellite의 반복수가 다르게 나타날 수 있는데, 이러한 반복서열 양쪽의 primer를 이용한 PCR 산물의 길이 차이를 분석함으로써 다형성을 확인할 수 있는 분자표지마커로 활용할 수 있다. SSR marker는 대립유전자가 공우성으로 유전되며, 대립유전자의 종류가 많고, PCR을 통해 쉽고 간편하게 분석이 가능할 뿐만 아니라 재현성이 매우 높기 때문에 유전형 분석에 매우 유용하게 이용되고 있다(Koh et al., 2015; Fukui et al., 2020; Kim et al., 2021a). 그러므로 감귤을 포함한 다양한 식물에서 품종판별, 유연관계 분석 및 형질연관 표지 개발을 위한 연구에 많이 활용되고 있다(Woo et al., 2020; Kim et al., 2021b, 2021c; Martínez-Cuenca et al., 2021).
따라서 본 연구에서는 대목으로 사용되는 탱자의 유전적 균일성을 확보하기 위해 자가수정 및 주심배 유래를 효율적으로 구분할 수 있는 SSR을 선발하고자 하였다. 또한 선발한 SSR을 이용하여 탱자묘의 자가수정 유래의 빈도를 추정하고, 그 발생 양상을 분석하고자 하였다.
재료 및 방법
실험 재료
일반 탱자와 ‘비룡’ 탱자(Poncirus trifoliata cv. Flying Dragon)를 식물재료로 이용하였다. ‘비룡’ 탱자는 제주특별자치도 농업기술원 유전자원 포장(서귀포시 강정동, 33.2616°N, 126.4945°E)의 종자를 파종해 얻어진 실생을 이용하였으며 SSR 선발을 위해 사용하였다. SSR의 분별확인에 사용한 일반 탱자는 제주특별자치도 농업기술원 유전자원 포장의 종자 파종 실생집단을 이용하였고, SSR 적용에는 제주 도외 지역(순천시 해룡면, 34.9138°N, 127.5376°E)의 종자를 파종한 묘목업체의 집단을 이용하였다.
도외 지역 종자의 파종 육묘된 실생 집단은 파종 후 1년차 실생 집단과 2년차 정식된 묘목 집단을 이용하였으며, 각 집단은 5m 내외의 이격 거리를 두고 조성된 독립적인 포장에서 관리되었다. 파종 1년차 집단에 비해 파종 2년차 집단은 생육이 비교적 균일한 편인데, 파종 1년 후 봄에 생육이 불량한 개체를 인위적으로 분리 도태시켜 정식하기 때문이다. 그러므로 파종 1년차 실생 집단에서는 묘목의 크기를 육안으로 큰 개체와 작은 개체로 구분하였고, 2년차 정식 집단에서는 평균 크기의 개체를 50개체씩 2반복으로 임의 선정하여 잎을 채취하였다.
또한 제주대학교 부설 연구실습 포장(제주시 도련일동, 33.5042°N, 126.5873°E)에 재식된 탱자로부터 채취한 종자를 MS 고형 배지에 기내배양하여 종자의 발아특성 분석에 사용하였다.
Genomic DNA 추출
식물체의 DNA 추출은 CTAB 방법에 따라 수행하였다(Doyle and Doyle, 1990; Cheng et al., 2003; Kaul et al., 2022). ‘비룡’ 탱자 및 일반 탱자의 잎을 채취하여 액체질소를 첨가해 분쇄한 후 ‒20°C에 냉동 보관하였다. CTAB 추출 용액(99.8% 2X CTAB + 0.2% β-mercaptoethanol, v/v)을 분말에 첨가하여 교반기로 잘 섞은 후 1시간 동안 65°C의 heating block에서 가열하였다. 이후 5분 동안 4°C에서 냉각시키고 phenol: chloroform: isoamyl alcohol(25: 24: 1, v/v)을 CTAB 추출 용액과 동일한 양으로 첨가해 12,000xg에서 15분 동안 원심분리(VS-15000 CFN II, Vision scientific Co., Ltd., Korea)하였다. 그리고 상징액을 취해 새로운 tube에 옮겼으며 동일한 양의 isopropyl alcohol을 넣고 잘 혼합하여 30분 동안 ‒20°C에서 냉각시켜 DNA를 침전시켰다. 이후 동일한 조건으로 원심분리하였고 침전된 DNA pellet만을 회수한 후 70% ethanol과 100% ethanol로 차례로 세척해 건조시킨 후 TE buffer와 1μL의 RNase를 첨가하여 37°C에서 30분 동안 가열하여 DNA를 현탁하였다. 추출된 genomic DNA는 나노드롭(ND-1000, Thermo, USA)을 이용하여 농도를 측정한 후 10ng·μL-1의 농도로 정량한 다음 ‒80°C에서 보관하였다.
SSR markers 탐색 및 분석
자가수정 및 주심배 유래 구분 SSR의 개발을 위해 ‘비룡’ 탱자의 전사체 분석을 통해 얻어진 SSR 정보를 탐색하였고 57개의 primer sets(BRS01~57)를 디자인하였다. 또한 국내에서 보고된 감귤 품종 구별 SSR 53개(Woo et al., 2020)와 외국에서 보고된 탱자의 다형성 SSR 7개(Kamiri et al., 2018)를 추가하여 이용하였다(Table 1). 전체적으로 총 117개의 SSR primer sets를 탱자의 주심배 및 자가수정 유래 분석에 이용하였다(Suppl. Table S1).
Table 1.
Simple sequence repeats (SSRs) screened for identifying nucellar and self-fertilized seedlings
| Source of SSR markers | No. of markers used for screening | Reference |
| SSR markers designed by a ‘Flying Dragon’ transcriptome analysis | 57 | - |
| SSR markers for identification of citrus varieties reported in Korea | 53 | Woo et al. (2020) |
| Polymorphic SSR markers reported in trifoliate orange | 7 | Kamiri et al. (2018) |
| Total | 117 |
SSR 검정을 위한 PCR 용액의 조성은 10ng genomic DNA, 10X PCR buffer, 10mM dNTPs, 10pmol 양방향 primers, 0.5U Taq plus DNA polymerase(Dogsheng Biotech Co., Guangzhou, China)에 증류수를 첨가하여 총 20μL로 혼합하여 이용하였다. PCR 증폭은 T100TM Thermal cycler(Bio-Rad, CA, USA)를 사용하여 94°C에서 5분 동안 pre-denaturation을 실시한 뒤, denaturation은 94°C에서 10분, annealing은 52–55°C에서 1분, extension은 72°C에서 1분으로 총 35회 반복한 후 최종 extension을 72°C에서 10분간 수행하였다. PCR로 증폭된 SSR의 유형은 전기영동장치(MGU-602T, CBS Scientific, Del Mar, CA, USA)를 이용하여 2.8% agarose gel(PhileKorea, Korea)에서 전기영동 한 다음 gel documentation system(Azyre Biosystems, Dublin, CA, USA)을 이용하여 분석하였다(Kim et al., 2020).
결과 및 고찰
‘비룡’ 탱자에서 자가수정 및 주심배 유래 판별 SSR의 선발
‘비룡’ 탱자는 보통 외형적으로 뒤틀린(twisted) 줄기와 가시의 특징(Fig. 1A)을 가지고 있다. 그러나 자가수정 유래의 경우 뒤틀림의 외형적 특성이 사라져 곧은(straight) 줄기와 가시를 가지는 비뒤틀림 외형(Fig. 1B)을 가지는 것으로 알려져 있다(Cheng and Roose, 1995; Mademba-Sy et al., 2012). 그러므로 뒤틀림 외형의 식물체에서 이형접합체로 나타내는 SSR은 비뒤틀림 외형의 자가수정 식물체에서는 동형접합체로 나타낼 수 있기 때문에 자가수정 및 주심배 유래 판별이 가능할 수 있을 것이다(Fig. 2).
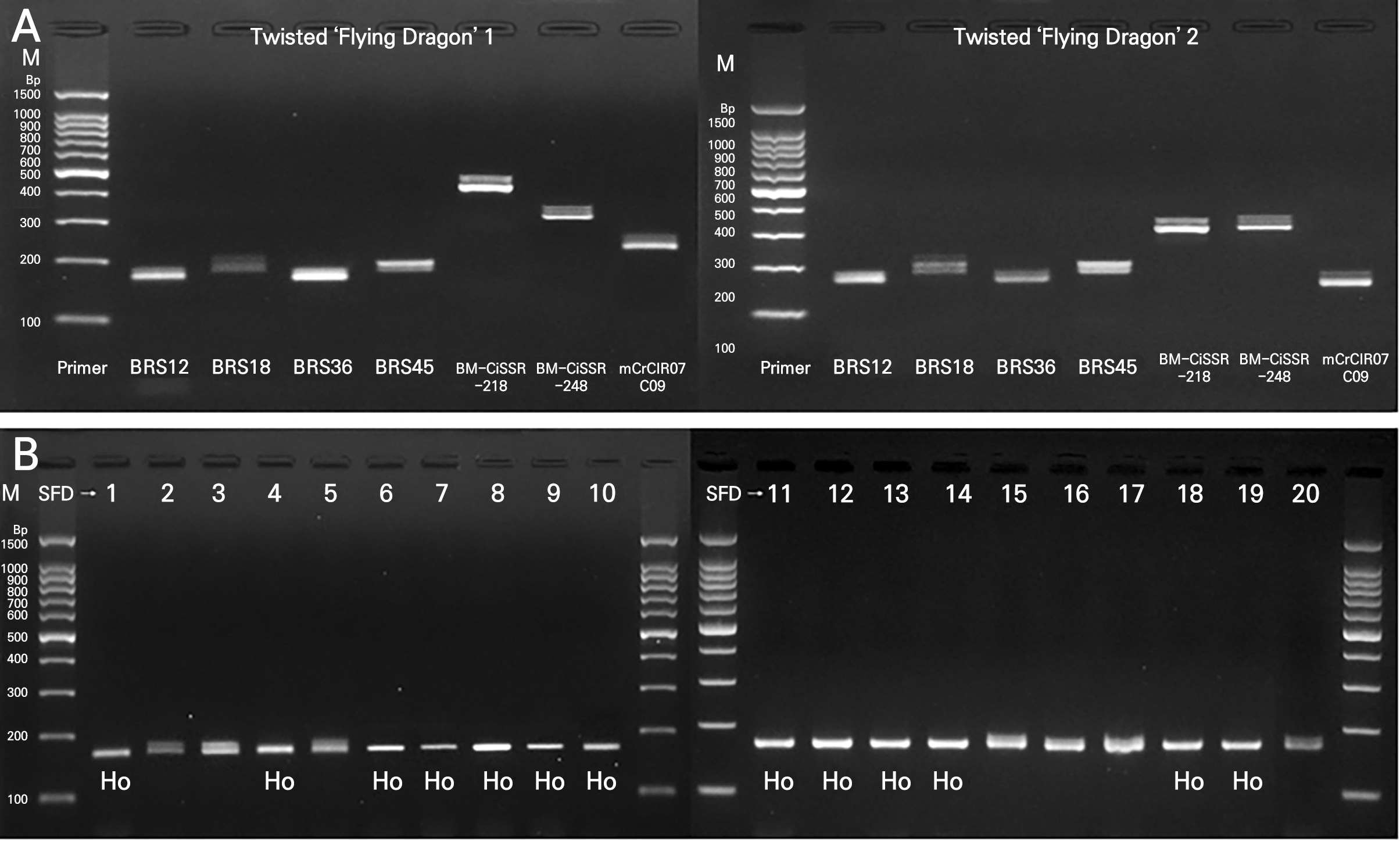
Fig. 2.
Agarose gel electrophoresis of simple sequence repeats (SSR) amplified with certain SSR primers in two representative plants of twisted ‘Flying Dragon’ trifoliate orange (A) and with BRS36 (B) in 20 plants of straight ‘Flying Dragon’. M, 100 bp molecular size marker; Ho, homozygous genotype; SFD, straight ‘Flying Dragon’.
뒤틀림 외형의 ‘비룡’ 탱자와 비뒤틀림 외형의 ‘비룡’ 탱자를 각각 20개씩 선정하여 117개의 SSR을 적용한 결과, 총 20개의 SSR primers를 1차 선발할 수 있었다(Table 2). 이 중 중복성을 최소화하고 비뒤틀림 외형의 ‘비룡’ 탱자에서 2개 이상의 SSR에서 동형접합을 나타내도록 double check이 가능한 총 7개의 SSR primers를 최종 선발하였다(Table 3). 총 20개의 비뒤틀림 식물체 중 ‘비룡’ 탱자 3번과 20번에서 선발된 SSR들이 동형접합형을 보이지 않았다. 이는 이들 식물체가 실제 자가수정 식물체이지만 선발된 SSR 영역에서는 구별되지 않는 경우이거나 또는 이들 식물체가 외형적으로 비뒤틀림으로 보였지만 실제로는 체세포 변이의 주심배일 경우의 하나로 생각된다. Khan and Roose (1988)는 탱자에서 isozyme 분석으로 자가수정과 주심배 유래를 명확히 구분할 수 있다고 하였는데, 이들 식물체에 대해서는 자가수정 및 주심배를 구분하는 isozyme 분석 등의 추가적인 연구로 확인할 필요가 있다고 생각되었다.
Table 2.
Genotyping of 20 straight primers ones with 20 simple sequence repeat (SSR) primers selected from twisted ‘Flying Dragon’ trifoliate orange plants
Table 3.
Information on the simple sequence repeat (SSR) primers selected for the identification of self-fertilized seedlings in this study
일반 탱자에서 자가수정 및 주심배 유래 판별 SSR의 적용
제주농업기술원 포장의 탱자 종자를 파종해 108개의 종자로부터 실생묘를 획득하였다. 다배성인 탱자는 한 종자에서 여러 개의 묘가 발생할 수 있는데, 한 종자에서 한 개의 묘만 자란 묘목은 88개, 두 개의 묘가 자란 묘목은 20개였다. 한 종자에서 한 개의 묘만 자란 묘목에서 임의로 40개를 선정하였고, 두 개의 묘가 자란 20개 종자의 40개 묘목을 모두 선정하여 선발된 7개의 SSR을 적용하였다.
일반 탱자 전체에서 한 종자에서 한 개의 묘만 자란 묘목 40개에서는 10개체가 동형접합을 나타내었고 두 개의 묘가 발생한 20개 탱자 종자의 40개 묘목 중 7개체가 동형접합을 나타내어 자가수정 비율은 각각 25.0% 및 17.5%로 추정되었다(Table 4). 이 중 큰 실생에서 5.0%, 작은 실생에서 12.5%가 자가수정으로 판별되어 한 종자에서 발생한 두 개의 묘목 중 큰 묘목보다 작은 묘목에서 더 많은 자가수정 유래가 나타남을 확인할 수 있었다. 이를 통해 Anderson et al. (1991)이 보고한 바와 같이, 가장 크고 빠르게 자란 실생묘는 주심배일 확률이 높고, 작은 실생묘는 자가수정일 가능성이 높은 것을 확인할 수 있었다. 이는 다배성 종자에서 수정배와 주심배 간의 공간 및 양분적 경합과 주심배 강세 현상과 관계되는 것으로 생각되었다(Koltunow, 1993; Villegas-Monter et al., 2022). 또한, 전체 일반 탱자 종자 60개에서 자란 80개 묘목의 자가수정을 판별한 결과, 17개체가 동형접합을 나타내어 21.3%가 자가수정으로 추정되었다. 이는 일반 탱자의 자가수정 유래 비율이 통상적으로 알려진 5–10% 내외보다 높은 편이었다(Khan and Roose, 1988; Roose and Prechtl, 1988). 일반 탱자에서 자가수정 유래 비율은 계통, 연차, 그리고 장소 등에 따라 다르게 나타난다고 알려져 있다(Khan and Roose, 1988; Moore and Castle, 1988). 그러므로 본 연구에서 높게 나타난 자가수정 비율이 연차 및 지역 환경과 관계되는 것인지에 대해서는 보다 상세한 연구가 필요하다고 판단되었다.
Table 4.
Frequency of self-fertilized seedlings detected by simple sequence repeats in a small sealed field
| Seedling type | No. of sowed seeds | No. of seedlings | No. of self-fertilized seedlings | Germinating order | |
| 1st | 2nd | ||||
| Single | 40 (66.7)z | 40 | 10 (25.0) | - | - |
| Double | 20 (33.3) | 40 | 7 (17.5) | 2 (5.0) | 5 (12.5) |
| Total | 60 (100.0) | 80 | 17 (21.3) | - | - |
자가수정 비율 평가는 묘목업체에서 대목용 일반 탱자 종자를 채취해 파종하여 육묘한 실생묘의 다른 집단을 대상으로도 실시하였다. 파종 1년차의 경우 자가수정 비율은 키가 큰 실생 집단에서 4.0%, 그리고 키가 작은 실생 집단에서 26.0%로 나타나 큰 묘목보다 작은 묘목에서 자가수정 비율이 높게 나타났다(Table 5). 또한 평균적으로는 파종 후 1년차 실생 집단의 경우, 자가수정 유래 비율은 15.0%로 나타나 이전 시험에서 분석된 21.3% 보다는 낮았으나 일반적으로 알려진 5–10% 내외보다는 높았다. 이는 파종 후 1년차 실생 집단에서는 실생 묘목의 크기가 불균일하여 키가 큰 실생 집단과 키가 작은 실생 집단으로 구분해 평가했기 때문이며, 키가 작은 실생 묘목에서 자가수정 비율이 높아 평균 자가수정 유래 비율에 영향을 준 것으로 보인다. 반면 파종 후 1년차의 키가 큰 실생묘는 자가수정이 4.0%로 판별되어 일반적으로 알려진 자가수정 비율에 근접했다. 한편 파종 후 2년차의 정식된 묘목 집단에서는 자가수정이 6.6%의 비율로 추정되었다. 이는 일반 탱자에서 통상적으로 알려진 5–10%의 범위에 있었으며 정식 시에 자가수정 가능성이 높은 작은 개체들을 분리하고 제외하여 재식하는 것과 관계되는 것으로 생각되었다.
Table 5.
Frequency of self-fertilized seedlings evaluated by simple sequence repeats in the first year (seedling) and second year (transplanting) in a nursery (n = 2)
| Year after sowing | Plant size | Self-fertilization frequencyz (%) |
| 1st (seeding) | Large | 4.0 ± 0.04y |
| Small | 26.0 ± 0.02 | |
| Mean | 15.0 ± 0.03 | |
| 2nd (transplanting) | Large-Small | 6.6 ± 0.02 |
SSR을 이용한 일반 탱자 종자의 기내발아 특성 평가
감귤의 다배성 종자에서 여러 개체가 발생했을 때 품종에 따라 수정배 및 주심배 유래 비율에 차이가 있는 것으로 알려져 있다(Yun et al., 2007). 이전 시험의 경우 탱자 종자에서 2개의 발아 식물체가 얻어지는 경우에는 2번째 발아 식물체에서, 그리고 묘포장 실생묘의 경우에는 작은 개체에서 자가수정 유래 비율이 높게 나타났다(Tables 4 and 5). 그러므로 추가적으로 탱자 종자를 기내 파종하여 여러 개체가 발생하였을 경우 주심배 유래의 비율과 분포에 대해 분석하였다.
기내 파종 40개의 탱자 종자로부터 11개(27.5%)의 종자에서 한 개의 실생묘가 자라 올라왔고 14개(35.0%)의 종자에서 2개의 실생묘가, 그리고 15개(37.5%)의 종자에서 3개 이상의 실생묘가 발생하였다(Fig. 3 and Table 6). 이에 대한 SSRs의 적용결과, 한 종자에서 한 개의 실생묘가 자란 경우는 11개 중 3개가 자가수정 유래로 확인되어 자가수정 유래가 27.3%로 나타났다. 한 종자에서 2개의 실생묘가 자란 경우는 14개 종자에서 발생한 식물체 28개 중 4개의 실생묘가 자가수정으로 확인되어 14.3%를 나타냈고, 모두 키가 작은 실생묘에서 자가수정으로 확인되었다. 3개 이상의 실생묘가 자란 경우에서는 15개 종자에서 발생한 식물체 56개 중 2개의 실생묘가 자가수정으로 확인되어 3.6%로 나타났다. 그 중 하나는 키가 가장 작은 실생묘에서, 남은 하나는 2번째 크기의 실생묘에서 자가수정으로 나타났다. 그러므로 총 95개의 실생묘에서 자가수정으로 확인된 실생묘는 9개로, 9.5%의 비율로 나타났다. 이 중 한 개의 실생묘가 자란 묘목에서는 3개가 자가수정 유래로 3.2%를 나타냈고, 두 개 이상의 실생묘가 자란 묘목에서는 2번째 크기의 실생묘에서 5.3%, 그리고 3번째 또는 4번째 크기의 실생묘에서 1.1%로 확인됐다(Table 6). 그러므로 한 종자에서 2개 이상의 실생묘가 발생했을 때 키가 가장 큰 실생묘는 주심배일 확률이 높고 그보다 늦게 발아한 실생묘가 자가수정으로 나타날 확률이 높았다.
Table 6.
Frequency of self-fertilized seedlings evaluated by simple sequence repeats in in vitro seedlings
| Seeding type | No. of seeds | No. of seedlings |
No. of self-fertilized seedlings | Germinating order | ||
| 1st | 2nd | 3rd or 4th | ||||
| Single | 11 (27.5)z | 11 | 3 (27.3) | 3 (27.3) | - | - |
| Double | 14 (35.0) | 28 | 4 (14.3) | 0 (0.0) | 4 (14.3) | - |
| Triple or more | 15 (37.5) | 56 | 2 (3.6) | 0 (0.0) | 1 (1.8) | 1 (1.8) |
| Total | 40 (100.0) | 95 | 9 (9.5) | 3 (3.2) | 5 (5.3) | 1 (1.1) |
이러한 결과는 자가수정 유래 실생묘가 주심배 유래 실생묘와의 경합 과정에서 생육이 저해됐기 때문으로 생각된다. Koltunow (1993)와 Aleza et al. (2010)에 의하면 다배성 감귤 종자에서 자가수정배 및 주심배의 발달 차이는 주심배의 빠른 발생 개시와 함께 영양분에 대한 경쟁 및 이용 가능성의 차이와 관계되며, 자가수정 유래는 주심배보다 생존하여 발아하기 어렵고, 발아하여도 크기가 작고 생육이 불량한 편이다. 이들 자가수정 유래의 작은 개체들은 정식 시에 인위적으로 분리되어 배제될 가능성이 매우 높다. 그러므로 정식 시에 자가수정 유래의 생육 부진 탱자묘의 일부가 인위적인 선별 과정에서 분리되어 제외되기 때문에 실제 생산되는 주심배 유래 감귤 묘목의 비율은 증가하고 대목의 균일성은 높아져 통상의 수정배 유래 비율인 5–10% 범위를 나타내게 되는 것으로 보아진다.
Supplementary Material
Supplementary materials are available at Horticultural Science and Technology website (https://www.hst-j.org).
- HORT_20240051_Table_S1.pdf
Supplementary Table S1. Sequences of Simple Sequence Repeat (SSR) Primers Screened to Identify the Nucellar and Self-Fertilized Origin in Trifoliate Orange Seedlings




