서 언
재료 및 방법
식물체 및 처리
수관내 광환경 조사 및 시료 채취
과실 특성 평가
RNA 분리 및 Real-Time PCR
통계처리
결과 및 고찰
반사필름이 광합성유효방사(PAR)에 미치는 영향
반사필름처리에 의한 과실 특성 변화
반사필름에 의한 과실의 안토시아닌 합성 및 성숙 관련 유전자 발현의 변화
서 언
국내에서 복숭아는 20,000ha 이상의 재배면적에서 20여만 톤이 생산되는 주요 과수산업으로 매년 생산량이 증가하고 있다(KATI, 2019). 대부분의 복숭아 과실은 호흡급등형으로 성숙 과정에서 세포에서는 다당체의 분해 또는 변형과 과피의 착색과 관련된 다양한 효소의 활성이 증가하여 과육의 연화가 빠르게 진행된다(Pressey and Avants, 1973; Yoshioka et al., 1992; Orr and Brady, 1993; Brummell et al., 2004; Hayama et al., 2006; Guo et al., 2013). 그러나, 복숭아 과실의 연화가 빠른 진행에 비해 과피는 느리게 착색되기 때문에 과피의 착색이 진행된 복숭아 과실은 과육이 무르게 되어 취급과 유통은 물론, 최근 증가하고 있는 해외로의 수출에도 어려움을 초래하고 있다(KATI, 2019).
또한 무대재배와 유대재배를 통하여 생산된 복숭아 과실의 과피색이 불량하거나 착색이 지연되어 상품성 하락의 중요한 원인이 된다(Zhang et al., 2013). 국내에서도 고품질의 복숭아를 생산하기 위하여 새로운 품종을 육성하고 다양한 재배기술을 개발하여 품질 향상과 보구력증진을 꾀하고 있으나 과실의 과피색 불량 및 과숙에 의한 과육 연화 등으로 인해 품질이 불량하여 시장과 소비자에 의한 복숭아 선호도가 낮다(KREI, 2020). 따라서, 과피의 착색 증진을 위한 봉지씌우기, 이중봉지 활용, 적심, 수확 전 전정, 반사필름 활용 등의 기술을 적용하고 복숭아 과실의 보구력 향상을 위한 다양한 연구가 진행되고 있다(Du et al., 1997; Kim et al., 2003; Park and Yoon, 2012; Lee et al., 2019; Lee et al., 2020).
과실의 성숙이 진행되는 시기에 과원의 지표면에 반사필름을 멀칭하면 과피의 착색을 촉진하여 외관과 품질을 향상시킬 수 있기 때문에 반사필름을 활용하여 과실의 품질을 개선하기 위한 연구가 활발히 진행되어 왔다(Andris and Crisosto, 1996; Miller and Greene, 2003; Iglesias and Alegre, 2009; Shi et al., 2011). 반사필름은 복숭아 나무 수체 내부의 광환경을 개선하여 잎의 광합성 효율(Zhou and Wang, 2009)과 과피의 착색(Layne et al., 2001; Layne et al., 2002; Zhang et al., 2013) 을 모두 향상시킬 수 있다고 보고되었다. 이러한 수체 내의 광환경 개선에 의한 과실의 착색 증진은 상품성 향상과 생산량 증대에 매우 유용할 것이다.
내수시장에서의 유통 과정뿐만 아니라 외국으로의 수출 과정에서 복숭아 과실은 과피색이 우수한 고품질을 유지하고 유통 기간의 연장이 요구된다. 복숭아 산업에서 고품질 과실을 생산하고 유통기한을 연장하기 위해서는 과실의 성숙과 더불어 성숙 초기에 과피의 착색을 촉진시킬 수 있는 기술을 개발하는 것이 중요하다. 그러므로, 본 연구는 복숭아 과피의 착색을 개선하기 위하여 포장에서 재배되는 복숭아 나무에 과실의 수확기 전에 반사필름을 처리하고, 과실의 과피색 및 특성, 성숙 관련 유전자의 발현 등에 미치는 영향을 조사하고자 수행하였다.
재료 및 방법
식물체 및 처리
본 연구는 2018년과 2019년에 영남대학교 시험포장(경북 경산시 소재)에 식재된 7년생 복숭아(품종: Taiko) 나무를 사용하여 진행되었다. ‘Taiko’ 품종은 일본에서 ‘Yuuzora’와 ‘Akatsuki’를 교배하여 육성되었으며, 과중은 400~500g으로 대과 품종으로, 과형은 편원형이고, 과피는 무대재배에서 노랑 바탕에 짙은 홍색으로 착색이 양호하며, 과육은 홍색을 띤 유백색이다. 복숭아 과실 수확 7일전 과수의 열간을 따라 수체 밑의 지표면에 반사필름(폭 2m, 두께 0.02cm, 스노우텍스, Nissan Chemical)을 멀칭하였다. 필름을 처리하지 않은 부분의 수관과 수관 내의 과실을 대조구로 사용하였다.
수관내 광환경 조사 및 시료 채취
과원의 지표면에 반사필름을 멀칭하고 수확 전날 오전 9시, 오후 1시, 오후 5시에 복숭아 나무 수관 내 광합성 활성 방사선(PAR)을 과실의 상부와 하부에서 측정하였다. 비슷한 위치에 있는 과실을 수확하여 과실의 특성을 조사하였다. 과실은 과피 부위를 0.5mm두께로 잘라내어 액체질소에서 급속하게 냉동하고 -80°C 냉장고에 보관하였다.
과실 특성 평가
반사필름을 처리한 복숭아 나무의 과실을 수확하여 과실의 과피색, 가용성 고형물 함량(SSC), 적정산도(TA), 경도(N)를 측정하였다. 과피색은 전체적인 과실의 착색 정도를 보기 위해 복숭아 과실의 적도면을 중심으로 상부, 중부, 하부를 무작위로 색도계(CR-300, MINOLTA, Japan)로 측정하였다. 가용성 고형물 함량은 과육을 착즙하여 과즙을 디지털당도계(PAL-1, ATAGO, Japan)로 측정하여 °Brix로 나타냈다. 적정산함량은 복숭아 과즙 3mL를 증류수 30mL에 희석하고 디지털 과일 산도계(GMK-835N, (주)GMK, Korea)를 이용하여 %로 나타냈다. 과실의 경도를 측정하기 위해 과실의 적도부위의 과피를 제거한 후 11mm probe를 장착한 과실경도계(ETS-FG2V, POLYGON, China 와 EFG-1000, ENPAIX, China)를 사용하여 Newton(N)으로 나타내었다.
RNA 분리 및 Real-Time PCR
복숭아 과피와 과육에서 RNA분리는 Chang et al.(1993)과 Hu et al.(2002) 방법에 의해 수행되었다. Nano Drop spectrophotometer (ND-1000, Technologies Inc., Wilmington, DE, USA) 을 이용하여 RNA 정량 후 희석하였다. 희석된 total RNA (500ng) 으로 부터 Go Script TM Reverse Transcription System (Go Script TM Reverse Transcription System, Promega, Madison, USA) 를 통해 cDNA로 합성하였고, 이 cDNA를 이용하여 real-time PCR을 수행했다. real-time PCR실험에는 SYBR Premix Ex (SYBR Premix Ex Taq, TaKaRa Bio Inc., Osaka, Japan)을 사용하였다. 반응 조건은 95°C에서 30초, 95°C에서 5초, 60°C에서 30초의 조건으로 총 40회 반복하였다. Transcipt 수치는 복숭아의 Actin gene을 대조구로 사용하여 표준곡선을 통해 나타내었으며 이 수치를 유전자 발현 값 분석 data로 이용하였다. Quantitative real-time PCR (qRT-PCR)에 의한 안토시아닌 생합성 관련 유전자(F3H 및 CHS)와 에틸렌 생합성 관련 유전자(ACO 및 ERS1), 성숙 관련 유전자(PL 및 PME)의 유전자 발현 조사를 하였다(Table 1).
Table 1.
Accession numbers from NCBI and primer nucleotide sequences of primers used for real-time PCR analysis in this study
| Gene | NCBI Accession no. | Primer sequences |
| 1-aminocyclopropane-1-carboxylic acid oxidase (ACO) | XM_007215636.2z |
5’-CAATGGAGAGGGAAGAAAAGCA-3’ 5’-CTCAAAGAAGCCCCAGTTCTCA-3’ |
| Ethylene response sensor 1 (ERS1) | XM_007199675 |
5’-AGGGAGCATTGTTGCATTCATT-3’ 5’-TGGTTGTGGTTGTGGTTGTGGTA-3’ |
| Polygalcturonase (PG) | XM_007213822.2* |
5’-AACTCAGCCATAGCCACTCCAG-3’ 5’-CAGAGAGGAAGGCTTTTGTGGA-3’ |
| Polygalcturonase-like (PGL) | XM_007213828.2 |
5’-AACTCAGCCATAGCCACTCCAG-3’ 5’-GAGGAAGGCTTTTGTGGAGTCA-3’ |
| Pectin methylesterase (PME) | AB231903 |
5’-CCGGGAAGCTTTCTGATCTTTT-3’ 5’-CCTGGATAGCTCCCTTTTGCTT-3’ |
| Chalcone synthase (CHS) | XM_002303785.3 |
5’-ATCTCCGTGAAGTTGGGCTTACATTT-3’ 5’-GTGTGCAATCCAGAATAGTGAGTTCCA-3’ |
| Flavone 3-hydroxylase (F3H) | JQ717267.1 |
5’-GGAGCAACAATTGCAGGACT-3’ 5’-CATCCACTGGCTAAGCACAT-3’ |
통계처리
통계분석은 Excel 데이터분석으로 t-검정(쌍체비교)를 실시하였고, 모든 데이터는 Duncan으로 (p < 0.05)으로 검정하였다.
결과 및 고찰
반사필름이 광합성유효방사(PAR)에 미치는 영향
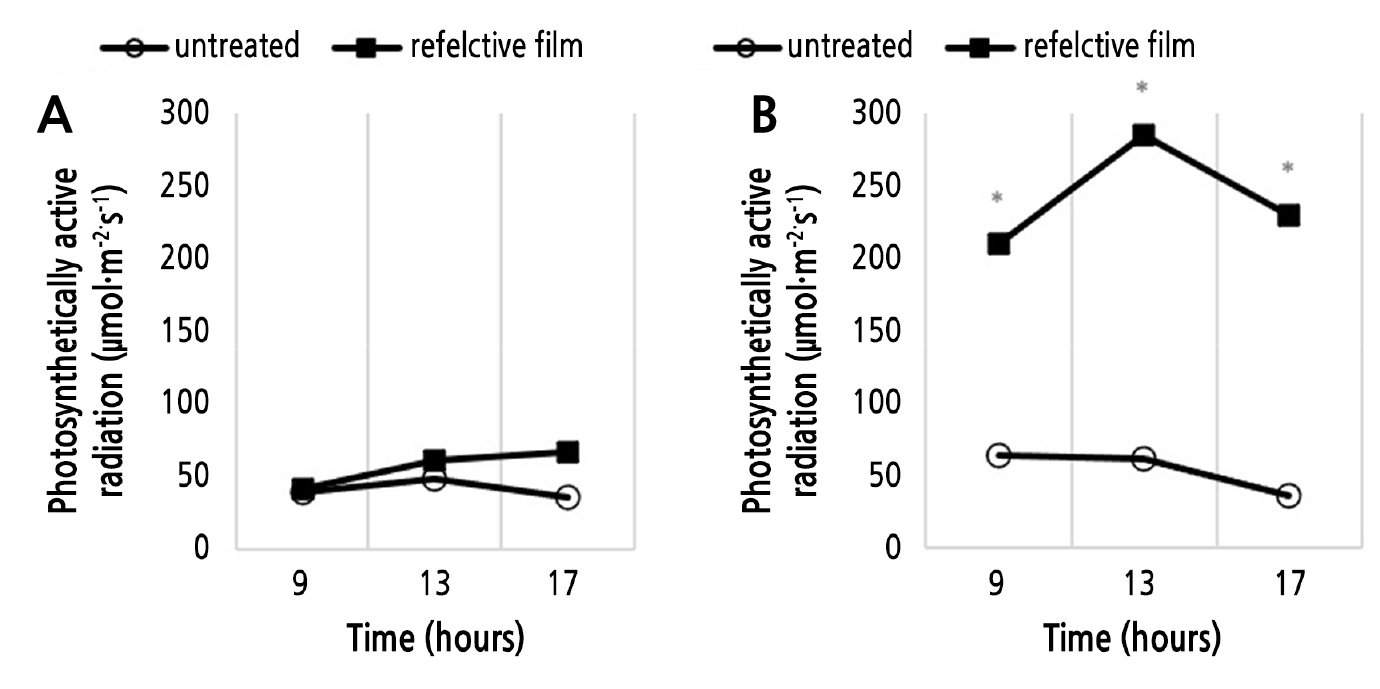
지표면에 반사필름을 멀칭한 수체와 처리하지 않은 수체의 수관 내부의 광도를 측정하였다. 과실의 상부에서 받는 광량은 반사필름을 처리한 수관의 내부에서 약간 높게 나타났다. 또한 과실의 하부에서 측정한 광도는 무처리구에 비해 반사필름을 처리한 수관에서 현저하게 높게 나타났다. 이는 지표면에 설치된 반사필름에 의해 수관 내부에 도달하는 광량이 현저하게 증가하였기 때문으로 사료된다. 반사필름을 처리한 후 24시간 내 시간대 별 광량 차이를 비교한 결과, 과실의 상부에서 측정된 오전 9시와 오후 1시의 광량은 처리 간의 큰 차이를 확인할 수 없었으나, 오후 5시의 경우에는 처리 간에 차이를 보였다. 과실의 하부에서는 측정된 모든 시간대에서 무처리에 비해 반사필름을 사용하였을 때 과실에 현저하게 많은 광량이 도달하였다(Fig. 1). 이러한 결과를 볼 때, 반사필름 처리에 의해 복숭아 나무의 수관 내부에 광량의 증가로 인하여 과피의 착색이 촉진될 수 있을 것으로 여겨진다.
반사필름처리에 의한 과실 특성 변화
빛은 광합성의 원동력으로 빛의 가용성은 양질의 과실을 생산하는 데 중요하며, 광합성은 과실의 발달과 당축적을 위한 에너지를 제공하며 안토시아닌 축적에도 필수적이다(Hopkins, 1999). 반사필름 처리에 의한 과실의 특성 변화를 비교한 결과, 반사필름을 처리한 수체에서 수확한 과실의 가용성 고형물 함량과 적정산도는 2018년과 2019년 모두 무처리 수체에서 수확한 과실과 비슷한 수준을 유지하였고 과실의 경도 또한 비슷한 경향을 나타냈다(Table 2). 과실의 과피색을 조사한 결과, 2018년과 2019년 상부, 중부, 하부에서 비슷한 경향을 나타냈다. 반사필름을 멀칭한 처리구와 무처리구의 과실 상부에서 Hunter L, a, b 값은 차이를 나타내지 않았다. 그러나 과실의 중앙부와 하부에서는 반사필름을 멀칭한 과실의 하부에서는 Hunter a값이 현저하게 높게 나타났다(Table 2). 이와 같은 결과로 반사필름을 멀칭한 수체의 수관에서 과피색이 더 붉게 착색 되는 것을 확인할 수 있었다(Fig. 2). 2018년과 2019년에 수행한 시험에서 모두 비슷한 경향의 결과를 얻었다. 이상의 결과로서 반사필름을 지표면에 멀칭함으로써 과실의 가용성 고형분 함량 및 적정산도와 경도에 큰 영향을 미치지 않고 과실의 과피 착색을 촉진한다는 것을 확인할 수 있었다.
Table 2.
Fruit characteristics of ‘Taiko’ peach as affected by reflective film mulching before harvest
반사필름에 의한 과실의 안토시아닌 합성 및 성숙 관련 유전자 발현의 변화
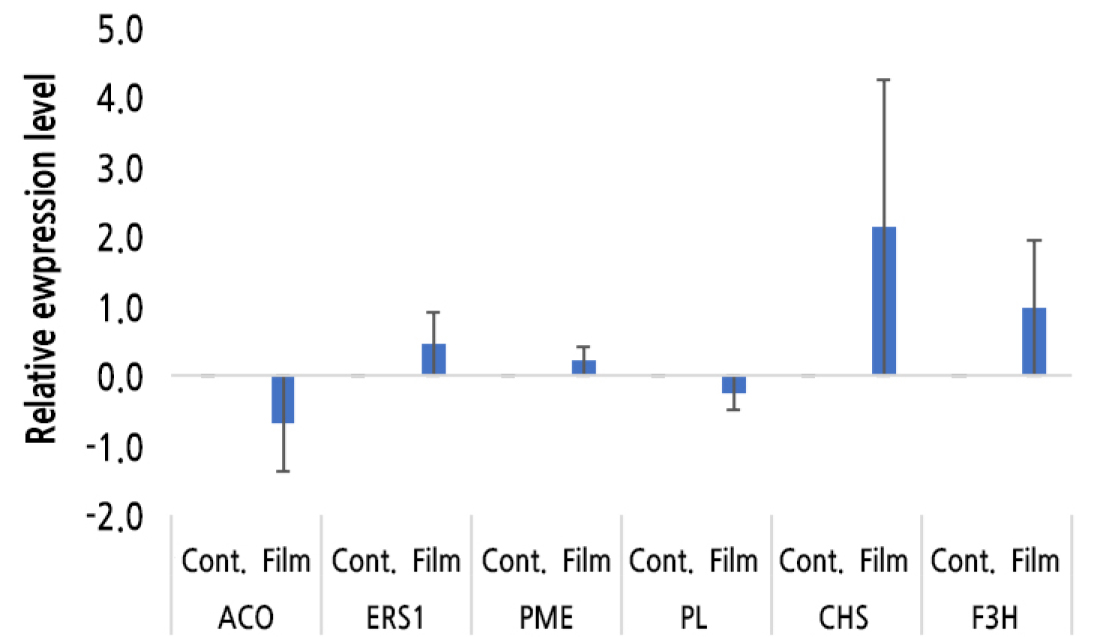
반사필름 처리에 의한 과실의 유전자의 발현 변화를 비교하기 위하여, 에틸렌 생합성에 관여하는 유전자 ACO와 에틸렌에 반응하는 유전자인 ERS1, 세포벽 분해와 관련된 유전자인 PL와 PME, 안토시아닌 합성과 관련된 유전자인 CHS와 플라보노이드 관련 유전자인 F3H의 발현을 분석하였다. 반사필름 처리에 의해서 과실의 성숙과 관련된 유전자인 ACO, ERS1, PL, PME의 유전자 발현은 큰 변화가 없거나 오히려 약간 감소하였고, 과피의 착색과 관련된 유전자인 CHS 및 F3H 유전자 발현은 반사필름을 처리한 과실에서 현저하게 높게 유도되었다(Fig. 3). 반사필름을 처리한 과실에서 성숙 관련 유전자(ACO 와 ERS1, PL와 PME)의 발현은 낮게 유지되는 반면에 과실의 착색과 관련된 유전자(CHS와 F3H)의 발현이 유도되는 것은 반사필름 처리에 의해 CHS, F3H 와 같은 안토시아닌 축적 관련 유전자와 플라보노이드 합성 관련 유전자 발현이 유도되어 복숭아 과피의 안토시아닌과 플라보노이드 축적이 진행되어 착색이 촉진된다는 것을 의미한다고 할 수 있다.
빛은 과실의 안토시아닌 축적을 통한 양호한 과피의 착색에 필수적인 환경조건으로서(Saure, 1990; Green et al., 1995), 특히 과수는 빛에 대한 의존도가 크며, 태양에 노출된 과실일수록 과피색은 적색을 띄게 된다(Marini et al., 1991; Song et al., 2014; Rahim et al., 2020). 복숭아 과피의 착색을 유도하기 위하여 수확 직전에 과실을 햇빛에 노출 시킬 수 있는 다양한 기술이 이용되고 있다(Marini et al., 1991; Myers, 1993; Andris and Crisosto, 1996). 반사필름 처리는 과실의 과피색과 크기, 꽃눈형성, 과실의 견고성, 가용성 고형물 함량 및 과실의 성숙 촉진 등에 영향을 미친다(Layne et al., 2001; Blanke et al., 2011). 복숭아 과실은 성숙이 진행되면서 과피색이 노란색 또는 적색으로 변화하며, 과피와 조직의 연화 및 가용성 고형물 함량의 증가가 수반된다(Delwiche and Baumgardner, 1983, 1985; Byrne et al., 1991; Krishna et al., 2020).
수관 하부에 반사필름을 멀칭하면 바닥으로 들어오는 빛을 수관 내부로 다시 반사하여 과실에 대한 광분포가 개선되고 빛의 강도가 증가하며 투광 시간이 연장되어 과실의 하부에 안토시아닌 축적을 촉진한다(Ju, 1991). 수관 내부의 광환경 개선은 광합성 효율과 과실의 탄소동화 작용을 증가시켜 안토시아닌의 합성을 간접적으로 촉진하며, 색소 생성에 관여하는 PAL 과 UFGT의 활성을 증가하도록 유도하여 안토시아닌의 합성을 촉진한다(Lancaster and Dougall, 1992; Williams, 1993; Ju et al., 1995; Shin et al., 2020). 반사필름을 멀칭하지 않은 수체에 비하여 수관 하부에 반사필름을 멀칭한 수관에서 과실에 도달하는 광환경이 개선되고 착색이 빠르게 촉진되었으며, 이러한 결과는 이전의 연구 결과와 일치하는 것이다(Andris and Crisosto, 1996; Ju et al., 1999; Glenn and Puterka, 2007; Zhang et al., 2013).
또한 과실의 색소 축적은 과실내에서 DFR, CHS, F3H와 같은 안토시아닌의 축적과 관련된 유전자의 발현에 의해 조절되는데 반사필름 처리에 의해서 안토시아닌 생합성 관련 유전자 CHS와 F3H의 발현 수준이 높게 나타났다. 이러한 결과는 이전의 연구 결과와 일치하는 것이다(Andris and Crisosto, 1996; Ju et al., 1999; Glenn and Puterka, 2007).
과수의 수관 내부의 광량이 증가함에 따라 가용성 고형물 함량이 증가하는데, 본 연구에서 반사필름을 처리한 수체의 과실 가용성 고형물 함량은 크게 증가하지 않았다. 이는 수관 내부로의 투광률 향상과 투광 시간의 연장으로 광합성량이 증가하고 탄소동화작용에 의한 간접적으로 안토시아닌 축적이 유도되고, 안토시아닌 합성과 관련된 유전자의 발현이 유도되었기 때문으로 여겨진다(Lancaster and Dougall, 1992; Williams, 1993; Ju et al., 1995).
반사필름에 의한 수체내의 광량의 증가는 복숭아 과실의 성숙을 촉진시키지만, 성숙 촉진보다는 조기에 과피의 착색과 관련된 유전자의 발현을 유도하여 안토시아닌 합성과 축적을 촉진함으로써 과피의 착색을 유도한 것으로 여겨진다. 또한 수확 7일 전 멀칭하여 복숭아 과실의 조기 착색을 유도함으로써 과피색을 개선하여 고품질과실을 생산하는 데에 기여하고, 조기수확을 통하여 유통기간을 연장함으로써 매년 꾸준히 증가하고 있는 해외 수출에도 기여할 것으로 기대된다.