서 언
재료 및 방법
식물재료
RNA 추출 및 Reverse Transcription Polymerase Chain Reaction (RT-PCR)
전자현미경 관찰
결과 및 고찰
바이러스 감염현황
CymMV와 ORSV 감염주의 증상 및 바이러스 입자 관찰
서 언
난초과(Orchidaceae)에 속하는 호접란(Phalaenopsis)은 MAFRA(Ministry of Agriculture, Food and Rural Affairs)에 의하면 2018년 기준 국내 난류 전체 재배면적의 31.6%, 판매량은 난류 전체의 37.5%를 차지하는 주요 화훼작물이다. 국내 호접란의 재배면적은 2003년에 72.5ha로 정점을 찍었으나, 그 후 계속 감소하여 2017년과 2018년에는 38ha로 급감하였다(MAFRA, 2019). 2016년 9월 말부터 시행된 청탁금지법의 영향으로 난 수요가 급감하였으며, aT(Korea Agro-Fisheries & Food Trade Corporation) 공판장 경매 금액은 23.65억 원(2015년 10월-2016년 9월)에서 18.3억 원(2016년 10월-2017년 9월)으로 동일 기간 전년 대비 22.5% 감소하였다(aT, 2015-2017). 호접란의 유통구조는 대부분 선물용으로 소비되는 특성을 보이고 있어 청탁금지법의 직접적인 영향을 받을 수밖에 없다. 또한, 청탁금지법은 최근 국내·외 경제 활동 침체와 더불어 국내 화훼시장의 활성화에 부정적인 영향이 되고 있다. 국내 화훼농가의 안정적인 생산활동과 소득창출을 위해 화훼시장을 활성화해야 하며 국외를 포함한 시장의 다변화가 하나의 방편이 될 수 있다.
한국산 난의 미국 수출은 2000년경 미국 플로리다 주와 캘리포니아 주에 수출전진기지를 설립하면서부터 시작하였고 미국의 검역시스템에 의해 기내배양묘나 뿌리를 씻은 어린 혹은 중간묘(bare root) 상태로 수출해 왔다. 그러나 미국 현지에서 활착의 어려움과 묘 손실률 증가로 인해 품질 하락, 개화주 생산기간 증가 등의 문제점이 있었다. 반면, 대만의 경우에는 2004년 미국과 검역협정으로 분화 상태의 개화주 수출이 가능해 15년 이상 안정적인 대미 수출을 확립해 오고 있다. 지난 2016년 하반기, 미국과의 호접란 및 심비디움 분화류 수출 검역 협상이 타결됨에 따라 이들 난류의 수출이 보다 용이하고 활성화될 수 있는 계기가 마련되었다(APQA, 2017). 2018년 이후 미국 농무성 승인을 얻은 수출 온실 두 곳에서 미국 플로리다 및 캘리포니아 지역으로 호접란 분화 수출을 시작하였지만, 수출 안정과 가격 및 국제 경쟁력 확보를 위해서는 우량 품질의 묘를 안정적으로 지속해서 생산하는 것이 무엇보다 중요하다.
기내 배양묘의 생산과 재배 조건의 최적화가 생산 품질에 영향을 주지만(Kwon et al., 2018; Lee et al., 2018; Lee et al., 2019), 난 재배에 있어 큰 문제점 중 하나는 바이러스 감염이다(Chang et al., 1991a, 1991b). 한번 바이러스에 감염되면 치유가 거의 불가능해 해를 거듭할수록 생장이 지연되고 품질저하로 관상가치가 떨어질 뿐만 아니라 품종퇴화의 주된 원인이 된다(Chang, 1998). 전 세계적으로 난초과에 발생하는 바이러스는 약 27여 종이 보고되어 있고(Chang et al., 1991a, 1991b; Koh et al., 2014), 국내에서는 약 7종이 확인되었다(Chang et al., 1991a, 1991b). 호접란에서는 7종의 바이러스가 보고된 바 있으며(Zheng et al., 2010), 이 가운데 호접란에서 가장 빈번하게 발생하고 큰 피해를 주는 바이러스는 Cymbidium mosaic virus(CymMV)와 Odontoglossum ringspot virus(ORSV)이다(Zettler et al., 1990; Chang et al., 1991a, 1991b; Ryu et al., 1998). CymMV에 감염된 식물체에서는 잎과 꽃에 백화, 괴저 증상이 나타나고 ORSV감염에 의해서는 잎의 윤문 또는 퇴록 줄무늬 등 모자이크 증상이 나타난다. 또한 이들 바이러스에 감염되면 꽃의 꽃잎과 꽃받침에 화색변이가 나타나기도 한다(Zettler et al., 1990; Chang et al., 1991a, 1991b; Ryu et al., 1998; Chung et al., 2010; Koh et al., 2014).
2016년 미국과의 검역협상으로 호접란과 심비디움의 분화 채 수출이 가능해졌다. 따라서, 미국 수출을 진행하고 있는 농가 기업에서 배양 또는 재배 중인 호접란의 CymMV와 ORSV 감염 실태를 파악하여 이를 토대로 농가 기업이 향후 무병묘 배양체계 또는 건전묘 재배기술을 확립하고 수출 품질을 관리하는 데 기여하고자 하였다.
재료 및 방법
식물재료
국내 생산묘의 바이러스 감염 실태를 조사하기 위해 경상남도, 경기도, 충청남도 3곳으로부터 기내배양묘 45품종(경상남도 비올라킹 외 13품종, 경기도 T1 외 20품종, 충청남도 만천홍 외 9품종) 140개체와 온실에서 재배 중인 분화묘 21품종(경상남도 브라보스타 외 12품종, 경기도 V3 외 3품종, 충청남도 미니화이트 외 4품종) 93개체의 잎을 수집했으며, 대만에서 수입한 ‘V3’ 품종 기내배양묘 30개체를 국내 생산묘 바이러스 검정 결과에 대한 대조구로 사용하여 바이러스 검정을 하였다. 바이러스 이병주 시료는 국립농업과학원 작물보호과에서 분양받아 대조구로 사용하였다.
RNA 추출 및 Reverse Transcription Polymerase Chain Reaction (RT-PCR)
호접란 잎에서 Gent pure RNA Kit(Dojindo Molecular Technologies, INC., Japan)를 사용하여 RNA를 추출하였다. 추출한 RNA 1µg을 주형으로 하여 ReverTra Ace -α-® (TOYOBO Co., Japan) kit를 사용하여 cDNA를 작성하였다. PCR증폭은 cDNA 1µL, 2x PCR Bio Taq Mix Red(PCR Biosystems, United kingdom) 그리고 CymMV나 ORSV에 특이적인 프라이머(Primer)를 사용하여 95°C 15초(denature), 55°C 15초(annealing), 72°C 30초(extension)의 조건에서 35cycles로 수행하였다. 411bp CymMV 단편 검출에는 CymMV-PF2(5’-CCC TCC ACC TTC ATA TTC CTT-3’)/CymMV-PR2(5’-CCC GAG AGT CAA CCA CTG CA-3’) 프라이머 쌍을 사용하였고 202bp ORSV 단편은 ORSV-PF2(5’-GTT TTA AAT CAC ATC CGT ACC T-3’)/ORSV-PR2(5’-CGA CTT GAT CTT TTG CTT CA-3’) 프라이머 쌍을 사용하였다. RNA 추출에 대한 Internal control 유전자로 호접란의 Actin(ACT4, JN185658) 유전자를 사용하였으며, 356bp의 ACT4단편을 Orchid- ACT-F1(5’-ACA GGT ATT GTG CTT GAT TCT GG- 3’)/Phal-ACT4-R1(5’-ATC ATG GAT GGT TGG AAA AGG AC-3’) 프라이머 쌍으로 바이러스 검출과 동일한 조건에서 증폭하였다. PCR산물을 2% Agarose gel에 전기영동하여 UV light로 관찰하였다.
전자현미경 관찰
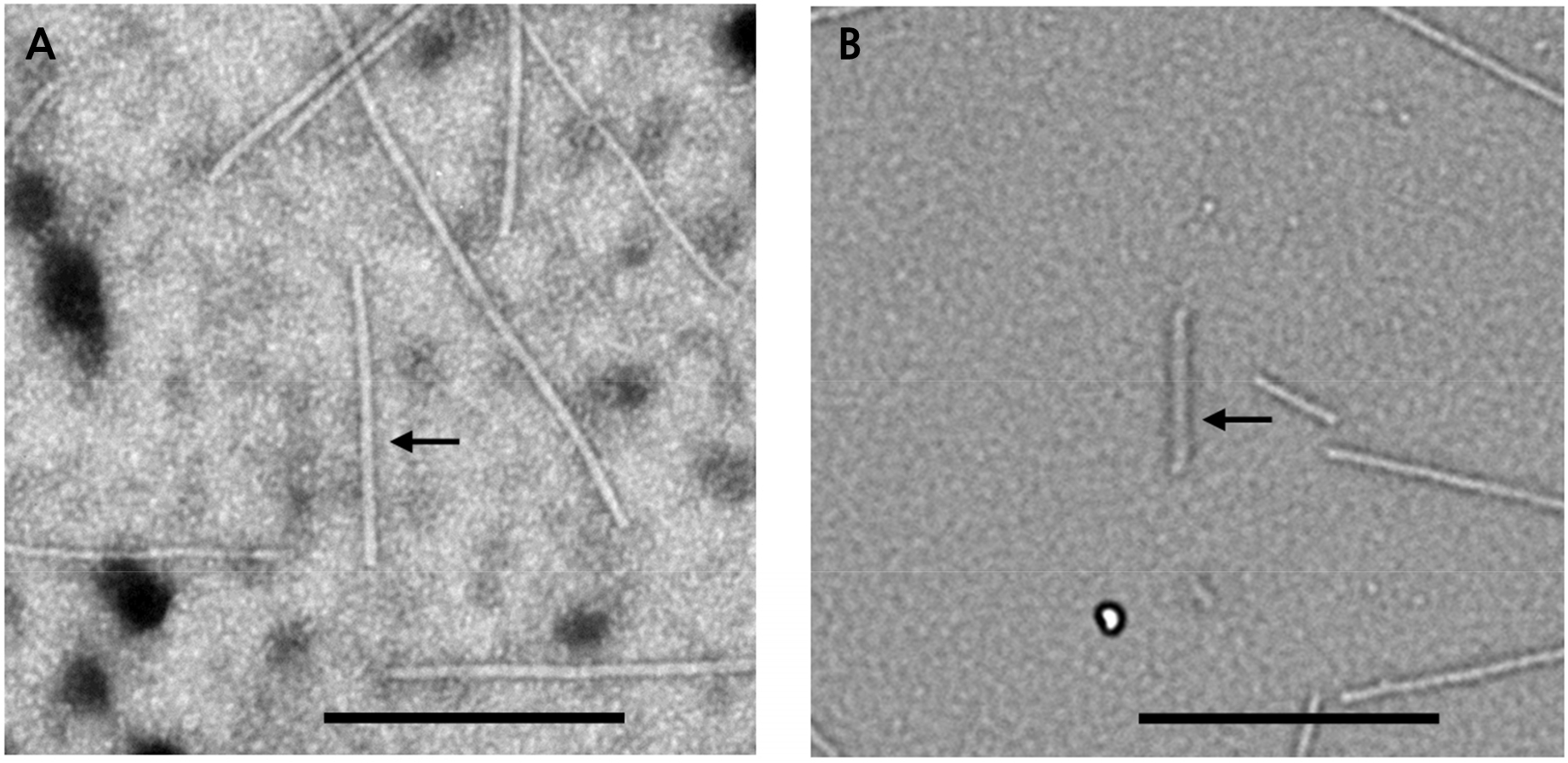
바이러스 입자의 관찰은 Direct negative staining method(DN법)에 의해 투과전자현미경(Hitachi H-7600, Japan)으로 관찰하였다. CymMV와 ORSV에 감염된 식물체의 잎 조직을 가로세로 각각 1cm 크기로 잘라내 면도날로 잘게 절단하였다. 절단면의 즙액에 Grid를 1분간 처리한 후 UranyLess EM Stain(Electron Microscopy Sciences, U.S.A.)으로 1분간 염색하고 5분동안 건조하여 투과전자현미경으로 관찰하였다.
결과 및 고찰
바이러스 감염현황
RT-PCR 검증을 위해 CymMV(EF125180)와 ORSV(NC001728)의 염기서열 정보로부터 각각 411bp와 202bp의 단편을 증폭하기 위한 바이러스 검출용 프라이머를 작성하였고, 추출한 mRNA에 대한 대조구로 팔레놉시스 ACT4(JN185658) 유전자의 356bp단편 검출용 프라이머를 작성하였다. 임의로 선발된 10개체의 호접란 시료를 사용하여, 각 프라이머의 목표 단편 증폭을 RT-PCR로 확인하였다(Fig. 1). 역전사효소(Reverse transcriptase, RT)를 처리하지 않은 시료에서는 PCR산물이 확인되지 않았고 RT 처리한 시료에서는 두 바이러스 및 ACT4에 해당하는 PCR증폭 산물이 확인되었으며, 이병주와 무병주의 구별이 가능하였다(Fig. 1). 따라서 이들 프라이머와 대조구 시료를 바이러스 검정을 위해 사용하였다.
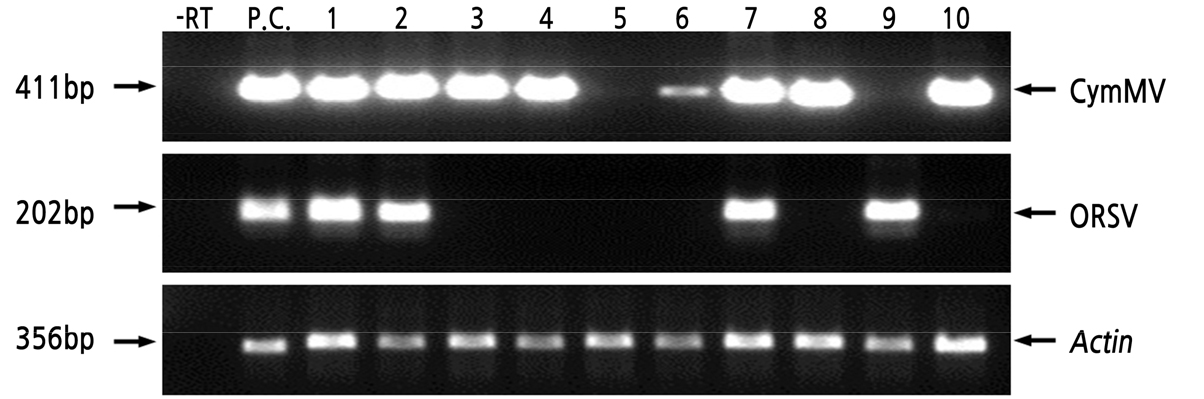
Fig. 1.
RT-PCR analysis of CymMV (Top) and ORSV (middle). -RT, an RNA sample not treated with reverse transcriptase (RT); P.C., a positive control; lanes 1–10, individual Phalaenopsis samples tested. The ACT4 gene (bottom) of Phalaenopsis was used as an internal control for each RNA sample (see materials and methods).
먼저, 국내 배양묘와 대만에서 수입한 ‘V3’ 배양묘의 바이러스 감염 상태를 확인하였다(Table 1). 국내 기내배양묘의 바이러스 감염률은 83.6%, 감염되지 않은 건전주는 16.4%였다. CymMV와 ORSV의 단독감염률은 각각 34.3%, 11.4%였고 두 바이러스에 대한 중복 감염률은 37.9%로 나타났다(Table 1). 2010년경 국내 호접란 기내배양묘 55개체를 검정한 결과, CymMV와 ORSV감염률이 각각 9%, 32.7%로 CymMV 감염률 보다 ORSV감염률이 더 높았으나(Chung et al., 2010), 이번 실험에서 사용된 국내 호접란 기내배양묘는 전체적인 수치에서 CymMV의 감염률이 ORSV보다 더 높은 것으로 나타났다. 대만에서 수입한 호접란에서 CymMV 감염률이 높다는 보고가 있었으나(Yun et al., 2000), 최근 대만에서 수입한 ‘V3’ 기내묘 30개체 모두에서 CymMV 및 ORSV에 감염되지 않은 것으로 나타났다(Table 1). 현재 대만에서는 호접란 수출을 위해 이 두 바이러스에 대해서는 무병 호접란 생산 체계가 구축된 것으로 판단된다.
Table 1.
Detection of CymMV and ORSV in Phalaenopsis cultured in vitro
| rowspan="2" align="center"> Origins | No. of samples | No. of virus-infected plants (%) | |||
| CymMVz only | ORSVy only | CymMVz and ORSVy | Overall virus infection | ||
| Imported from Taiwan | 30 | 0 (0) | 0(0) | 0 (0) | 0 (0) |
| Gyeongnam | 41 | 7 (17.1) | 0(0) | 32 (78.0) | 39 (95.1) |
| Gyeonggi | 63 | 35 (55.6) | 7(11.1) | 7 (11.1) | 49 (77.8) |
| Chungnam | 36 | 6 (16.7) | 9(25.0) | 14 (38.9) | 29 (80.6) |
| Total | 140 | 48 (34.3) | 16(11.4) | 53 (37.9) | 117 (83.6) |
국내 온실에서 재배하고 있는 호접란 분화묘에 대한 바이러스 검정 결과를 보면, 전체 바이러스 감염률은 92.5%, 건전주는 7.5%로 온실에서 재배 중인 호접란의 바이러스 감염률이 매우 높게 나타났다. CymMV와 ORSV의 단독감염률은 각각 57.0%, 0%였고 중복감염률이 35.5%로 ORSV 단독감염주는 확인되지 않았다(Table 2). 2000년 이전에 조사된 결과를 보면, 국내에서 재배하는 호접란의 CymMV와 ORSV 감염률은 각각 15-21.4%, 5-10.7%로 보고되었지만(Park et al., 1998; Ryu et al., 1998), 이번 연구에서는 조사를 위해 수집한 세 곳 모두에서 40% 이상의 CymMV의 감염률을 보여 CymMV 감염이 상당한 것으로 확인되었다. 전체 바이러스 감염률 비교에서 기내 배양묘가 83.6%, 온실재배묘가 92.5%로 온실재배묘가 약 9% 정도 감염율이 높은 것으로 나타났다(Tables 1 and 2). 그러나 이러한 감염률 증가는 조사된 기내 배양묘와 동일한 대상 식물이 온실에서 조사된 것이 아니며 매년 배양을 통해 생산되는 품종도 상이하기 때문에 온실 재배 과정에서 증가했다고 보기는 어려웠다. 따라서, 온실 재배에 따른 바이러스 감염 확산 여부를 판단하기 위해서는 기내배양묘와 기외재배묘를 연계하여 바이러스 감염에 대한 추적 조사가 필요할 것으로 생각된다.
Table 2.
Detection of CymMV and ORSV in Phalaenopsis in potted plants
| Origins | No. of samples | No. of virus-infected plants (%) | |||
| CymMVz only | ORSVy only | CymMVz and ORSVy | Overall virus infection | ||
| Gyeongnam | 13 | 8 (61.5) | 0 (0) | 3 (23.1) | 11 (84.6) |
| Gyeonggi | 40 | 28 (70.0) | 0 (0) | 10 (25.0) | 38 (95.0) |
| Chungnam | 40 | 17 (42.5) | 0 (0) | 20 (50.0) | 37 (92.5) |
| Total | 93 | 53 (57.0) | 0 (0) | 33 (35.5) | 86 (92.5) |
바이러스 감염을 근본적으로 해결하기 위해서는 기내배양묘의 무병화가 무엇보다 중요하다. 대만의 경우, 2000년대 이후 대미 수출확대와 더불어 호접란의 바이러스 무병묘 생산체계가 확립된 것으로 판단되지만(Table 1; Yun et al., 2000), 이번에 조사한 국내 배양묘는 바이러스 감염율이 높아(Table 1) 기내 증식에 앞서 바이러스 무병묘 선발 과정을 거치지 않는 것으로 판단된다. 기내 배양 중인 배양묘의 감염원인은 초대배양 시 사용한 배양재료의 감염 정도가 크게 영향을 미치며 건전묘를 사용하였다 하더라도 배양 중 타 배양체가 감염되었을 때, 기내증식 과정에서 교차오염 될 수 있어 배양체의 증식과 바이러스 감염을 연계하여 매우 조심스럽게 관리해야 할 필요가 있다. 또한, 증식단계인 계대배양 시 철저한 주의가 요구되며 조직배양 증식묘가 결과적으로 온실에서 순화를 거쳐 재배되기 때문에 온실 분화묘의 바이러스 감염률을 낮추기 위해서도 기내배양 단계에서의 무병묘 생산이 전제되어야 한다(Hollings, 1965; Fulton, 1986). 이번 연구결과에서 국내 배양묘의 바이러스 감염비율이 전체 83.6%로 매우 높게 나타났으며(Table 1), 이는 묘를 생산하는 생산현장에서 무병묘 생산에 대한 중요성을 간과하기 때문인 것으로 판단된다. 2016년 하반기 미국과의 검역협상으로 한국산 호접란 분화묘가 분화 채 미국 수출이 가능해졌으며 2019년 상반기 최초로 미국 플로리다로 수출되었다(APQA, 2017; Yonhap News Agency, 2019). 최근, 코로나19의 영향으로 각국의 검역 여건은 식물을 포함한 전분야로 확대되어 보다 엄격한 기준에서 시행될 가능성이 커졌으며, 해외시장에서 앞서가는 대만과의 품질 경쟁을 위해서도 미래 시장확보를 위해서도 무병묘 생산 및 관리체계의 확립이 더욱 중요할 것으로 판단된다.
CymMV와 ORSV 감염주의 증상 및 바이러스 입자 관찰
호접란 분화묘 중에서 바이러스 감염으로 확인된 식물체의 바이러스 증상을 관찰하였다. 감염증상이 나타나지 않는 경우도 있었지만 CymMV에 단독감염된 증상과 CymMV와 ORSV에 중복감염된 증상을 확인할 수 있었다. CymMV 단독 감염주에서는 잎의 백화와 괴저반점 증상이 나타났다(Fig. 2A and Fig2B). 두 바이러스 중복감염에서는 잎의 퇴록 줄무늬 얼룩무늬 증상(Fig. 2C)과 꽃잎, 꽃받침의 색이 탈색하는 화색변이와 화형변이가 관찰되었다(Fig. 2D). 실험에 사용한 분화묘 가운데 ORSV의 단독감염주를 분리하지 못해(Table 2), ORSV 단독감염 증상은 확인하지 못하였다. 이번 연구결과와 마찬가지로 CymMV에 감염된 난에서는 백화 또는 괴저의 움푹 패인 반점이 관찰되며 ORSV에 감염된 난에서는 잎에 퇴록 줄무늬, 모자이크증상이 나타난다. 또한, 이 두 바이러스는 화색변이를 유발하는 것으로 알려져 있다(Zettler et al., 1990; Chang et al., 1991a, 1991b; Ryu et al., 1998; Chung et al., 2010; Koh et al., 2014).
CymMV와 ORSV 두 바이러스의 입자를 관찰하기 위해 퇴록 줄무늬, 괴저반점 등의 증상을 나타내는 식물체의 잎 조직을 DN법에 의해 투과전자현미경으로 관찰하였다(Fig. 3). CymMV는 길이가 480-500nm, 폭이 13-15nm의 사상형(filamentous type) 바이러스 입자이고 ORSV는 길이가 290-300nm, 폭이 18nm인 막대기형(rod-shaped type) 바이러스 입자라고 한 보고(Chang et al., 1991a, 1991b; Navalinskienë et al., 2005)와 같이 CymMV와 ORSV에 감염된 호접란의 잎에서 약 500 × 15nm의 사상형 바이러스 입자와(Fig. 3A) 약 300 × 18nm의 막대기형 바이러스 입자를 관찰할 수 있었다(Fig. 3B).