서 언
재료 및 방법
식물 재료
과실의 당도, 산도 및 유기산 함량 분석
효소 추출 및 활성 분석
Quantitative Real-Time (qRT)-PCR 분석
통계 분석
결과 및 고찰
과실의 당도, 산도 및 유기산 함량 변화
유기산 대사관련 효소 활성의 변화
유기산 대사관련 유전자 발현의 변화
서 언
과실에서 유기산 함량과 조성은 매우 중요하다. 과실의 유기산 함량은 당도에 따른 당산비를 결정하여 풍미와 품질에 영향을 미칠 뿐만 아니라(Etienne et al., 2013; Lin et al., 2015) adenosine triphosphate(ATP) 합성과 신호전달 물질의 하나로 스트레스 반응 조절에도 중요하게 작용한다(Batista-Silva et al., 2018). 과실의 유기산 함량은 일반적으로 생육초기에 가장 높고 과실의 비대 및 성숙과 더불어 점차 감소하는 경향을 보인다(Zhou et al., 2018; Liao et al., 2019; Moing et al., 2000). 과실의 유기산 조성은 과종 및 품종에 따라 달라질 수 있는데, 유기산 종류에 따라 맛, 향 및 식미 등에 영향하는 2차 대사산물의 함량 변화에 영향하는 것으로 알려져 있다(Alam et al., 2022).
가용성 당은 대부분 잎에서 합성되어 과실로 전류되어 축적되는 반면, 유기산은 과실에서 합성되고 조절된다(Guo et al., 2016). 유기산의 합성과 축적은 다양한 관련효소들의 작용으로 조절되는 것으로 알려져 있다. 잎으로부터 과실로 전류된 탄수화물은 세포질의 해당과정에서 포스포엔올피루브산(PEP) 또는 피루브산으로 분해되는데, PEP는 수산 또는 사과산으로의 전환에 이용될 수 있고, 피루브산은 미토콘드리아로 들어가서 아세칠-CoA로 변환되고 구연산 회로에서 구연산으로의 합성에 이용된다(Hirai, 1982; Chen et al., 2009a, 2009b; Zhou et al., 2018; Zhang et al., 2021; He et al., 2023). 구연산 회로에서 수산과 아세칠-CoA 결합의 구연산 합성에는 Citrate synthase(CS)가 촉매하고, 기질로 소모되는 수산에 대해서는 세포질의 PEP를 PEP carboxylase(PEPC) 촉매로 수산으로 전환하여 직접 공급하거나 세포질의 피루브산을 NADP-malic enzyme(ME) 촉매로 또는 세포질의 수산을 NAD-malate dehydrogenase(MDH) 촉매로 사과산으로 전환하여 구연산 회로의 하위 단계에서 간접 공급하게 된다. 반면 유기산의 축적은 구연산을 이소구연산으로 변환하는 aconitase(ACO) 및 이소구연산을 알파케토글루타르산으로 변환하는 NADP-siocitrate dehydrogenase(IDH)의 활성 감소와 액포로의 유입에 관여하는 vacuolar H+-ATPase(VHA) 및 vacuolar H+-PPase(VHP)이 활성 증가로 이루어진다(Fig. 1). 과종에 따른 사과산 또는 구연산 등 주요 유기산 성분의 결정에는 유기산 합성 및 분해의 대사과정이 다르게 조절되기 때문이다(Müller et al., 1996; Muñoz-Robredo et al., 2011; Batista-Silva et al., 2018; Zhang et al., 2021). 이들 대사과정에는 품종, 대목, 토양수분 등 재배 환경이 영향하여, 유기산의 조성과 함량이 달라질 수 있는 것으로 알려져 있다(Violeta et al., 2010). 그러나, 과실의 가용성 당과는 달리 유기산의 조성과 함량 변화에 미치는 이들 요인들의 생화학적 × 분자생물학적 조절에 대해서는 상대적으로 많이 알려져 있지 않다(Guo et al., 2018).
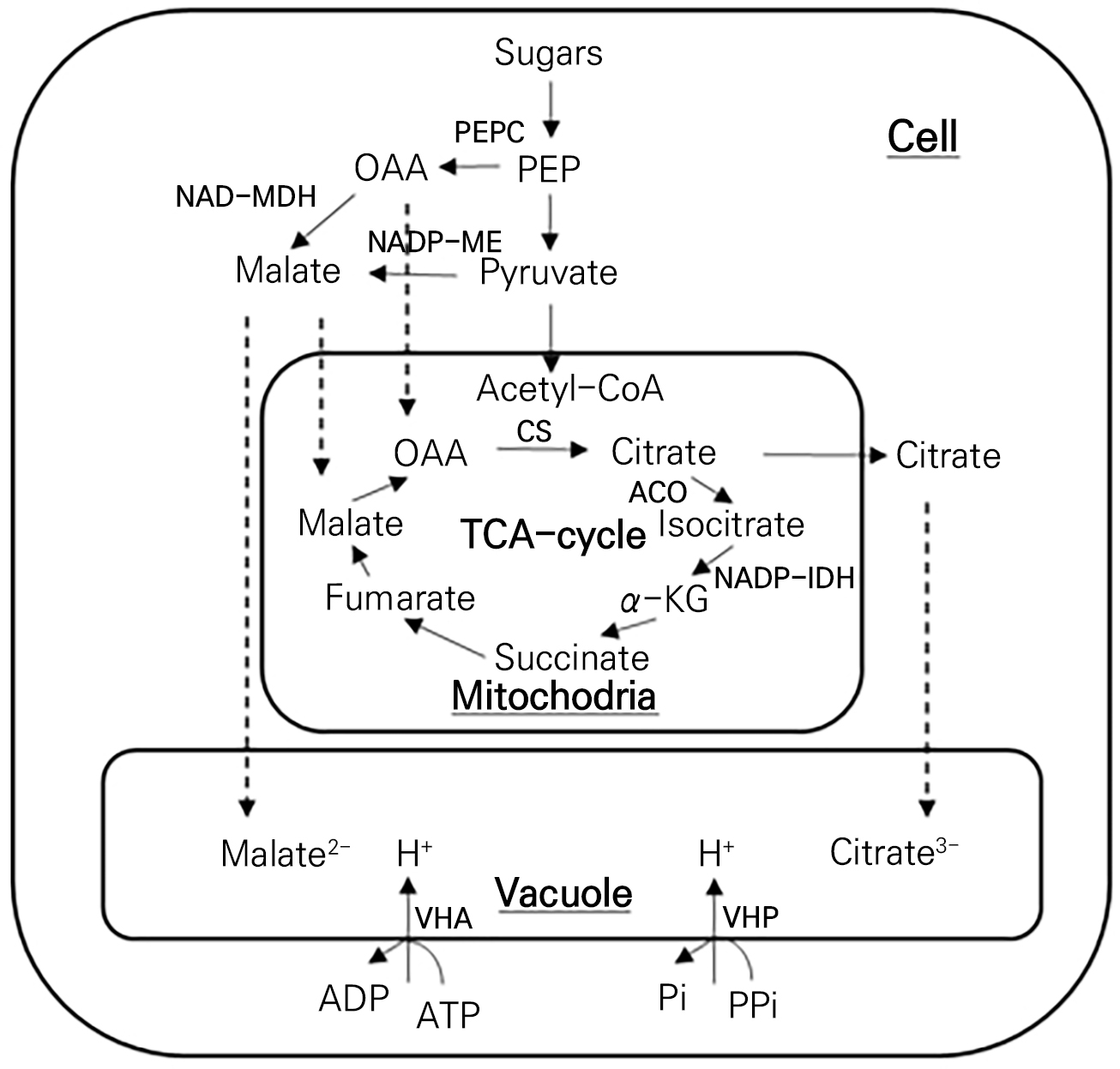
Fig. 1.
Schematic representation of the major organic acid metabolic pathways in fruit cells. Diagrams are compiled and modified from Jiang et al. (2020) and Guo et al. (2016). PEP, phosphoenolpyruvate; PEPC, phosphoenolpyruvate carboxylase; OAA, oxaloacetate; NAD-MDH, NAD-malate dehydrogenase; NADP-ME, NADP-malic enzyme; CS, citrate synthase; ACO, aconitase; NADP-IDH, NADP-isocitrate dehydrogenase; VHA, vacuolar H+-ATPase; VHP, vacuolar H+-PPase; TCA-cycle, tricarboxylic acid cycle.
감귤은 한국을 비롯한 전세계에서 산업적으로 가장 중요한 과실의 하나인데, 이는 당, 유기산, 아미노산, 카로티노이드, 플라보노이드 및 무기염류 등 다양한 건강 기능성 성분들을 다량 함유하고 있는 것과 관계된다(Guo et al., 2016; Sheng et al., 2017; Sadka, 2019). 최근 국내에서는 사과 및 수입과실과의 경쟁력을 높이기 위해 다양한 고당도 및 기능성 품종들이 개발되어 보급되고 있다. 국립원예특작과학원 감귤연구소에서 최근 육성 보급되고 있는 ‘미니향’ 만다린(Citrus reticulata Blanco)은 30–40g의 작은 과실 크기임에도 불구하고 13°Brix 내외의 고당도 품질 특성을 가지고 있어 재배 범위가 확대되고 있다(Yun et al., 2019; Hong et al., 2022). 일반적으로 감귤은 탱자(Poncirus trifoliata(L.) Raf.)를 대목으로 사용하고 있는데, ‘미니향’ 만다린의 경우 수세가 너무 강하여 꽃눈 형성이 부족하고 충분한 착과량 확보가 여의치 않은 실정이다. 이에 따라, 탱자 대목보다 왜화성이 더 높은 비룡탱자(P. trifoliata var. monstrosa Swing.)가 대안으로 제시되고 있으나, 아직까지 이들 대목에 따른 ‘미니향’ 만다린 과실의 수량 및 품질 특성에 대해서는 연구가 매우 부족한 실정이다(Hong et al., 2022; Kim et al., 2023).
감귤 등의 과수에서 품종 및 재배조건은 물론 대목도 과실의 가용성 당, 유기산 및 안토시아닌 등 품질관련 성분 함량에 영향하는 중요한 요인 중의 하나이다(Continella et al., 2018; Sarkhosh et al., 2021). 감귤에서 가용성 당의 함량은 대사관련 효소 및 유전자 발현 조절과 밀접하게 연관되어 있으며, 대목은 수용부위 활력 및 대사 조절과 관련하여 당 함량에 영향하는 것으로 알려지고 있다(Hong et al., 2022). 유기산의 경우도 함량 변화가 대사관련 유전자 발현 조절과 매우 밀접하게 관계되는 것으로 보고되고 있으며(Guo et al., 2016; Alam et al., 2022), 대목은 유기산의 함량은 물론 조성에도 영향에 주는 것으로 보고되고 있다(Legua et al., 2014; Feng et al., 2018).
따라서, 본 연구는 ‘미니향’ 과실에서의 생육단계에 따른 유기산의 조성 및 함량 변화와 대사관련 효소의 활성 및 유전자 발현 양상과의 관계는 물론 대목의 영향 정도를 평가하고자 수행하였다.
재료 및 방법
식물 재료
제주특별자치도 서귀포시 남원읍에 위치한 국립원예특작과학원 감귤연구소(33°30’24” N, 126°61’19” E)의 무가온 하우스에 2.9 × 2.0m로 재식된 4년생 ‘미니향’(C. reticulata Blanco) 만다린을 시험수로 이용하였다. 대목으로 탱자와 비룡탱자를 각각 이용하여 고접한 후 양성된 묘목을 재식되었다. 전정, 관수, 시비 및 병해충 관리 등을 포함한 일반 재배관리는 일반 온주밀감 재배법에 준하여 수행하였다.
과실 비대 초기인 8월 13일부터 성숙기인 12월 7일까지 총 4회[개화 후 100일(과실 비대 초기), 150일(비대 후기), 185일(성숙기), 220일(수확기)] 탱자 또는 비룡탱자의 접목 ‘미니향’ 만다린 각 9주의 나무로부터 나무당 9개씩 수관 중간 바깥 부위로부터 평균과 크기의 과실에 대해 무작위로 채취하였다(Hong et al., 2022). 이 중 3개의 과실은 산도 측정에, 3개는 유기산 함량 분석에, 그리고 나머지 3개의 과실은 유전자 발현 분석에 각각 이용하였다. 유기산 함량, 효소 활성 및 유전자 발현 분석용 시료는 수확 후 곧바로 현장에서 과피와 양낭막을 분리한 후 액체질소로 즉시 사양을 동결시킨 다음 분석 전까지 ‒80°C에서 저장하였다.
과실의 당도, 산도 및 유기산 함량 분석
과실의 당도와 산도는 과즙을 착즙한 후 디지털 당산도측정기(GMK-707R, G-won Hitech Ltd., Daegu, Korea)를 이용하여 측정되었다(Hong et al., 2022). 유기산 함량 분석을 위해 급속 동결하여 초저온 냉동고에 보관 중인 사양조직을 해동시킨 후, 2겹의 거즈로 싸서 착즙한 다음 3mL을 취하고 증류수 6mL를 가하여 희석하였다. 이를 15,000xg에서 10분간 원심분리하여 상징액을 취한 후 Sep-Pak C18 cartridge(Waters Co., Milford, MA, USA)와 0.45µm syringe filter(Cytiva, Co., Maidstone, UK)로 여과한 다음 분석시료로 이용하였다. 유기산의 분석은 CapcellPac C18(4.6 × 250mm, 5μm, Agilent, USA) 컬럼과 UV-Visible 검출기(SPD-20A, Shimadzu, Japan)가 장착된 HPLC(LC-20AT, Shimadzu, Japan)를 이용하여 이동상 0.01M H2SO4(pH 2.3), 시료 10µL, 유속 1mL·min-1, 컬럼온도 30°C의 조건에서 수행하였다.
효소 추출 및 활성 분석
유기산 대사 관련 효소 추출은 Chen et al.의 방법(2009b)을 일부 변형하여 수행하였다. 급속 동결 사양 시료 2g을 10mL 추출 용액[50mM Tris-HCl(pH 7.5), 5mM Mgcl2, 2mM EDTA, 0.5mM PMSF, 0.1%(v/v) BSA, 1%(v/v) Triton X, 10%(v/v) Glycerol, 2%(v/v) PVPP]과 혼합하여 유발 및 유봉으로 마쇄하고 20,000xg, 4°C에서 10분간 원심분리하였다. Desalting buffer [1M Hepes-KOH(pH 7.2), 0.2M MgCl2, 4.8mM β-mercaptoethanol, 10%(v/v) glycerol]를 이용하여 Sephadex PD-10 column(Amersham Pharmacia Biotech, Inc., Piscataway, NJ, USA)를 전처리한 후 원심분리 상층액 2.5mL를 loading한 후 3.5mL를 회수하였고, 이를 조효소액으로 사용하였다.
CS의 활성 측정은 Chen et al.의 방법(2009b)을 일부 변형하여 수행하였으며, 1mL 반응액[50mM Tris-HCl(pH 7.8), 0.1mM 5,5'-DTNB, 0.2mM acetyl-CoA, 0.5mM oxaloacetic acid(OAA) 및 조효소액]을 이용하여 25°C에서 반응을 진행한 후 412nm absorbance(A412)에서 정량하였다. NAD-MDH의 활성 측정은 Merlo et al.의 방법(1993)을 일부 변형하여, 1mL 반응액[50mM Tris-HCl(pH 7.8), 2mM MgCl2, 0.5mM EDTA, 0.2mM β-NADH, 2mM OAA 및 조효소액], 25°C에서 반응을 진행하여 A340에서 정량하였다. PEPC의 활성 분석은 Lane et al.의 방법(1969)을 일부 변형하여 1mL 반응액[40mM Tris-HCl(pH 8.5), 10mM KHCO3, 2mM MgCl2, 2mM PEP, 0.5mM glutathione, 0.24mM NADH 및 조효소액], 25°C, A340에서 수행되었다. NADP-ME의 활성은 Hirai and Ueno의 방법(1977)을 일부 변형하여 1mL 반응액[80mM Tris-HCl(pH 7.5), 0.4mM MnSO4, 0.1mM EDTA, 1mM 1,4-DTT, 0.2mM NADP, 3mM malic acid 및 조효소액], 25°C, A340에서 측정되었다.
효소 활성 산출을 위한 총 단백질 함량은 Bradford의 방법(1976)으로 Bio-Rad protein assay kit(Bio-Rad 500-0001, Bio-Rad Laboratories, Inc., Hercules, CA, USA)을 이용하여 595nm에서 비색 정량되었다.
Quantitative Real-Time (qRT)-PCR 분석
사양 조직의 RNA 추출은 급속 동결한 사양 시료를 석영사와 PVPP를 함께 막자사발에 넣은 후 액체질소를 가하고 유봉을 이용하여 분말을 만든 다음, BiomedicⓇ RNAxzolTM Reagent(Biomedic Co., Ltd., Bucheon, Korea)를 사용하여 제조사의 지침에 따라 수행되었다. 추출한 총 RNA의 정량 및 정성 분석은 비색계(DeNovix DS-11+, DeNovix, Inc., Wilmington, DE, USA)와 1.2%(v/v) 아가로오스 젤의 전기영동으로 수행되었다. cDNA는 PrimeScript™ RT reagent kit(TaKaRa, Inc., Kusatsu, Japan)를 이용하여 합성되었다. CitPEPC1, CitPEPC2, CitCS1, CitCS2, CitACO1, CitACO2, CitACO3, CitcytNAD-MDH, CitMDH1, CitMDH2, CitNAD-ME, CitNADP-IDH1, CitNADP-IDH2, CitNADP-IDH3, CitVHA-c3, CitVHA-D, CitVHP1, CitVHP3 에 대한 프라이머를 Guo et al.(2016)가 제시한 서열정보를 이용하여 제작하였다(Table 1). 총 20μL의 반응액[4μL cDNA, 0.8μL forward and reverse gene-specific primers(각 10pmol/μL), 10μL ToPreal qPCR 2x premix(Enzynomics, Inc., Daejeon, Korea), 5.2μL 멸균수]에 대해 LightCycler® 480 II real-time PCR system(Roche Diagnostics GmbH, Ltd., Mannheim, Germany)을 이용하여 95°C에서 5분 변성 후, 95°C에서 15초, 60°C에서 20초, 72°C에서 30초의 조건으로 총 45회 반복하여 qRT-PCR을 수행하였다. qRT-PCR은 3회의 생물학적 반복과 2회의 기술적 반복으로 수행되었고, 유전자 발현량을 comparative CT 법(Schmittgen and Livak, 2008)에 의해 2-(Ct target gene-Ct housekeeping gene, β-actin) 값으로 산출하였다.
Table 1.
Sequence of primers used in this experiment (Guo et al., 2016)
통계 분석
통계적 유의성 검정은 SigmaStat 3.0 software(Systat Software Inc., Palo Alto, CA, USA)를 이용하여 p = 0.05 수준에서 T-test로 수행하였다.
결과 및 고찰
과실의 당도, 산도 및 유기산 함량 변화
과실의 생육 및 대목에 따른 ‘미니향’ 만다린 과실의 당도와 산도에 미치는 영향을 Table 2에 나타내었다. 과실 생육에 따른 당도 및 산도의 변화는 ‘하례조생’ 및 ‘궁천조생’ 온주밀감의 경우와 매우 유사하였으나, 당도는 1.0°Brix 정도 높고, 산도는 0.3% 정도 낮은 경향이었다(Kim et al., 2012). 대목에 따른 과실의 당도는 생육기 내내 비룡탱자 대목에서 탱자에 비해 높게 나타나는 반면, 산도는 비대 초기를 제외하면 거의 차이가 없었다. 당도는 과실 비대 초기의 차이가 수확기까지 비슷한 수준으로 유지되어 0.5–0.9°Brix 내외의 차이를 보였다. 반면 산도는 과실 비대 초기 0.6%의 함량 차이를 보였으나, 성숙기에는 0.1% 이내로 미미한 차이를 나타냈다. 이는 비룡탱자를 이용한 오렌지와 온주밀감에서 보고된 연구결과와 매우 유사하였다(Noda et al., 2001; Mademba-Sy et al., 2012; Andersen and Brodbeck, 2015; Domingues et al., 2021). 일반적으로 감귤에서 대목은 과실의 당도와 산도에 모두 크게 영향하는 것으로 알려져 있는데(Bassal, 2009; Yildiz et al., 2013; Legua et al., 2014; Raddatz-Mota et al., 2019; Caruso et al., 2020), 본 연구결과와는 차이가 있었다. ‘만다레드’ 만다린의 경우 과실의 산도는 성숙기 기상 환경의 영향을 받아 달라질 수도 있으며, 대목에 따라 그 정도가 다르게 보고된 바 있다(Caruso et al., 2020). 또한 나무의 수령에 따른 과실 산도의 영향을 보면 ‘Gunda Gunda’ 오렌지의 경우 27년생까지 유기산 함량이 계속 증가하였으나, ‘Kinnow’ 만다린의 경우 18년생까지 증가하다, 이후 감소하는 경향이 보고되었다(Khalid et al., 2012; Aregay et al., 2021). 그러므로 과실 산도에 미치는 대목의 영향 정도를 정확히 평가하기 위해서는 수령 및 재배환경 등을 고려하여 추가적으로 중장기적인 연구가 필요하다고 판단되었다(Kim et al., 2012).
Table 2.
Changes of soluble solids and acidity at days after anthesis (DAA) in the fruit of ‘Minihyang’ mandarin grafted on trifoliate orange (TO) and Flying Dragon (FD) rootstocks
| DAA | Soluble solids (°Brix) | Titratable acidity (%) | |||||
| TO | FD | Significancey | TO | FD | Significance | ||
| 100 | 7.1 ± 0.08z | 7.8 ± 0.09 | * | 3.22 ± 0.22 | 3.82 ± 0.06 | * | |
| 150 | 8.2 ± 0.11 | 9.1 ± 0.30 | * | 0.73 ± 0.03 | 0.83 ± 0.06 | ns | |
| 185 | 11.0 ± 0.23 | 11.5 ± 0.18 | ns | 0.65 ± 0.04 | 0.70 ± 0.06 | ns | |
| 220 | 12.6 ± 0.15 | 13.5 ± 0.10 | * | 0.67 ± 0.02 | 0.74 ± 0.04 | ns | |
‘미니향’ 과실의 대목 및 생육단계에 따른 유기산 함량을 분석한 결과는 Table 3과 같다. 과실 비대 초기에 구연산은 사과산의 10배 내외의 높은 함량을 나타내었으나, 이후 점차 감소하여 성숙 후기 및 수확기에는 사과산 함량보다도 약간 낮아지는 수준을 나타내었다. 구연산과 사과산 이외에 아스코브산, 수산, 석신산, 젖산 등이 소량 검출되었으나, 함량의 변화는 미미하여, 수확기 아스코브산을 제외하면 유의차는 없었다. 본 연구결과와는 달리 온주밀감, 오렌지 등 대부분 감귤에서의 유기산은 구연산이 60–90% 내외를 차지하여 사과산의 1.5–10배 정도 높게 함유하고 있으며, ‘하례조생’ 온주밀감의 경우 성숙기의 구연산은 5.52mg·g-1, 사과산 2.34mg·g-1의 수준으로 보고되어 왔다(Yamaki, 1989; Kim et al., 2012; Wang et al., 2014; Ordóñez-Díaz et al., 2020). 또한 ‘미니향’의 교배친인 ‘기주밀감’ 및 ‘병감’의 유기산 조성에서도 매우 유사한 경향을 보이고 있다(Chen et al., 2012; Ornelas-Paz et al., 2017). 그러므로 ‘미니향’ 만다린의 높은 사과산 함유 특성은 다른 품종과의 차별성을 부여할 수 있는 특성으로 판단되나, 그 유전적 배경에 대해서는 추가적인 연구가 필요하다. 과실 생육 초기와는 달리 성숙기 유기산 함량의 감소는 과실 성숙을 촉진하기 위한 다양한 성분 합성과 관련한 호흡 기질로서의 이용과 관계된다(Seymour et al., 2013). 그러나 ‘미니향’ 과실에서의 구연산 함량의 급속한 감소가 호흡기질로서의 이용에 의한 것인지는 명확치 않다. 더욱이 구연산 및 사과산 등의 유기산들은 신호전달 및 질소대사와 관련하여 과실의 크기에도 영향하는 것으로 알려지고 있다(Batista-Silva et al., 2018). 이전의 연구에서 비룡탱자는 탱자에 비해 성숙기 ‘미니향’ 과일 크기를 증가시켰는데(Hong et al., 2022), 유기산의 함량의 변화와는 연관성이 낮은 것으로 보아졌다. Raddatz-Mota et al.(2019)는 감귤류 5개의 대목에서 레몬 과실의 유기산 함량을 비교하였을 때, 볼카머 레몬과 비룡탱자 대목의 경우 다른 대목에 비해 구연산 함량이 증가하였으나 다른 유기산 성분이 변화에는 영향하지 않았다고 하였다. 또한 Aguilar-Hernández et al.(2020)의 연구에서는 대목과 품종의 여러 조합에서 구연산과 사과산은 차이를 보이지 않은 반면, 아스코브산과 수산의 함량은 차이가 있었다고 하였다. 그러므로 본 연구에서의 ‘미니향’ 만다린 과실의 유기산 함량에 미치는 대목의 영향은 당도에 비해 매우 미미한 수준이며, 이는 접수 품종과 대목 품종 간의 조합 반응에 의한 것으로 간주된다.
Table 3.
Organic acid contents (mg·g-1FW) at different days after anthesis (DAA) in the fruits of ‘Minihyang’ mandarin grafted on trifoliate orange (TO) and Flying Dragon (FD) rootstocks
| DAA | Rootstock | Citric acid | Malic acid | Ascorbic acid | Oxalic acid | Succinic acid | Lactic acid | Total |
| 100 | TO |
37.56 ± 0.90z (90.0)y |
3.52 ± 0.17 (8.4) |
0.52 ± 0.03 (1.2) |
0.10 ± 0.01 (0.2) |
0.04 ± 0 (0.1) | - x |
41.73 ± 1.06 (100) |
| FD |
37.78 ± 0.69 (91.0) |
3.12 ± 0.19 (7.5) |
0.46 ± 0.06 (1.1) |
0.09 ± 0.01 (0.2) |
0.04 ± 0 (0.1) | - |
41.50 ± 0.80 (100) | |
| Significancew | ns | ns | ns | ns | ns | ns | ||
| 150 | TO |
7.79 ± 0.27 (64.0) |
3.50 ± 0.16 (28.8) |
0.78 ± 0.08 (6.4) |
0.06 ± 0 (0.5) |
0.03 ± 0 (0.3) | - |
12.17 ± 0.27 (100) |
| FD |
10.11 ± 0.19 (71.3) |
3.19 ± 0.10 (22.5) |
0.78 ± 0.04 (5.5) |
0.06 ± 0 (0.5) |
0.04 ± 0 (0.3) | - |
14.18 ± 0.13 (100) | |
| Significance | * | ns | ns | ns | ns | * | ||
| 185 | TO |
4.93 ± 0.82 (40.7) |
6.49 ± 0.49 (53.6) |
0.54 ± 0.03 (4.5) |
0.08 ± 0.01 (0.7) |
0.04 ± 0 (0.3) |
0.02 ± 0.01 (0.2) |
12.11 ± 1.34 (100) |
| FD |
5.13 ± 0.31 (45.2) |
5.68 ± 0.21 (50.0) |
0.44 ± 0.04 (3.9) |
0.06 ± 0.00 (0.5) |
0.04 ± 0 (0.3) |
0.01 ± 0 (0.1) |
11.36 ± 0.46 (100) | |
| Significance | ns | ns | ns | ns | ns | ns | ns | |
| 220 | TO |
5.52 ± 0.17 (43.1) |
6.62 ± 0.25 (51.7) |
0.51 ± 0.02 (4.0) |
0.07 ± 0 (0.6) |
0.04 ± 0 (0.3) |
0.04 ± 0 (0.3) |
12.80 ± 0.13 (100) |
| FD |
5.92 ± 0.03 (43.7) |
7.07 ± 0.33 (52.2) |
0.41 ± 0.02 (3.0) |
0.07 ± 0 (0.5) |
0.05 ± 0 (0.3) | 0.03 ± 0 (0.2) |
13.54 ± 0.32 (100) | |
| Significance | ns | ns | * | ns | ns | ns | ns |
유기산 대사관련 효소 활성의 변화
‘미니향’ 과실의 생육단계 및 대목에 따른 유기산 대사관련 효소 활성은 Fig. 2와 같다. 구연산 합성의 핵심단계로 알려진 4개의 효소 중에서는 NAD-MDH가 18.8–65.7nmol·min-1·mg-1 protein 내외로 가장 높고, 이어서 CS 24.3–36.1nmol·min-1·mg-1 protein 내외, NADP-ME 0.2–1.5nmol·min-1·mg-1 protein 내외, PEPC 0.12–0.36nmol·min-1·mg-1 protein 내외 순으로 나타났다. PEPC의 활성은 과실 성숙기에 해당하는 만개 후 185일까지 0.12–0.14nmol·min-1·mg-1 protein 매우 낮은 수준으로 유지되다가 익음 단계인 만개 후 220일에 0.21–0.36nmol·min-1·mg-1 protein 수준까지 약간 증가하였으며, 특히 비룡에서 활성 증가의 폭이 다소 크게 나타났다. NAD-MDH는 과실 비대 초기에 해당하는 만개 후 100일에는 18.8–19.3nmol·min-1·mg-1 protein 수준으로 다소 낮은 수준이었으나, 비대기 후기에 해당하는 만개 150일 이후부터 활성이 55.2–57.5nmol·min-1·mg-1 protein 수준으로 증가하여 높은 수준으로 유지되었다. 대목 간 NAD-MDH 활성의 유의적인 차이는 없었다. NADP-ME의 활성은 만개 100일 후에는 0.1nmol·min-1·mg-1 protein 이하로 매우 미미하였으나, 만개 150일 후부터 증가하기 시작하여 만개 후 185일 및 220일에는 1.0–1.5nmol·min-1·mg-1 protein 내외로 높게 유지되는 경향이었다. 대목에 따른 유의적인 차이는 없었으나, 만개 후 165일에는 비룡탱자에서, 그리고 만개 후 220일에는 탱자에서 다소 높은 경향을 나타냈다. CS의 활성은 과실 생육기 내내 24.3–36.1nmol·min-1·mg-1 protein 내외로 높은 수준을 유지하였으며, 만개 후 100일부터 220일까지 서서히 감소하는 경향이었다. 대목에 의한 유의적인 차이는 없었으나, 비룡탱자에서 만개 후 185일 및 220일에 약간 낮은 경향을 보였다.
과실 생육기 유기산 함량과 효소 활성을 비교할 때, 만개 100일 후의 과실 비대 초기 높은 구연산과 낮은 사과산의 함량과 비대 후기인 만개 후 150일 이후 구연산의 감소 및 사과산의 중가는 CS 활성 감소와 NAD-MDH 및 NADP-ME 활성 증가와 관계되는 것으로 보아졌다(Table 3 and Fig. 2). 사과산의 합성은 주로 PEPC와 NAD-MDH의 활성과 관계된다고 보고(Miller et al., 1998; Jiang et al., 2019; Moing et al., 2000)되어 왔는데. 본 연구결과에서의 NAD-MDH 및 NADP-ME 활성 증가에도 불구하고 PEPC 활성이 낮은 것과는 차이가 있었다. PEPC의 활성은 기질 특이성이 높아 낮은 수준에서도 수산 합성에 기여하며(Zhang et al., 2021), PEP를 CS의 기질인 피브루산 및 acety-CoA의 공급을 촉진하기 위한 기작과 관계되는 것으로 보여지나, 이에 대해서는 추가적인 연구가 필요하다. 또한 과실에서 구연산 함량의 변화는 CS의 활성보다는 aconitase(ACO)의 활성과 관계 깊은 것으로 알려져 있다(Sadka et al., 2000; Sadka et al., 2001). 이와 관련한 ACO 활성 분석에 대해서도 추가적인 연구가 요구된다.
유기산 대사관련 유전자 발현의 변화
‘미니향’ 과실의 생육단계 및 대목에 따른 유기산 대사관련 유전자의 발현 분석 결과는 Fig. 3과 같다. PEP로부터의 수산 합성 관련 PEPC1의 발현은 과실 생육기간 내내 일정하게 유지되는데 반해, PEPC2의 발현은 성숙 과정에서 증가하는 것으로 나타났다(Fig. 3A and 3B). 전체적인 PEPC의 발현 정도는 높은 편은 아니었다. 수산으로부터 사과산 합성을 조절하는 NAD-MDH의 발현은 매우 낮은 수준이었으나, 대목에 따른 과실 생육기 발현 정도는 다르게 나타났다(Fig. 3C). 탱자의 경우 과실 비대 초기에 다소 높은 수준에서 성숙 초기에 급속히 낮아져 유지되는 반면, 비룡탱자의 경우 점진적으로 감소하는 양상을 보였다. 구연산 회로에서 사과산으로부터 수산 합성을 조절하는 MDH1과 MDH2의 발현 수준은 매우 낮은 수준이었으나, 대체로 과실 생육과 더불어 증가하였다. 또한 이들 isogene 간 발현 양상은 약간 차이가 있었고 대목 간 차이는 거의 없었다. 미토콘드리아 내에서 피루브산으로부터 사과산 합성을 조절하는 ME의 발현은 다른 유전자의 발현과 비교할 때 중간 수준이었으며 과실 비대초기보다 성숙기에 높게 나타났고 대목의 영향은 일정하지 않았다. 이들 유전자들은 과실 생육 초기보다 성숙기에 사과산이 증가한 것과 일치하는 경향이었다. 그리고 전반적인 대사 조절의 PEPC 및 MDH의 유전자 발현은 PEPC 및 MDH 활성과도 거의 일치하는 것으로 나타났다(Fig. 2). 또한 이들 결과는 ‘벤디자오’ 만다린(Alam et al., 2022)과 백향과(Zhang et al., 2021)에서 보고된 것과도 매우 유사하게 나타났다.
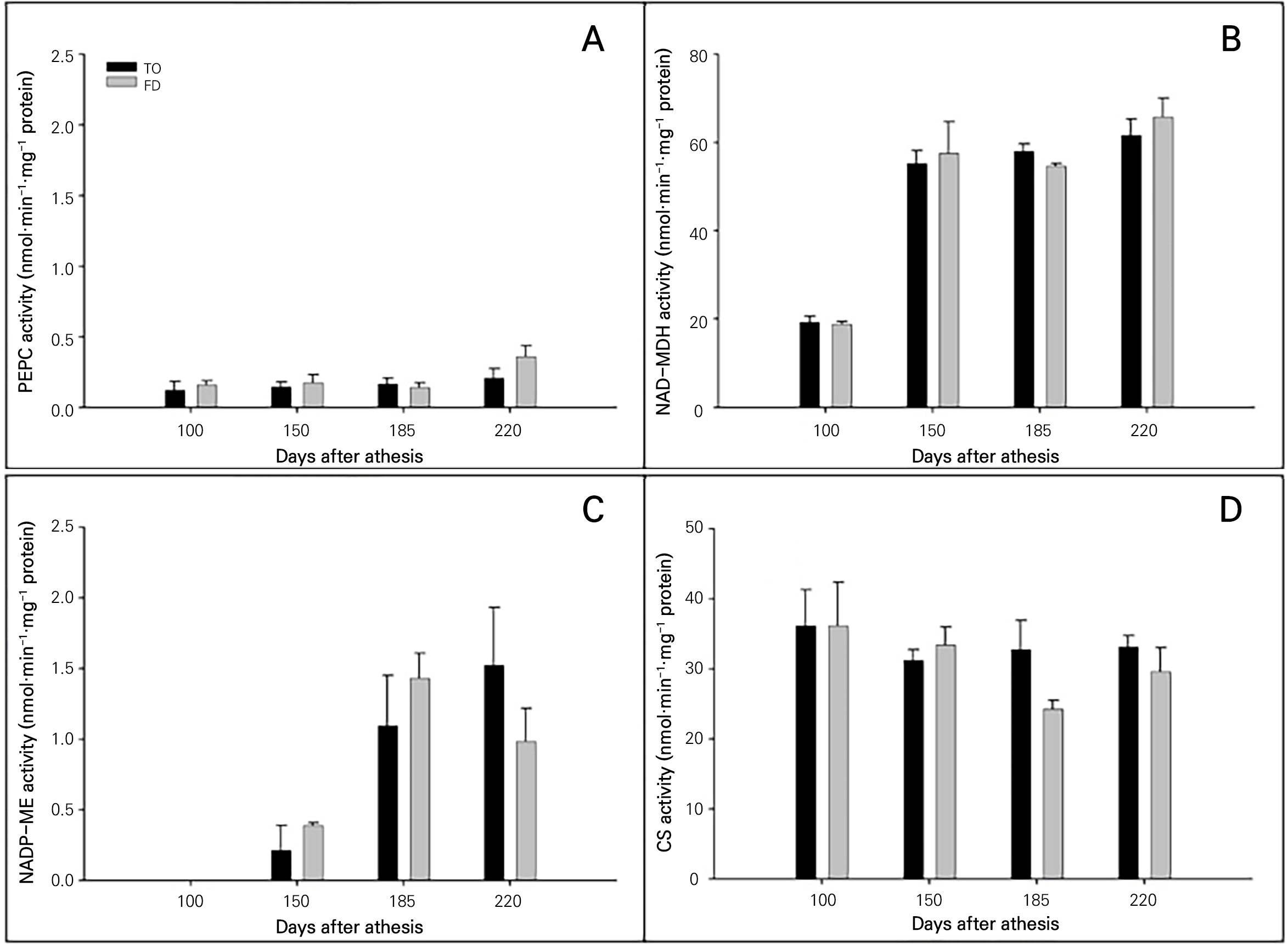
Fig. 2.
Organic acid metabolic enzyme activities at different days after anthesis in the fruit of ‘Minihyang’ mandarin grafted on trifoliate orange (TO) and Flying Dragon (FD) rootstocks. (A) PEPC activity; (B) NAD-MDH activity; (C) NADP-ME activity; (D) CS activity. Vertical bars represent mean ± SE (n = 3).
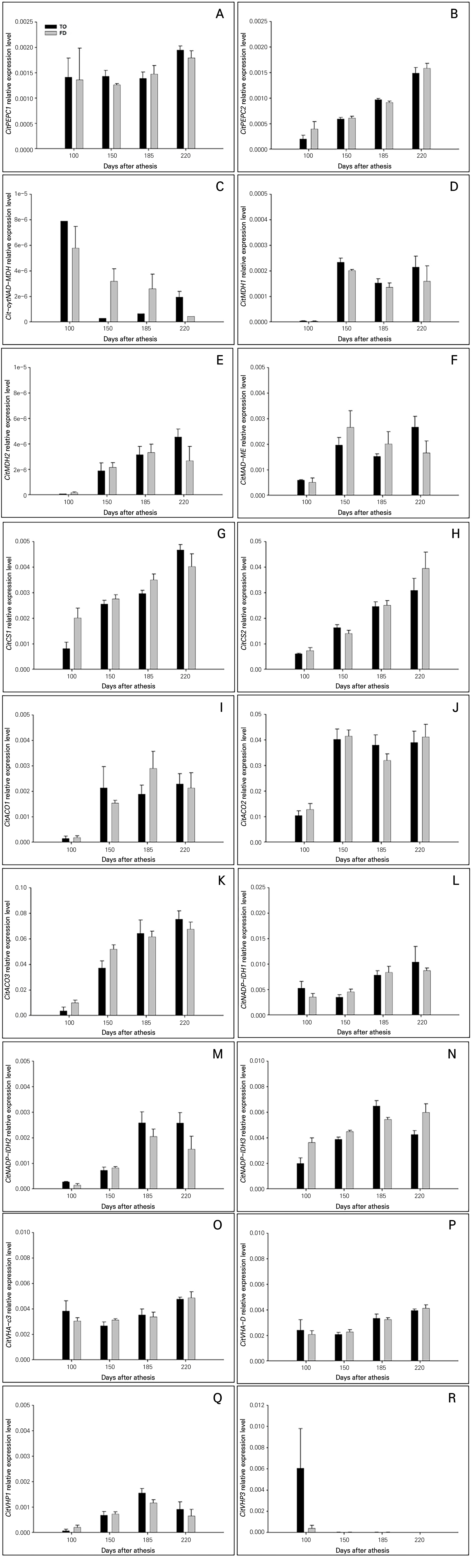
Fig. 3.
Real-time fluorescence quantitative PCR analysis for the relative expression of organic acid metabolism-related genes at different days after anthesis in the fruits of ‘Minihyang’ grafted on trifoliate orange (TO) and Flying Dragon (FD) rootstocks. (A) Citrus phosphoenolpyruvate carboxylase1 (CitPEPC1); (B) CitPEPC2; (C) Citrus cytosolic NAD malate dehydrogenase (CitcytNAD-MDH); (D) CitMDH1; (E) CitMDH2; (F) Citrus malic enzyme (CitNAD-ME); (G) Citrus citric acid synthase1 (CitCS1); (H) CitCS2; (I) Citrus aconitase1 (CitAco1); (G) CitAco2; (K) CitAco3; (L) Citrus NADP-isocitrate dehydrogenase1 (CitNADP-IDH1); (M) CitNADP-IDH2; (N) CitNADP-IDH3; (O) Citrus vacuolar H+-ATPase-c3 (CitVHA-c3); (P) CitVHA-D; (Q) Citrus vacuolar H+-PPase1 (CitVHP1); (R) CitVHP3. Vertical bars represent mean ± SE (n = 3).
구연산 합성과 관련한 CS1와 CS2의 발현은 과실 생육과 더불어 점차 증가하였으며, CS1보다는 CS2의 발현이 높게 나타났다(Fig. 3G and 3H). 구연산의 분해를 촉매하는 ACO의 경우는 3개 isogenes의 발현 양상은 비슷한 경향을 보였는데, 과실 비대 초기에는 낮았으나 성숙기에 증가하여 높게 유지되었다. ACO1의 발현이 다른 ACO2 및 ACO3의 발현보다 낮았으며, 대목에 따른 차이는 거의 나타나지 않았다. Isocitrate의 석신산으로 분해 관련 NADP-IDH의 발현은 대체로 3종의 isogenes 모두 과실 생육과 더불어 점차 증가하는 경향이었으며, 대목 간의 차이는 나타나지 않았다. 이들 유전자들은 과실 비대 초기의 구연산 함량 증가 및 성숙과 더불어 구연산 함량이 점차 감소하는 것과 밀접하게 관계되었다. 과실 생육 초기에는 구연산의 분해와 관계되는 ACO 및 IDH의 활성과 관계되었으며 CS1의 발현 증가와는 반대의 경향이었다. 이는 과실 생육과 더불어 구연산 합성보다는 분해의 증가에 기인함을 보여주는 것이라고 할 수 있다(Wang et al., 2014; Jiang et al., 2020; Zhang et al., 2021; Alam et al., 2022). 한편 과실 생육과 더불어 점차 증가하는 CS1와 CS2의 발현 양상은 과실 생육기 내내 거의 같은 수준으로 유지되는 CS 활성과는 다소 차이가 있었다(Fig. 2). 이는 백향과에서의 CS 발현과도 다른 양상이었다(Zhang et al., 2021). 그러므로 과실 성숙기 CS1와 CS2의 발현 증가는 전사 후 변형과 관계되어 CS 활성이 생육 초기와 동등한 수준으로 유지되는 것으로 보아졌으며, 추가적인 연구가 필요하다고 판단되었다.
액포 내 유기산의 축적과 관련한 VHA 및 VHP의 경우 VHA-c3 및 VHA-D의 발현은 서로 비슷하게 성숙과 더불어 서서히 증가하는 양상이었으나, VHP1의 발현은 성숙과 더불어 증가하다가 익음 단계에서 다시 감소하는 경향이었고 VHP3의 발현은 생육 초기에만 나타나고 이후 매우 미미한 수준에서 유지되어 VHA 및 VHP의 발현 양상은 달랐으며, VHP의 isogenes 간에도 발현 양상은 다르게 나타났다. 본 연구결과는 Guo et al.(2016)이 오렌지에서 보고한 바와 매우 유사하였다. 이는 감귤의 유기산의 액포 내 축적과 관련해서는 VHA보다는 VHP의 역할이 보다 중요하고, 가용성 당의 액포 내 축적과 관련해서는 VHP보다는 VHA의 역할이 보다 더 중요하게 작용함을 보여주는 것이라 판단되었다. 그러나 과실 생육과 관련한 유기산의 함량 증가와 액포막 H+ 펌프와 관계되는 VHP와 VHA의 역할에 대해서는 추가적으로 보다 상세하게 연구할 필요가 있다고 보아진다.


