서 언
재료 및 방법
실험 재료
재배 조건
시료 추출물 제조
총 안토시아닌 함량
총 플라보노이드 분석
2,2-Diphenyl-1-picrylhydrazyl (DPPH) radical 소거능 검정
2,2′-Azinobis-(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical 소거능 검정
통계처리
결과 및 고찰
서 언
최근 생활 수준이 안정되고 건강에 대한 관심이 높아지면서 건강 지향적 식품 및 기능성 향장품에 대한 수요가 증가됨에 따라 다양한 기능성 물질을 갖고 있는 자연 유래 천연물에 관한 연구가 활발히 진행되고 있다(Katsube et al., 2004). 자연적으로 생성되는 식물 유래 천연 산화방지물질의 대부분은 식물에 포함되어 있는 산화방지성 페놀화합물로서 꽃, 잎, 줄기, 뿌리 등의 모든 부분에 존재하며(Roby et al., 2013), 글루타티온(glutathione), 비타민 C(vitamin C), 카르티노이드류(carotenoid), 탄닌(tannin), 플라보노이드(flavonoid) 등과 같은 천연 산화방지물질은 인체 내에서 활성 산소와 유리 라디컬의 생성을 저해하거나 지연시켜 염증 및 암을 예방하는 등 다양한 작용을 하는 것으로 보고되었다(Zhang et al., 2011; Jaberian et al., 2013; Li et al., 2013).
여러 식물 소재 중 특히, 꽃은 풍부한 화색을 띠고 있어 산화방지능이 뛰어난 천연물 의약품 및 기능성 식품으로 활용가능성이 매우 높은 부위로 평가되고 있으며(Elzaawely et al., 2007), 모든 천연성분, 즉, 생리활성물질의 총합체로 매우 중요한 역할을 하는 식물체의 한 부분이다.
심비디움(Cymbidium hybrid)은 난과(Orchidaceae) 심비디움속(Cymbidium Genus)에 속하는 식물로 우리나라를 비롯한 일본, 중국, 호주, 네덜란드 등 전 세계 각지에서 절화 또는 분화로 생산 및 유통되고 있는 중요한 화훼 작물 중 하나이다(Hwang et al., 2016). 난초과 식물은 고대부터 관상의 목적뿐만 아니라 약용 식물로도 사용되어 왔고 뿌리, 줄기, 잎 및 위구경에 있는 식물 천연 화합물은 결핵, 관절염, 마비 등의 각종 질병을 치료하는 데 사용되어 왔으며, 착향 및 향장품의 성분으로 이용되고 있는 것으로 알려진 리나놀(linalool)과 메틸페놀(4-methyl-phenol)은 심비디움의 뿌리에서 유래된 것으로 보고되었다(Kovács et al., 2008; Hossain, 2011; Gaytán et al., 2013; Yoshikawa et al., 2013). 또한, 일부 난초는 스틸베노이드(stilbenoid), 알칼로이드(alkaloid), 트리테르페노이드(triterpenoid) 및 플라보노이드와 같은 유기화합물을 함유하고 있고, 난초과에 속하는 물주전자란 [Bletilla striata (Thunb.) Rchb.f.]의 위구경은 중국과 일본에서 항균, 항염증, 소염제, 진통제, 피부 미용 등에 이용된다고 보고되어 왔으나(Singh and Duggal, 2009), 의약품의 원료로 이용 가능성을 탐색하는 연구는 미비한 실정이다. 이처럼 난초는 건강 지향적 식품 및 기능성 향장품의 새로운 원료로 사용할 수 있는 가능성이 크다고 볼 수 있지만, 난초과에 속하는 분화 심비디움의 산화방지물질 및 산화방지능 분석과 관련된 연구 또한 국내외를 통틀어 매우 미비한 실정이며, 꽃잎의 안토시아닌 등과 같은 플라보노이드에 관한 연구가 일부 보고되었다(Wang et al., 2014).
현재 심비디움 재배 농가는 주요 분화 수출대상국인 중국의 심비디움 자급화 및 국가적 사치품 소비 제한 분위기에 따라 수출 판로가 거의 불가능한 환경이 조성되었으며, 주요 절화 수출대상국인 일본의 엔저 현상 및 화훼 소비 인구 감소로 인한 가격 폭락으로 심비디움 생산농가의 피해가 점점 커지고 있는 실정이다. 이러한 심비디움 재배농가의 여건을 고려하여 심비디움의 꽃, 잎 및 위구경을 건강 지향적 식품이나 기능성 향장품의 신원료로 사용하기에 적합한 생리활성 물질 탐색 및 가공 기술을 개발하여 새로운 고부가가치를 창출함으로써 분화 심비디움 재배 농가의 경제활성화에 기여할 수 있는 연구가 필요하다고 판단된다.
따라서 본 연구는 국내에서 재배된 분화 심비디움 3품종(‘SP211’, ‘ER827’, ‘FX750’)을 선정하여 부위별(꽃, 잎, 위구경)에 따른 산화방지물질 및 총 산화방지능을 분석하여 건강 지향적 식품 및 기능성 향장품의 원료로 이용 가능성을 판단하고자 실시하였다.
재료 및 방법
실험 재료
본 실험의 공시 재료는 충청남도 공주에 위치한 농가에서 재배한 분화 심비디움을 사용하였으며, 부위 별 산화방지물질 및 산화방지능을 분석하기 위해 각기 다른 화색을 가진 ‘SP211’, ‘ER827’, ‘FX750’ 3품종을 선정하였다(Fig. 1). 실험에 적합한 균일한 상태로 화경의 하부에서부터 상부에 위치한 화수까지 전체적으로 개화하였을 때 수확하여 사용하였다. 수확한 심비디움은 부위별(꽃, 잎, 위구경)로 분리하여 -196°C인 액체질소로 동결건조 시킨 후, -25°C의 냉동실에 보관하면서 산화방지물질 분석과 산화방지능 측정에 사용하였다.
재배 조건
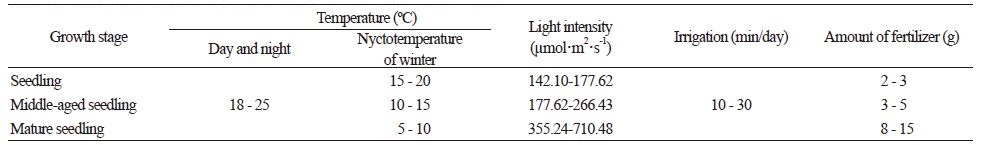
충남 공주에서 재배된 심비디움의 재배 조건은 Table 1과 같다. 플라스틱 하우스 내에서 2013년 4월부터 2016년 1월까지 유묘기, 중묘기, 성묘기에 걸쳐 총 3년간 재배되어 개화한 상품을 선별 및 수확하여 실험용 재료로 사용하였다. 하우스 내의 온도는 주, 야간 18-25°C 내외로 유지시켜 주었으며, 겨울철 야간 온도는 생육 단계별로 유묘기(15-20°C), 중묘기(10-15°C), 성묘기(5-10°C)로 관리하였다. 물 관리는 매일 10-30분 정도 1회 관수하였으며, 여름철에 한해 1일 2회 관수하였다. 광 조건은 생육 단계별로 유묘기(142.10-177.62µmol/m2/s), 중묘기(177.62-266.43µmol/m2/s), 성묘기(355.24-710.48µmol/m2/s)로 관리하였으며, 영양 관리는 질소, 인, 칼륨이 주 조성 원료인 복합비료(Osmocote Plus 13-13-13+2MgO+TE, Sangrok Co., Korea)를 각 화분당 유묘기(2-3g), 중묘기(3-5g), 성묘기(8-15g) 별로 달리하여 시비하였다.
시료 추출물 제조
냉동 보관한 시료 일정량을 막자 사발에 담아 적당량의 액체질소를 가하여 분말화한 후, 80% 에탄올을 가하여 블렌더(HR-2171, Phillips, Korea)로 3분씩 3회 균일하게 혼합하였다. 혼합물은 감압 여과장치에서 Whatman #2 여과지(Whatman International Ltd., Kent, England)를 사용하여 여과시킨 후, 감압식 회전농축기(N-1000, Eyela, Japan)를 이용하여 용매를 완전히 제거시키면서 농축시켰다. 농축시킨 혼합물은 –25°C에 냉동 보관하여 산화방지물질 분석과 총 산화방지능 측정에 사용하였다.
총 안토시아닌 함량
각기 다른 화색을 갖는 분화 심비디움 꽃 추출물의 총 안토시아닌 함량 분석은 pH시차법(pH differential method)에 따라 측정하였다(Meyers et al., 2003; Shin, 2012). 심비디움 추출물에 0.025M KCl buffer(pH 1.0)와 0.4M sodium acetate buffer(pH 4.5)를 각각 첨가한 후 분광광도계(Optizen POP, Mecasys, Korea)를 이용하여 510nm와 700nm 파장에서 흡광도를 측정하였다. 총 안토시아닌 함량의 단위는 다음과 같이 계산하여 mg cyanidin 3-O-glucoside equivalents (CGE)/100g fresh weight(FW)로 환산하여 표기하였다.
(A×MW×D×1000)

총 플라보노이드 분석
심비디움 부위별 추출물의 총 플라보노이드 함량은 비색법(colorimetric assay method)에 따라 측정하였다(Meyers et al., 2003; Shin, 2012). 심비디움 추출물과 3차 증류수를 혼합한 시험용액에 5% NaNO2을 0.3mL 넣고 균일하게 혼합한 후 5분간 정치 후, 10% AlCl3을 0.3mL 넣고 균일하게 혼합한 후 6분간 정치하였다. 최종적으로 1N NaOH를 2mL 넣고 증류수를 2.4mL 더하여 총량을 10mL로 맞춰준 후 분광광도계(Optizen POP, Mecasys)를 이용하여 510nm 파장에서 흡광도를 측정하였다. 표준검량곡선은 표준물질 카테킨(catechin)을 50, 100, 150, 200, 250mg·L-1 농도 별로 제조하여 작성하였고, 총 플라보노이드 함량의 단위는 mg catechin equivalents (CE)/100g FW로 환산하여 표기하였다.
총 페놀화합물 분석
심비디움 부위별 추출물의 총 페놀화합물 함량은 Folin-Ciocalteu 비색법(Folin-Ciocalteu colorimetric method)에 따라 측정하였다(Meyers et al., 2003; Shin, 2012; Sinkovič et al., 2017). 심비디움 추출물과 3차 증류수를 혼합한 시험 용액에 Folin-Ciocalteu 시약을 0.2mL 첨가하고 균일하게 혼합하여 실온에서 6분간 정치한 후, 7% NaCO3를 2mL 첨가하고 상온암소 상태로 90분간 정치한 후, 분광광도계(Optizen POP, Mecasys)를 이용하여 750nm 파장에서 흡광도를 측정하였다. 표준검량곡선은 표준물질 갈산(gallic acid)을 50, 100, 150, 200, 250mg·L-1 농도 별로 제조하여 작성하였고, 총 페놀화합물 함량의 단위는 mg gallic acid equivalents (GAE)/100g FW로 환산하여 표기하였다.
2,2-Diphenyl-1-picrylhydrazyl (DPPH) radical 소거능 검정
심비디움 부위별 추출물의 DPPH 라디컬 소거능을 이용한 산화방지능 측정은 DPPH 분석 방법에 따라 측정하였다(Brand-Williams et al., 1995; Shin, 2012). 심비디움 추출물 50μL와 0.2mM DPPH solution 2,950μL를 혼합한 시험용액은 상온암소 상태에서 30분간 반응시킨 후, 분광광도계(Optizen POP, Mecasys)를 이용하여 517nm 파장에서 흡광도를 측정하였다. 표준검량곡선은 표준물질 비타민 C를 사용하여 50, 100, 150, 200mg·L-1 농도 별로 제조하였고 심비디움 추출물의 산화방지능 측정값은 mg vitamin C equivalents (VCE)/100g FW로 환산하여 표기하였다.
2,2′-Azinobis-(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical 소거능 검정
심비디움 부위별 추출물의 ABTS 라디컬 소거능을 이용한 산화방지능 측정은 ABTS 분석 방법(Re et al., 1999; Jo et al., 2016)에 따라 측정하였다. 심비디움 추출물 20μL와 ABTS 반응용액 980μL를 혼합한 시험용액은 37°C 에서 10분간 반응시킨 후, 분광광도계(Optizen POP, Mecasys)를 이용해 734nm 파장에서 흡광도를 측정하였다. 표준검량곡선은 표준물질 비타민 C를 사용하여 50, 100, 150, 200mg·L-1 농도 별로 제조하였고 심비디움 추출물의 산화방지능 측정값은 mg VCE/100g FW로 환산하여 표기하였다.
통계처리
각 실험의 통계처리는 SAS 통계 프로그램(SAS Institute, Inc., Cary, NC, USA)과 SPSS 프로그램(SPSS Inc., Chicago, IL, USA)을 사용하여 분산분석(ANOVA)을 실시하였고, 유의성 검정은 Duncan의 다중범위검정법(Duncan’s multiple range test)을 사용하였다(p < 0.05). 각 요인 별 상관관계는 Pearson의 적률 상관계수(Pearson’s correlation coefficient)를 이용하여 표기하였다.
결과 및 고찰
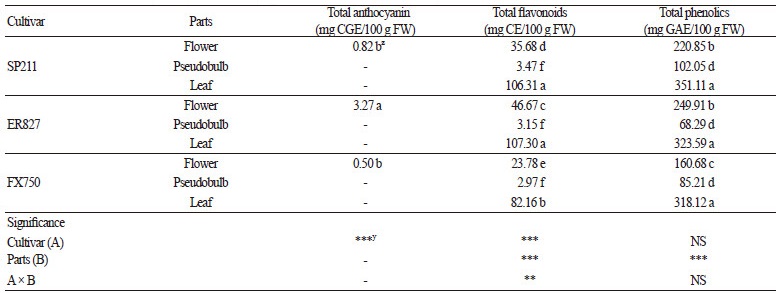
분화 심비디움의 부위별 추출물에 함유된 총 안토시아닌, 총 플라보노이드, 총 페놀화합물 함량을 분석한 결과는 Table 2와 같다. 총 안토시아닌은 주로 꽃이나 과실 등에 포함되어 있는 안토시아니딘의 색소배당체이므로 꽃 추출물에서만 측정하였다. 꽃 추출물의 총 안토시아닌 함량은 다른 품종에 비해 ‘ER827’ 품종이 3.27mg/100g FW으로 유의차 있게 가장 높았으며(p < 0.05), ‘SP211’ 품종과 ‘FX750’ 품종은 각각 0.82, 0.50mg/100g FW으로 이 두 품종 간에 유의차는 없는 것으로 나타났다(p < 0.05). 본 연구 결과, 적색 품종인 ‘ER827’이 분홍색 품종인 ‘SP211’과 황색 품종인 ‘FX750’보다 총 안토시아닌 함량이 높았던 것으로 조사되었으며, 이러한 결과는 Benvenuti et al.(2016)의 식용꽃의 산화방지물질에 관한 연구에 따르면 백색 꽃보다 적색 또는 분홍색 꽃에서 총 안토시아닌 함량이 더 높았다는 연구 결과와 유사한 결과임을 알 수 있었다. Wang et al.(2014)의 연구 결과에서는 네 가지 색상의 그룹으로 분류된 심비디움 8품종 중 적색 품종의 총 안토시아닌 함량이 가장 높았다고 하였으며, 총 안토시아닌의 농도는 색의 진한 정도와 관련이 있는 것으로 보고되었다. 또한, Wang et al.(2014)의 연구결과에 의하면 일반적으로 분홍색 계열의 꽃은 안토시아닌 색소가 관여하고, 백색의 꽃은 색소가 존재하지 않으며, 황색 계열의 꽃은 카르티노이드, 녹색 계열의 꽃은 엽록소를 축적한다는 보고는 적색 꽃 추출물의 총 안토시아닌 함량이 가장 높았다는 본 연구 결과와 동일한 것으로 판단되었다.
부위별 추출물의 총 플라보노이드 함량은 모든 부위의 추출물에서 2.97-107.30mg/100g FW로 부위 간에 차이가 큰 것으로 조사되었다(Table 2). 다른 부위의 추출물보다 ‘ER827’의 잎 추출물(107.30mg/100g FW)과 ‘SP211’의 잎 추출물(106.31mg/100g FW)이 유의차 있게 높은 것으로 나타났다(p < 0.05). 꽃 추출물 중에서는 ‘ER827’(46.67mg/100gFW)이 ‘SP211’ (35.68mg/100g FW)과 ‘FX750’(23.78mg/100g FW)에 비해 유의차 있게 높은 것으로 나타났으며(p < 0.05), 위구경 추출물은 2.97-3.47mg/100g FW으로 다른 부위에 비해 함량이 가장 낮은 것으로 조사되었다. Joung et al.(2007)의 연구에서도 식용 백합의 잎 추출물이 구근 추출물보다 총 플라보노이드 함량이 높은 것으로 보고된 바 있다. 또한, 본 연구에서 ‘ER827’의 꽃 추출물은 다른 품종에 비해 총 안토시아닌 함량과 총 플라보노이드 함량이 높았는데 이는 Wang et al.(2014)의 플라보놀은 안토시아닌 색소와 관련되어 화색에 영향을 미치는 색소의 역할을 한다는 보고와 유사하였다.
부위별 추출물의 총 페놀화합물 함량은 총 플라보노이드 함량과 유사한 경향을 나타내었다(Table 2). 모든 부위의 추출물에서 68.29-351.11mg/100g FW 함유되어 있는 것으로 측정되었으며, 다른 부위의 추출물보다 잎 추출물의 함량이 각각 ‘SP211’ (351.11mg/100g FW), ‘ER827’(323.59mg/100g FW), ‘FX750’(318.12mg/100g FW)로 유의차 있게 높은 것으로 나타났다(p < 0.05). 반면에 위구경 추출물은 각각 ‘SP211’(102.05mg/100g FW), ‘FX750’(85.21mg/100g FW), ‘ER827’(68.29mg/100g FW)로 잎에 비해 약 3-5배 가량 적었고, 3품종 모두 잎, 꽃, 위구경 추출물 순으로 높았다. 심비디움의 총 페놀화합물 함량에 관한 선행연구는 전무한 실정이기 때문에 직접적인 비교는 어렵지만, Joung et al.(2007)의 식용 백합의 부위별 추출물의 총 페놀화합물 함량을 분석한 결과, 백합 구근 추출물보다 잎 추출물에 더 많은 양의 총 페놀화합물이 함유되어 있다는 결과와 유사한 것을 알 수 있었다. 다른 부위에 비해 잎의 총 페놀화합물 함량이 높은 이유는 식물체 잎에서 일어나는 광합성 대사 시 생성되는 폴리페놀 성분에 의해 다른 부위보다 잎에 총 페놀화합물 및 플라보노이드 물질이 다량으로 축적되기 때문인 것으로 보고되었다(Lee et al., 2005).
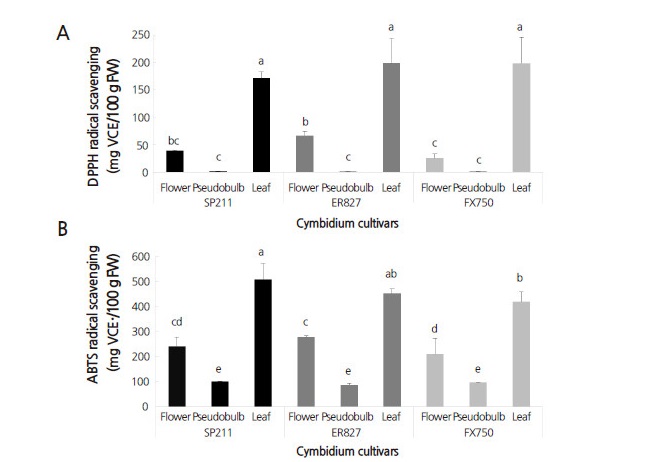
총 산화방지능 분석은 DPPH와 ABTS 라디컬 소거능을 이용하여 측정한 결과(Fig. 2), 3품종 모두 다른 부위보다 잎의 산화방지능이 각각 ‘SP211’(DPPH: 171.80, ABTS: 507.75mg VCE/100g FW), ‘ER827’(DPPH: 199.45, ABTS: 452.13mg VCE/100g FW), ‘FX750’(DPPH: 198.83, ABTS: 418.31mg VCE/100g FW)으로 유의차 있게 높은 소거능을 보였다(p < 0.05). 이러한 결과는 본 연구에서 산화방지물질(총 안토시아닌, 총 플라보노이드, 총 페놀화합물) 모두 잎의 함량이 다른 부위보다 높았던 것과 관련이 있는 것으로 사료된다. 총 안토시아닌 함량을 측정한 꽃 추출물의 경우, 총 안토시아닌 함량이 가장 높게 나타난 ‘ER827’ 품종의 총 산화방지능(DPPH: 66.85mg VCE/100g FW, ABTS: 278.79mg VCE/100g FW)도 다른 품종에 비해 유의차 있게 높은 것으로 보아 Benvenuti et al.(2016)의 품종마다 다양성이 존재하지만 대체로 총 안토시아닌 함량이 높을수록 산화방지능도 높다는 보고와 유사한 결과라고 판단된다.
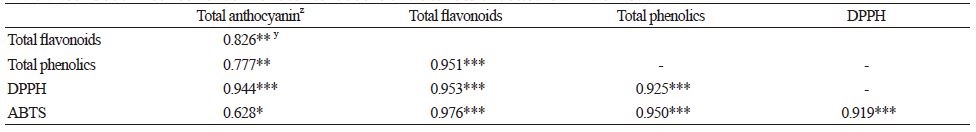
총 페놀화합물 및 총 플라보노이드의 농도와 총 산화방지능 간의 상관관계를 보면(Table 3), 심비디움 3품종의 총 페놀화합물과 총 산화방지능은 DPPH(r=0.925)와 ABTS(r=0.950)는 높은 상관관계를 보였으며(p < 0.05), 총 플라보노이드와 산화방지능 간의 상관관계도 DPPH(r= 0.953), ABTS(r=0.976)로 상당히 높은 것으로 나타났다(p < 0.05). 총 안토시아닌은 꽃 추출물에서만 검출되었기에 총 안토시아닌과 총 플라보노이드, 총 페놀화합물 및 총 산화방지능 간의 상관관계는 꽃 추출물의 함량만으로 분석하였으며 Table 3에 나타내었다. 총 안토시아닌과 총 플라보노이드 간의 상관관계는 r=0.826으로 높은 상관관계를 보였으며 총 페놀화합물 간의 상관관계는 r=0.777로 나타났다(Table 3). 또한, DPPH 라디털 소거능과의 상관관계는 r=0.944로 높은 상관관계를 보였으며 ABTS 라디컬 소거능과의 상관관계는 r=0.628로 나타났다(Table 3). 심비디움의 산화방지물질과 총 산화방지능에 관한 연구는 매우 미비한 실정이지만, 과수 및 채소와 같은 다른 원예산물의 연구 결과에 의하면 산화방지물질 함량이 높을수록 총 산화방지능도 높아 산화방지물질과 산화방지능 간에는 상당히 높은 상관관계가 있는 것으로 보고되었다(Shin, 2012).
결론적으로, 심비디움 3품종의 꽃, 잎, 위구경 추출물의 산화방지물질 및 산화방지능을 비교, 분석해 본 결과, 부위별 농도의 차이는 있었지만 산화방지물질이 모두 포함되어 있었고, 산화방지물질과 산화방지능 간에 높은 상관관계도 나타났다. 이러한 결과를 종합해 보았을 때, 분화 심비디움에 존재하는 산화방지물질 역시 총 산화방지능의 주요 작용인자로 기여하는 것으로 사료되며, 향후 기능성 향장품의 원료로 이용 가능성을 탐색하기 위해 미백과 항노화 등의 피부 미용과 관련된 연구를 실시할 필요성이 있다고 판단된다. 이처럼 분화 심비디움은 식물 유래 천연화합물을 다량 보유하고 있기 때문에 추후 건강 지향적 식품 및 기능성 향장품의 신원료로 이용할 가치가 충분하며, 관상 목적으로만 재배되던 심비디움의 새로운 고부가가치 창출을 통해 재배 농가에 경제적으로 도움이 될 것으로 사료된다.