서 언
재료 및 방법
실험 재료 및 멜라토닌 엽면살포
생육 특성 조사 및 광합성 측정
단백질 정량 및 malondialdehyde(MDA), H2O2 함량 분석
Ascorbic acid와 proline 함량 분석
항산화효소 활성 분석
통계분석
결과 및 고찰
배추의 생육 특성
배추의 광합성 특성 변화
배추의 malondialdehyde(MDA) 및 H2O2 함량 변화
Ascorbic acid 및 proline 함량 변화
항산화효소 활성 변화
서 언
김치의 주재료인 배추(Brassica rapa L. ssp. pekinensis)는 주로 노지에서 재배하는 작물로 비생물적 환경 스트레스에 영향을 많이 받는다. 특히 고온과 건조 스트레스는 배추의 세포 손상을 유발하여 세포사멸을 초래하고, 생육 저하 및 결구 불량 등으로 품질 저하와 생산량을 감소시킨다(Lee et al., 2009; Lee et al., 2011; Lee et al., 2012; Oh et al., 2014). 배추의 생리 장애와 대사 이상의 대부분은 활성산소종(ROS, reactive oxygen species)의 생성과 이로 인한 광범위한 세포 손상 및 광합성 억제를 통해 발생한다(Baxter et al., 2014). 이러한 식물의 산화스트레스를 유발하는 활성산소종은 catalase(CAT), glutathione peroxidase(GSH-Px), peroxidase(POD), superoxide dismutase(SOD)등의 항산화효소와 비타민, 식물성 화합물, 미네랄 등의 저 분자 항산화 물질 등에 의해 효율적으로 제거된다. 현재, 작물의 항산화효소 활성과 비효소적 항산화물질의 축적 증진을 통해 환경 스트레스에 의한 산화스트레스를 경감시키려는 연구가 진행되고 있으며, 이를 위해 다양한 호르몬과 항산화 물질 등의 생리활성제가 활용되고 있다.
멜라토닌(melatonin)은 동물과 식물에서 생성되는 물질로서 최근 강력한 항산화효소 활성 능력으로 주목받고 있으며(Hardeland, 2009), 멜라토닌 처리에 의한 작물의 환경스트레스 저항성 증진 효과가 규명되고 있다. 건조 조건에서 23.2mg·L-1 농도로 밀(Ye et al., 2016)과 유채(Dai et al., 2020)에 처리 하고, 고온 조건시 토마토(Xu et al., 2016; Qi et al., 2018, Jahan et al., 2019)와 밀(Buttar et al., 2020)에 4.7-23.2m·L-1 처리시 생체중, 건물중, 광합성 특성 및 항산화효소 활성이 증가하여 스트레스 저항성을 보였다. 또한 멜라토닌은 옥신(auxin)과 유사한 활성 및 영양생장을 촉진하는 화합물로(Hernandez-Ruiz et al., 2005), 멜라토닌 처리시 초기 생육단계 식물의 광주기에 의한 개화 유도와 발달에 영향을 주고(Kolar et al., 2003), 부정근과 곁뿌리 발달을 촉진하였다(Arnao and Hernandez-Ruiz, 2007; Chen et al., 2009). 특히 멜라토닌은 다양한 종류의 활성산소(ROS, reactive oxygen species)와 활성질소(RNS, reactive nitrogen species)를 효율적으로 소거함으로써 작물을 산화스트레스로부터 보호하는 역할을 한다(Galano et al., 2011). 일반적으로 항산화 물질들은 redox-cycling 기작에 따라 산화촉진제로 작용함으로써 세포독성을 유발한다고 알려져 있다(Rietjens et al., 2002). 반면 멜라토닌은 세포 독성이 없고, 수용체를 필요로 하지 않으며, 효소적·비효소적 대사산물도 항산화제로 직접 작용함으로써 다른 생리활성물질에 비해 높은 항산화활성을 보였다(Tan et al., 2000; 2007). 현재까지 배추의 환경 스트레스에 대한 멜라토닌 경엽처리 효과 연구는 검토된바 없으나, 고온과 건조 조건하에서 멜라토닌 처리시 광합성 특성, 항산화효소 활성 등을 증진시킴으로써 피해를 경감할 수 있을 것으로 기대된다. 따라서 본 연구에서는 배추를 대상으로 이상기상에 의한 기온과 토양수분 스트레스 조건에서 멜라토닌 경엽처리가 배추의 생육 및 생리반응에 미치는 영향과 적정 처리농도를 규명하고자 하였다.
멜라토닌(melatonin)은 동물과 식물에서 생성되는 물질로서 최근 강력한 항산화효소 활성 능력으로 주목받고 있으며(Hardeland, 2009), 멜라토닌 처리에 의한 작물의 환경스트레스 저항성 증진 효과가 규명되고 있다. 건조 조건에서 23.2mg·L-1 농도로 밀(Ye et al., 2016)과 유채(Dai et al., 2020)에 처리 하고, 고온 조건시 토마토(Xu et al., 2016; Qi et al., 2018, Jahan et al., 2019)와 밀(Buttar et al., 2020)에 4.7-23.2m·L-1 처리시 생체중, 건물중, 광합성 특성 및 항산화효소 활성이 증가하여 스트레스 저항성을 보였다. 또한 멜라토닌은 옥신(auxin)과 유사한 활성 및 영양생장을 촉진하는 화합물로(Hernandez-Ruiz et al., 2005), 멜라토닌 처리시 초기 생육단계 식물의 광주기에 의한 개화 유도와 발달에 영향을 주고(Kolar et al., 2003), 부정근과 곁뿌리 발달을 촉진하였다(Arnao and Hernandez-Ruiz, 2007; Chen et al., 2009). 특히 멜라토닌은 다양한 종류의 활성산소(ROS, reactive oxygen species)와 활성질소(RNS, reactive nitrogen species)를 효율적으로 소거함으로써 작물을 산화스트레스로부터 보호하는 역할을 한다(Galano et al., 2011). 일반적으로 항산화 물질들은 redox-cycling 기작에 따라 산화촉진제로 작용함으로써 세포독성을 유발한다고 알려져 있다(Rietjens et al., 2002). 반면 멜라토닌은 세포 독성이 없고, 수용체를 필요로 하지 않으며, 효소적·비효소적 대사산물도 항산화제로 직접 작용함으로써 다른 생리활성물질에 비해 높은 항산화활성을 보였다(Tan et al., 2000; 2007). 현재까지 배추의 환경 스트레스에 대한 멜라토닌 경엽처리 효과 연구는 검토된바 없으나, 고온과 건조 조건하에서 멜라토닌 처리시 광합성 특성, 항산화효소 활성 등을 증진시킴으로써 피해를 경감할 수 있을 것으로 기대된다. 따라서 본 연구에서는 배추를 대상으로 이상기상에 의한 기온과 토양수분 스트레스 조건에서 멜라토닌 경엽처리가 배추의 생육 및 생리반응에 미치는 영향과 적정 처리농도를 규명하고자 하였다.
재료 및 방법
실험 재료 및 멜라토닌 엽면살포
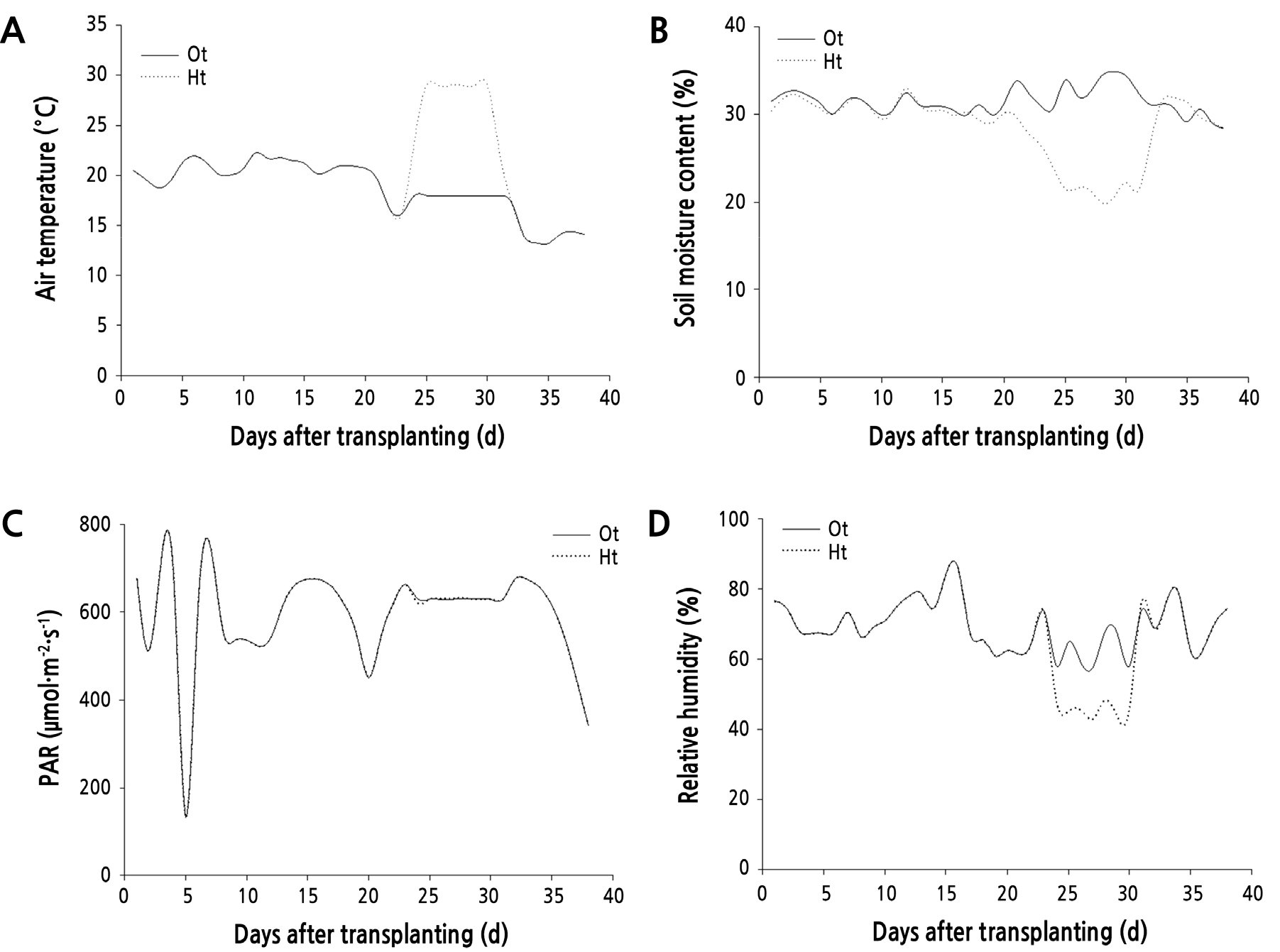
시험 재료는 ‘불암 3호’(Bulam No. 3, Hungnong seed Co., Korea) 배추를 2020년 8월 11에 파종하였고, 본엽 6-7매가 전개된 모종 60주(파종 후 4주)를 사양토 12kg을 채운 1/2000아르 와그너포트에 정식하였다. 재배기간 동안의 토양수분(S-SMx-M005, Oneset, USA), 일사량(S-LIA-M003, Oneset, USA), 기온과 상대습도(S-THB-M002, Onset, USA)는 데이터로거(H21-USB, Onset, USA)를 활용하여 1시간 간격으로 수집하였다. 정식 후 21일에 멜라토닌(Melatonin, Sigma-aldrih, Darmstatd, Germany)을 각각 5, 10 및 20mg·L-1 농도로 주당 100mL를 경엽처리 하였고, 무처리와 대조구(적온·적습)는 물을 처리하였다. 인공적으로 기상을 제어할 수 있는 환경제어모듈(EWGC; Modified CEEWS model, Environmental Growth Chambers, Chagrin Falls, OH, USA)이 설치된 식물생장상을 활용하여 고온·건조 조건을 구현하였다. 멜라토닌 엽면살포 후 7일간 기온은 32°C(야간 26°C), 토양수분함량은 20-24%를 유지 하였고, 처리 종료 후에는 20°C(야간 16°C)에서 재배하였다(Fig. 1).
생육 특성 조사 및 광합성 측정
멜라토닌 엽면살포 후 15일(정식 후 36일)에 각 처리구별로 최대엽장, 최대엽폭, 엽록소(SPAD), 엽수, 엽면적, 지상부의 생체중과 건물중을 조사하였다. 엽록소 함량은 간이형 파장광학 농도차 측정방식(SPAD-502, Konica Minolta, Japan)을 이용하여 측정하였고, 엽면적은 엽면적기계(LI-3100, LI-COR Inc., USA)를 이용하여 측정하였다. 광합성 특성은 휴대용 광합성 측정장치(LI-6400, LI-COR Inc., Nebraska, USA)를 이용하여 고온·건조 스트레스 처리 5일에 배추의 4번째 외엽에서 측정하였다. 측정 조건은 기온 25°C, 상대습도 40-60%, 이산화탄소 농도 400µmol·mol-1, 광도는 500µmol·m-2·s-1로 설정하였다.
단백질 정량 및 malondialdehyde(MDA), H2O2 함량 분석
고온·건조 처리 후 5일에 배추의 외엽(3-5번째)에서 시료를 혼합 채취 후 액체질소를 사용하여 마쇄 하였다. 각 시료 100mg에 1mL PBS(potassium phosphate saline, pH 7.0)를 혼합하여 4°C, 13,000 rpm에서 30분간 원심 분리한 후 상등액(조효소액)을 추출하였다. 단백질은 Bio-rad protein assay(Bio-rad, USA) 시약을 이용하여 Bradford(1976) 방법으로 정량하였다. MDA와 H2O2 함량은 EZ-Lipid peroxidation(TBARS) assay kit(DoGenBio Co., Korea)와 EZ-Hydrogen Peroxide/ Peroxidase Assay Kit(DoGenBio Co., Korea)를 사용하여 분석하였다. 조효소액 시료 100µL와 동량의 indicator solution 용액을 혼합하여 65oC에서 45분간 반응시킨 후 540nm 파장에서 흡광도를 측정(Eon-C Biotek, VT, USA)하여 total MDA 함량을 분석하였다. 조효소액 50µL에 동량의 반응용액(Oxi-probe/HRP working solution)을 혼합하고 상온에서 30분간 빛을 차단하여 반응시킨 후 560nm 파장에서 흡광도를 측정하여 H2O2 함량을 분석하였다.
Ascorbic acid와 proline 함량 분석
배추의 세포내 ascorbic acid(AsA) 함량은 EZ-Ascorbic Acid Assay kit(DoGenBio Co., Korea)을 사용하여 분석하였다. 조효소액 120µL를 반응액 50µL와 혼합하여 상온에서 5분간 빛을 차단하여 반응 후 570nm 파장에서 흡광도를 측정하여 AsA 함량을 분석하였다. Proline 함량은 Bates et al.(1973)의 방법에 따라 분석하였다.
항산화효소 활성 분석
배추의 catalase(CAT), peroxidase(POD) 및 superoxide dismutase(SOD) 활성은 각각 Amplex® Red Catalase Assay Kit(Molecular Probes, USA), Amplex® Red Hydrogen Peroxide/Peroxidase Assay Kit(Molecular Probes, USA), SOD determination kit(Sigma-aldrich, US)를 사용하여 분석하였다(Lee et al., 2017; Lee et al., 2019). Ascorbate peroxidase(APX) 활성은 Ascorbate peroxidase activity assay kit(Elabscience Biotechnology Inc., USA)를 사용하였다. 조효소액 20µL를 160µL의 반응용액과 혼합하여 290nm 파장에서 흡광도를 측정한 후 37°C에서 2분간 반응시키고 다시 290nm에서 흡광도를 측정하였고, APX 활성을 분석하였다. Total antioxidant capacity(TAC)는 EZ-Total Antioxidant Capacity assay kit(DoGenBio Co., Korea)을 사용하여 분석하였다. 조효소액, Copper Reagent, Reaction Buffer 각 100μL를 혼합하여 상온에서 30분간 반응 후 450nm 파장에서 흡광도를 측정하여 TAC 활성을 분석하였다.
통계분석
실험구 배치는 난괴법 3주 3반복으로 하였고, 통계분석은 SAS 프로그램(SAS 9.2, SAS Institute Inc., USA)을 이용하여 분산분석(ANOVA)을 실시하였다. 평균간 비교는 Duncan의 다중검정을 이용하여 5% 유의수준에서 각 처리 간 유의성을 검증하고, 그래프는 SigmaPlot 프로그램(SigmaPlot 12.5, Systat Software Inc., USA)을 이용하여 나타냈다.
결과 및 고찰
배추의 생육 특성
멜라토닌 엽면살포 후 15일(정식 후 36일)에 배추의 생육 특성을 조사한 결과는 Table 1과 같다. 고온·건조에서 멜라토닌 처리시 무처리 대비 생체중이 증가하였고, 특히 10mg·L-1 농도에서 912.8g/주로 가장 높았다. 건물중은 무처리보다 다소 증가하는 경향을 보였으나, 큰 차이가 없었다. 엽면적은 무처리대비 증가하였고, 10mg·L-1 처리시 9,366.8cm2/주로 가장 높았다(Table 1). 고온 조건시 토마토에 멜라토닌 23.2mg·L-1을 처리한 결과 생체중과 건물중이 대략 30% 증가하였고(Jahan et al., 2019), 건조 조건에서 밀과 토마토에 각각 23.2mg·L-1과 20mg·L-1 처리시 생체중과 건물중이 10-20% 증가하여 환경스트레스에 대한 저항성이 보고된 바 있다(Ye et al., 2016; Ibrahim et al., 2020). 배추속 식물인 유채는 고온 조건에서 23.2mg·L-1 처리시 지상부 생체중을 14.2% 증가시켰으나, 통계적으로 유의한 차이를 보이지 않았다(Dai et al., 2020). 본 연구에서 고온·건조 조건시 멜라토닌 처리에 의해 생체중이 무처리 대비 13-27% 증가하였고, 특히 10 mg·L-1에서 가장 높았다. 또한 엽록소함량(SPAD)이 증가하는 경향을 보였다. 따라서 고온·건조 스트레스 조건에서 멜라토닌 경엽처리는 배추의 엽록소 함량을 높게 유지하여 광합성능력 향상에 작용하였고, 스트레스에 의한 생육 저하를 경감시키는것으로 사료된다(Dai et al., 2020).
Table 1.
Kimchi cabbage growth as affected by foliar application of melatonin and exposure to high-temperature and water deficient conditions at 36 days after transplanting.
| Temperature |
Foliar application |
Fresh weight (g/plant) |
Dry weight (g/plant) |
Leaf length (cm/plant) |
Leaf width (cm/plant) |
Chlorophyll (SPAD) |
Number of leaves (no./plant) |
Leaf area (cm2/plant) |
| 20/16°C | H2O | 893.7 abz | 63.2 a | 38.6 a | 27.6 ab | 39.4 b | 46.0 a | 8,705.4 bc |
| 32/26°C | H2O | 743.8 d | 46.1 c | 39.3 a | 27.2 ab | 41.0 b | 47.4 a | 8,216.7 c |
| Me 5 mg·L-1 | 862.1 bc | 55.2 b | 40.1 a | 29.0 a | 50.2 a | 50.7 a | 8,935.0 ab | |
| Me 10 mg·L-1 | 912.8 a | 47.7 bc | 39.3 a | 26.2 b | 50.1 a | 49.3 a | 9,366.8 a | |
| Me 20 mg·L-1 | 842.3 c | 53.0 bc | 39.1 a | 27.2 ab | 49.8 a | 47.7 a | 8,529.4 bc |
배추의 광합성 특성 변화
고온·건조시 멜라토닌 처리 결과 무처리 대비 광합성속도 4.4-11.7%, 기공전도도 9.7-44.2% 및 증산속도 14.3-31.3% 증가하여 높은 광합성 효율을 보였다(Fig. 2). 일반적으로 식물의 기공 변화는 이산화탄소의 흐름, 잎 온도와 수분 손실을 조절하기 위한 환경스트레스에 대한 대응 방법으로 알려져 있다. 대부분 고온은 증산작용으로 잎 온도를 내리기 위해 기공전도도를 증가시키는 반면, 가뭄은 수분 손실을 방지하기 위해 반대로 영향을 미친다(Mittler and Blumwald, 2010). 그리고 토양수분이 부족하게 되면 잎의 수분 포텐셜이 낮아져 기공은 닫히게 되고 세포내 이산화탄소가 정상적으로 공급되지 못하여 기공전도도와 세포내 CO2 농도가 감소한다(Oh et al., 2014; Kim et al., 2017). 고온 또는 건조 조건시 작물에 멜라토닌 처리는 광합성속도, 기공전도도 및 증산 속도를 증가시킨 반면 세포내 CO2 농도에는 변화가 없다고 보고된바있다 (Amad et al., 2019; Dai et al., 2020). 고온과 건조 혼합 스트레스 처리시 단일 조건과 대조구 대비 광합성 속도, 기공전도도 및 증산률이 감소 했으나(Zandalinas et al., 2016), 본 실험에서 멜라토닌 처리시 현저하게 증가하였다(Fig. 2). 이는 멜라토닌 경엽처리가 스트레스에 의한 광합성 능력 저하를 효과적으로 향상 시켰다고 판단된다.
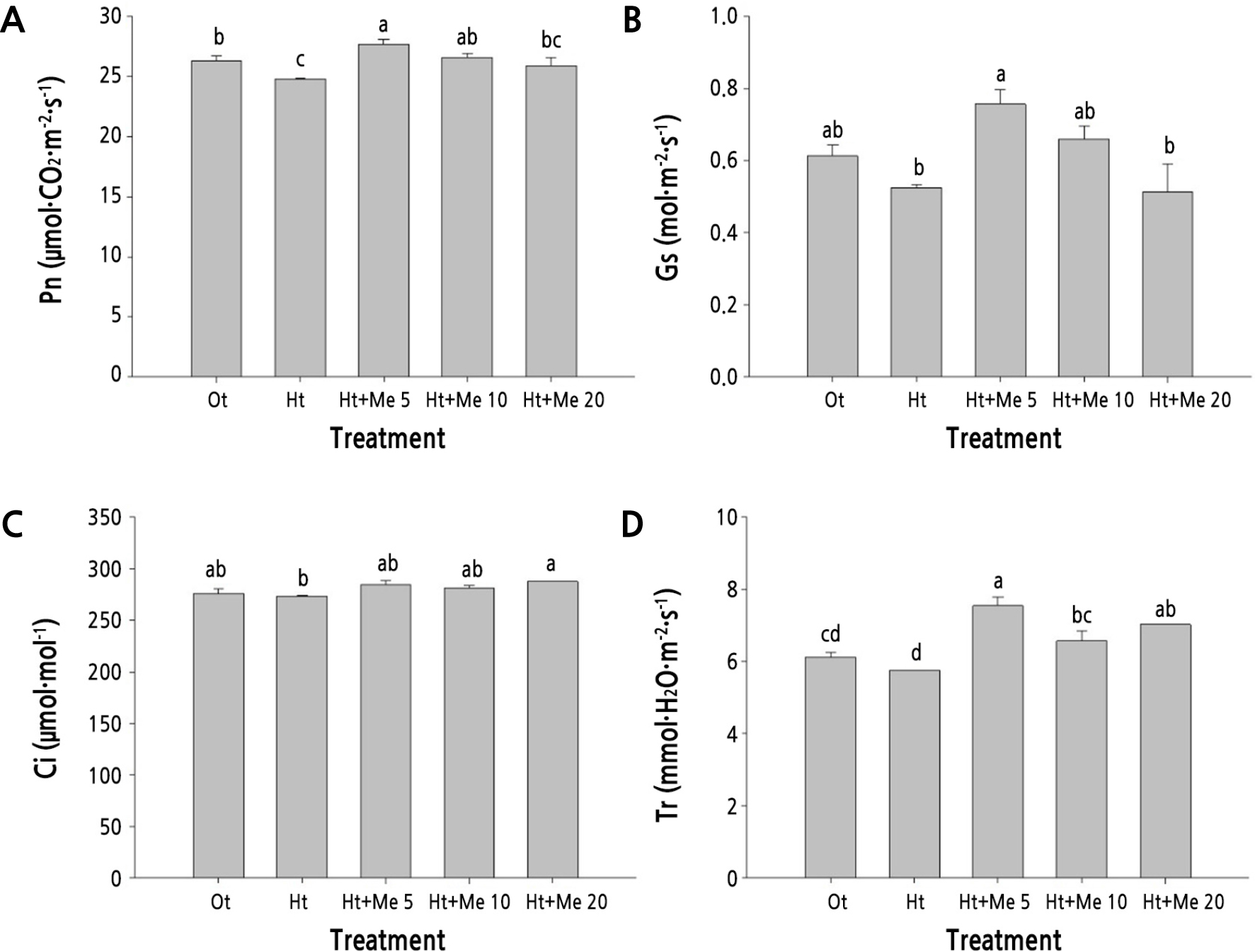
Fig. 2.
Comparison of photosynthetic rate (Pn, A), stomatal conductance (Gs, B), intracellular CO2 concentration (Ci, C), and transpiration rate (Tr, D) of Kimchi cabbage leaves as affected by treatment with different concentrations of melatonin at 5 days after exposure to high-temperature and water deficient conditions. Vertical bars represent the standard error of means from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
배추의 malondialdehyde(MDA) 및 H2O2 함량 변화
고온·건조 조건에서 멜라토닌 처리시 MDA 함량은 처리구간 차이를 보이지 않았으나, 세포내 H2O2 함량은 무처리 대비 감소하였다(Fig. 3). 식물이 환경 변화에 의한 산화스트레스를 받았을 때 세포막 구성 지질 분자의 과산화 반응으로 인한 세포막 파괴가 일어나고, 세포 내용물의 누출로 인해 세포 손상이 더욱 가속화 된다(Dhindsa et al., 1981). 고온 또는 건조 조건시 작물의 멜라토닌 처리는 MDA와 세포내 H2O2 함량을 감소시켜 산화스트레스를 완화 시키고 잎의 노화를 지연시켰다(Yu et al., 2016; Ahmad et al., 2019; Jahan et al., 2019; Buttar et al., 2020; Ibrahim et al., 2020; Tan et al., 2020). 본 연구결과, 고온·건조 조건에서 멜라토닌 10mg·L-1 처리시 무처리 대비 H2O2 함량이 35% 이상 감소 되어 산화스트레스에 의한 피해 경감에 효과적으로 작용하는 것으로 사료 된다. 반면 MDA 함량은 지질 과산화에는 큰 영향을 미치지 못하는 것으로 판단된다.
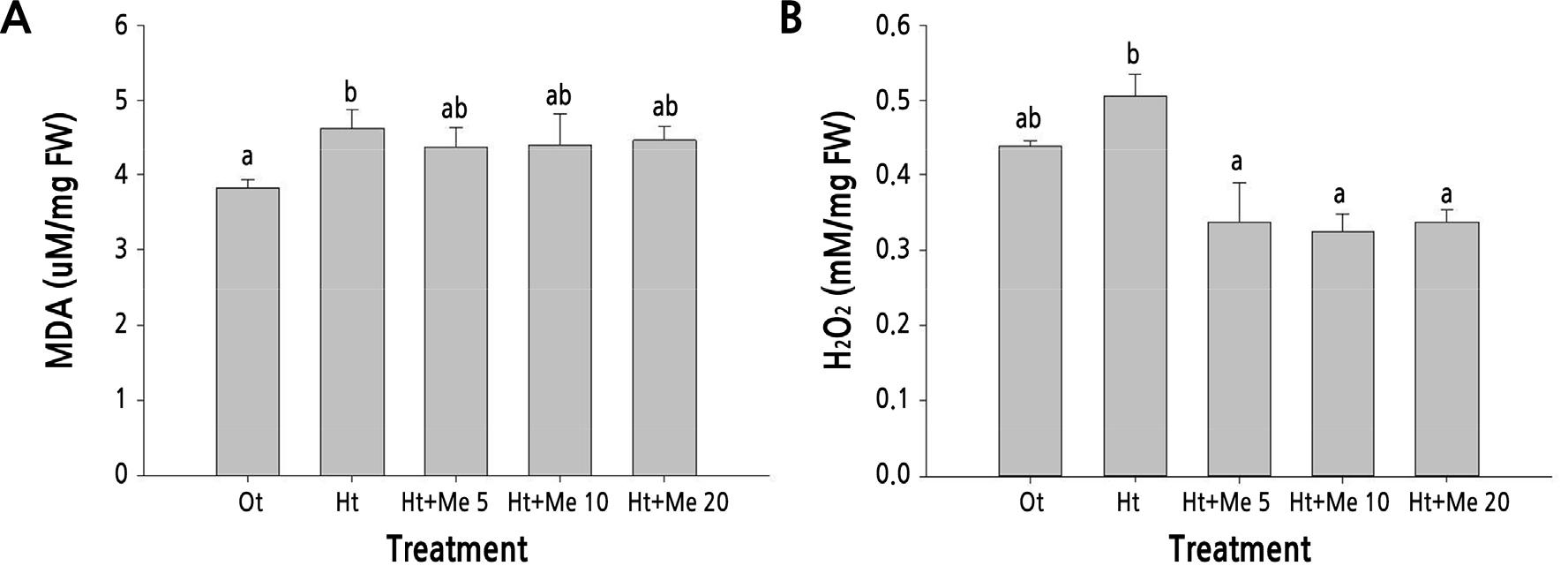
Fig. 3.
Measurement of malondialdehyde (MDA, A) and H2O2 (B) contents in Kimchi cabbage leaves as affected by treatment with different concentrations of melatonin at 5 days after exposure to high-temperature and water deficient conditions. Vertical bars represent standard errors of the mean from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
Ascorbic acid 및 proline 함량 변화
고온·건조 조건에서 멜라토닌 처리시 세포내 AsA 함량은 무처리구 대비 다소 증가하는 경향을 보였으나(Fig. 4A), 고온 또는 건조 조건에서 토마토에 멜라토닌 23.2mg·L-1를 경엽처리 하였을 때 세포내 AsA 함량이 무처리에 비해 현저하게 증가하였다는 연구보고(Jahan et al., 2019; Ibrahim et al., 2020)와는 차이를 보였다. proline 함량은 무처리 대비 증가하는 경향을 보였으며, 20mg·L-1 처리시 가장 높았다(Fig. 4B). 식물은 스트레스 조건에서 proline과 같은 삼투조절물질 등의 대사산물의 생성을 변화시키고, 삼투조절물질의 축적은 세포삼투압을 조절하여 단백질과 세포막을 안정화시키는 것으로 알려져 있다(Suzuki et al., 2014). 고온 조건에서 밀에 멜라토닌 23.2mg·L-1 처리시 proline 함량이 무처리 대비 4배 이상 증가하였다(Buttar et al., 2020). 건조 조건의 옥수수에 4.7-23.2mg·L-1 처리시 proline 함량은 무처리에 비해 증가하였고, 멜라토닌 처리 농도에 따라 proline 함량이 비례적으로 증가하였다(Ahmad et al., 2019). 본 연구 결과, 멜라토닌 처리시 proline 함량은 처리농도와 비례하여 무처리 대비 10-57%까지 증가하였고(Fig. 4B), 이는 스트레스 조건에서 멜라토닌의 경엽처리가 세포 삼투압조절에 효과적인 것으로 판단된다.
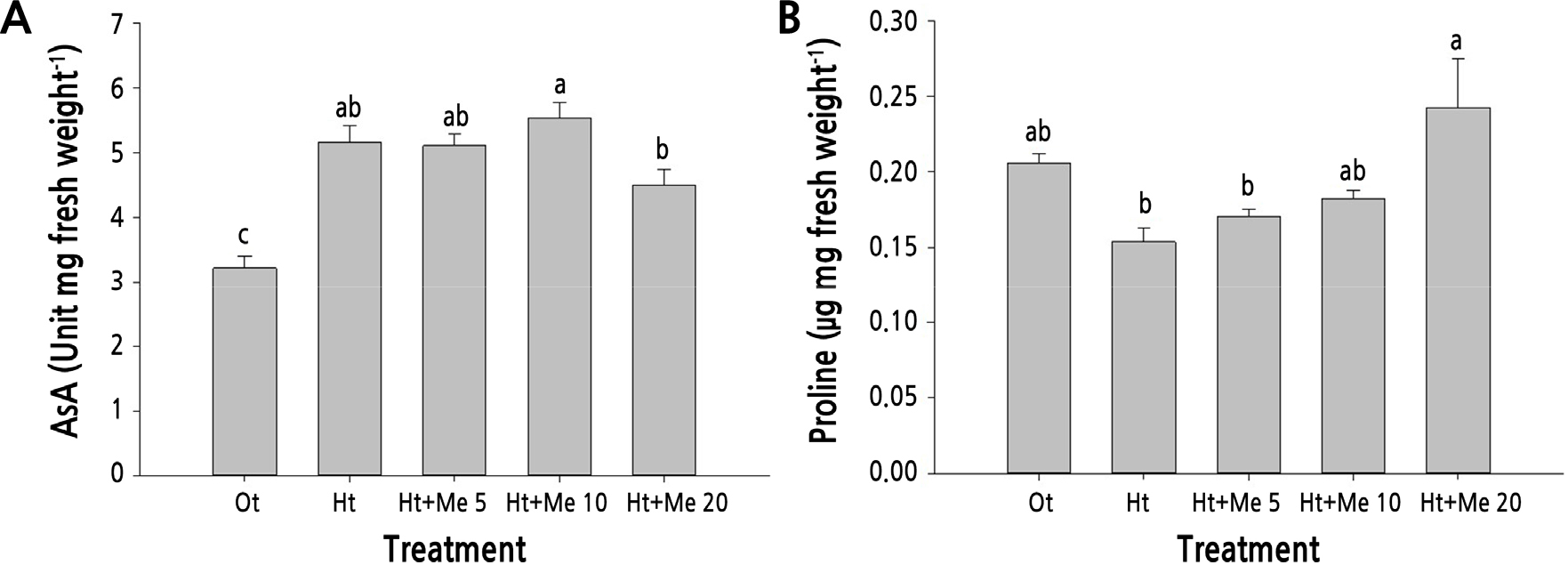
Fig. 4.
Comparison of ascorbic acid (AsA, A) and proline (B) contents in Kimchi cabbage leaves as affected by treatment with different concentrations of melatonin at 5 days after exposure to high-temperature and water deficient conditions. Vertical bars represent the standard errors of the mean from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
항산화효소 활성 변화
고온·건조시 멜라토닌 처리결과 항산화효소 활성은 무처리 대비 증가하는 경향을 보였다. 특히 APX와 SOD 활성은 전반적으로 증가하였으며, 10mg·L-1 처리시 무처리 대비 각각 51%와 35% 로 가장 높았다(Fig. 5). CAT, POD 및 TAC 활성은 다소 증가하는 경향을 보였고, 10mg·L-1에서 가장 높았다(Fig. 6). 일반적으로 작물은 고온, 건조와 같은 환경 스트레스에 노출되면 활성산소의 생성에 의해 생장과 발달에 피해를 받을 뿐 아니라 항산화효소와 같은 산화방지 물질의 활성으로 식물의 자체 방어 기작에 의하여 스트레스에 저항성을 보인다(Foyer et al., 1994; Mittler, 2002; Hu et al., 2007). 환경 스트레스 조건에서 작물에 멜라토닌 처리시 항산화효소 활성은 전반적으로 증가하였으나, 스트레스 조건에 따라 다양하게 나타났다. 염 또는 고온 조건에서 토마토의 멜라토닌 4.7mg·L-1 처리시 APX, CAT 및 SOD 활성이 무처리 대비 증가하였다(Qi et al., 2018; Siddiqui et al., 2019). 한편 염과 고온 조건에서 23.2mg·L-1 처리시 SOD 활성은 감소하고 APX와 CAT는 증가하여 염 또는 고온의 단일 스트레스 조건과 다른 경향을 보였다(Martinez et al., 2018). 또한 고온과 건조 스트레스 처리시 APX와 SOD의 활성 및 유전자 발현은 단일 스트레스 처리에 비해 증가하였다(Rizhsky et al., 2002; Koussevitzky et al., 2008). SOD는 superoxide anion radical(O2-)을 제거시키는 작용(2O2 + 2H → H2O2 +O2)을 하는 효소로써 활성산소종에 대한 1차적 방어작용을 하는 대표적 활성 저해제이다(Bannister et al., 1987). CAT, APX, POD는 환경 스트레스 조건시 활성이 증가된 SOD에 의해 생성되는 과산화수소를 물분자와 산소분자로(2H2O2 → O2 + 2H2O) 분해함으로써 과다한 활성산소종에 의한 피해를 감소시키는 것으로 알려져 있다(Kang et al., 1998). 본 연구에서 고온·건조시 멜라토닌의 엽면 살포는 APX와 SOD 활성을 증가 시켰으나 CAT, POD 및 TAC 활성은 각 처리간 큰 차이가 없었다(Figs. 5 and 6). 이는 멜라토닌 처리시 항산화효소 활성의 변화는 환경스트레스의 종류, 노출되는 생육단계와 기간 등에 따라 다르게 영향을 받는 것으로 사료된다.
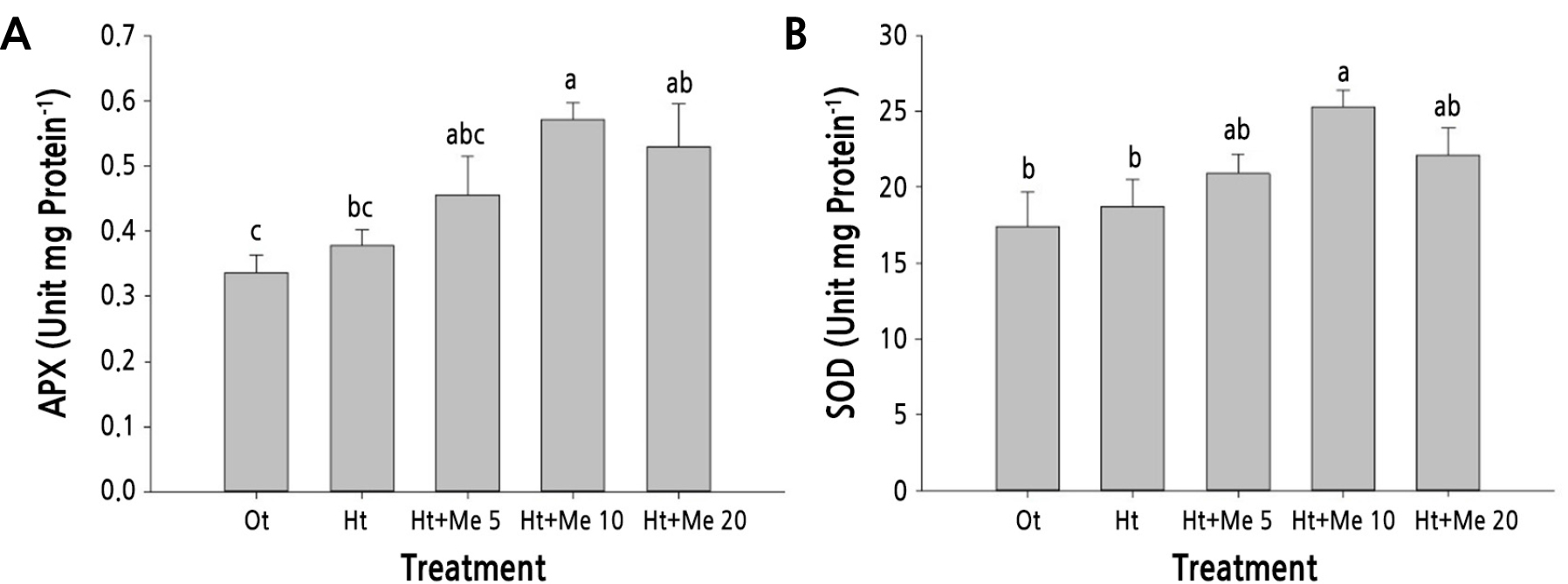
Fig. 5.
Fig. 5. Comparison of ascorbate peroxidase (APX, A) and superoxide dismutase (SOD, B) activity levels in Kimchi cabbage leaves as affected by treatment with different concentrations of melatonin at 5 days after exposure to high-temperature and water deficient conditions. Vertical bars represent the standard errors of the mean from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
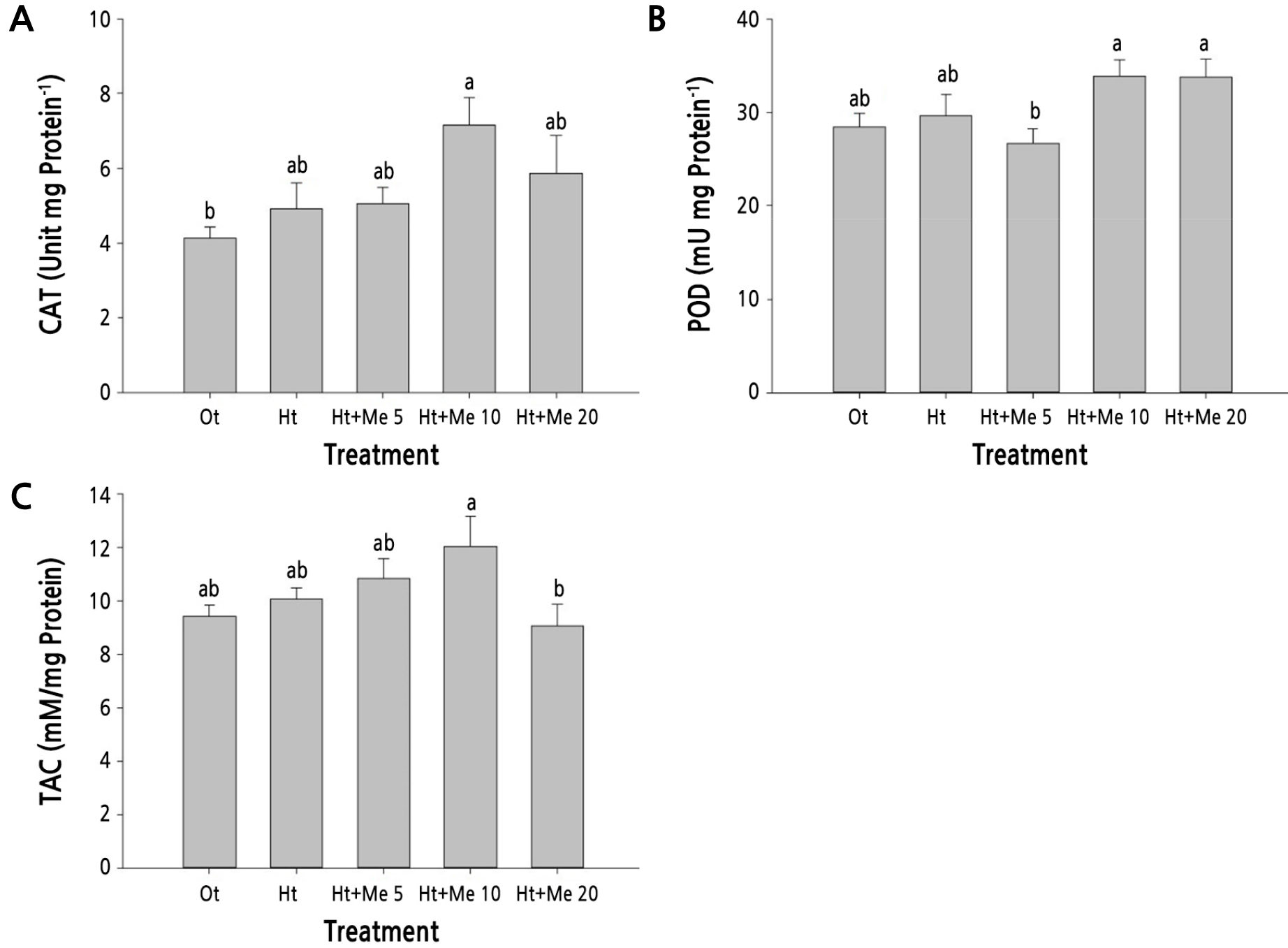
Fig. 6.
Comparison of catalase (CAT, A), peroxidase (POD, B), and total antioxidant capacity (TAC, C) activity levels in Kimchi cabbage leaves as affected by treatment with different concentrations of melatonin at 5 days after exposure to high-temperature and water deficient conditions. Vertical bars represent the standard errors of the mean from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
따라서, 고온·건조 조건시 배추에 멜라토닌 경엽처리는 광합성특성을 향상시키고 생체중을 증가시켰다. 세포내 과산화수소 함량을 효과적으로 감소시키고, APX와 SOD 등의 항산화효소 활성과 proline 축적을 증가시킴으로써 스트레스에 의한 피해 경감에 긍정적으로 작용했다고 사료 된다. 또한 고온·건조 조건시 배추를 대상으로 멜라토닌 처리농도별 효과를 종합적으로 고려해볼 때 10mg·L-1 처리가 적정한 시비 농도라 판단된다.