서 언
국내 절화류 재배면적 및 생산액은 2021년 1,205ha, 1,740억 원으로 전체 화훼 재배면적 및 생산액에 각각 약 28.6%와 32.3%를 차지하고 있다(MAFRA, 2022). 거베라는 2021년 국내 재배면적 23.4ha, 생산량 1,454만 본, 생산액 54.2억 원으로 장미, 국화, 백합, 카네이션과 함께 주요 절화류 중 하나이다. 세계적으로 교역량이 많은 거베라는 절화용, 분화용, 정원용으로 다양하게 이용되며, 특히 절화용 비중이 높아 절화품질 관련 연구가 꾸준히 보고되고 있다(Park and Kim, 2022). 1980년대 초 오일쇼크 이후 우리나라에 도입되어 재배 시설의 기온을 10°C 이상 유지하면 연중 개화가 가능한 소득 작목으로 남부지역을 중심으로 생산규모가 확대되었고, 2021년 경북 및 경남 지역의 거베라 재배면적은 각각 12.8ha, 9.6ha로 전체 재배면적의 약 96%를 차지하고 있다(MAFRA, 2022).
현재 국내에서 재배되는 거베라는 네덜란드를 포함한 유럽 육종회사에서 육성한 품종이 대부분이다(Park et al., 2012). 종묘 수입은 2000년 31.7만 주에 불과하던 것이 2006년에는 98.7만 주로 약 3배 이상 크게 증가하였으며, 2021년 현재까지 연간 약 60–70만 주의 조직배양묘가 수입되고 있다(APQA, 2021). 특히 거베라는 2004년부터 품종보호 대상작물로 지정되면서 해외 로열티 지불에 따른 재배농가 부담이 가중되어 국내 육성 품종 보급효율을 높이기 위한 방안 모색이 요구된다(Choi, 2002). 외국 품종에 대한 의존도가 높은 이유는 국산 품종 수급 불안이다. 국내에서 거베라는 주로 조직배양묘로 농가에 보급되고 있으며 보급시기는 매년 품종갱신 시기인 3–5월 전후에 집중된다(Chung and Lee, 2019; RDA, 2022). 그러나 계절적 수요 특성에 따라 일시에 여러 품종을 대량으로 공급하기에는 국내 종묘회사 규모가 영세하고, 기내 소식물체를 유지하는 과정은 숙련 작업자 수작업에 의존하기 때문에 인건비가 전체 종묘생산 비용의 약 60%에 이른다(Kozai, 1991). 노동력과 배양배지에서 기인한 고비용은 수급 불안의 직접적인 원인이 되고 있어 이에 대한 해결 방안 마련이 시급하다.
식물조직배양에 관한 연구는 1898년 오스트리아의 Gottlieb Haberlandt에 의해 처음 발표된 이후 1950년대 Skoog가 담배 조직배양을 위한 배지 조건에 대하여 연구하였다(Murashige and Skoog, 1962). 이를 계기로 상업적인 미소대량증식(micropropagation)은 꾸준히 주목받아왔다(Rahman et al., 2011). 원예 선진국인 프랑스와 네덜란드의 경우 일찍이 조직배양 산물을 기내에서 장기간 저장하는 체계를 구축하였다(Assy-Bah and Engelmann, 1993; Negash et al., 2001). 연중 생산된 기내 소식물체를 저온 등 생장 억제 조건에서 저장하였다가 원하는 시기에 묘를 출하하면 정식시기 확대, 온실 이용 효율 향상, 인력 분산 및 생산비 절감과 같은 여러 이점이 있다(Park and Chae, 1993). 이러한 이유로 몇몇 작목에서 조직배양묘에 대한 저온 저장연구가 보고되었으나(Joy et al., 1991; Lee et al., 2015), 거베라에서는 아직까지 보고된 바 없다.
거베라는 매년 상당량의 종묘가 수입되는 영양번식 화훼류로 국내생산 기반 약화에 따른 종묘 수급 불안이 수입 증가를 초래하는 실정으로 국내 품종 보급과 안정 생산을 위해서는 종묘 보급 효율을 높이는 것이 필요하며, 조직배양묘의 장기저장성 파악이 요구된다. 따라서 본 연구는 국산 거베라를 기내 발근묘 상태로 저온 저장할 때 저장 기간에 따라 온도 및 광 조건 등을 달리하여 계대배양 빈도를 최소화하면서도 순화 후 건전 생육이 가능한 저장 조건을 구명함으로써 향후 국내 우량품종 보급 확산에 기여하고자 수행하였다.
재료 및 방법
식물재료
식물재료로는 2010년 농촌진흥청 국립원예특작과학원에서 육성한 거베라 ‘Harmony’ 품종으로 전북 부안 소재 종묘업체에서 구입한 기내 배양 중인 조직배양묘를 사용하였다. 조직배양 배지조건은 MS기본배지(Murashige and Skoog, 1962)에 sucrose 20g·L-1 와 한천 8g·L-1 를 첨가 후 450 mL 유리 배양용기에 50 mL씩 분주하였다. 온도 25 ± 2°C, 광도 30 ± 10µmol·m-2·s-1 PPFD, 16시간 광주기의 배양환경에서 자란 조직배양묘를 발근배지로 옮겨 3주간 발근시킨 기내 소식물체를 배양용기 그대로 저장처리 하였다. 초장 5.1 ± 0.3 cm, 엽수 7.0 ± 1.0매, 건물중 0.021 g이었고 용기당 배양묘는 15개체씩 시험구 배치는 3반복 완전임의배치하였다.
저장 처리 및 기간
저장 처리는 저온 실험상(VS-1302L, VS, Korea)을 이용하여 온도 조건 2수준(4 ± 0.3°C, 8 ± 0.8°C), 광조건 2수준(광 30µmol·m-2·s-1, 암 0µmol·m-2·s-1)을 교호 처리하였다. 광조건은 16시간 일장으로 설정하였다. 온도 및 광조건 처리는 각각 4°C 광처리구(T-4L), 4°C 암처리구(T-4D), 8°C 광처리구(T-8L), 8°C 암처리구(T-8D)로 구분하여 표시하였다. 저장 기간은 3, 6, 9, 12, 24, 36, 48주로 처리하였다.
묘소질 분석
저온 기간별 저장조건에 따른 기내 조직배양묘의 초장, 엽수, 황화율, SPAD값 건물중 및 지상부 고사율을 조사하였다. 잎이 모두 황화 되고 지상부의 2/3 이상이 고사한 경우 고사주로 판정하였다. 초장은 주당 최장 엽병 길이로 측정하였고, 황화율은 전체 엽수를 기준으로 황화된 엽수 비율로 계산하였다(Hempel and Hempel, 1987). 건물중은 배양묘를 70°C에 3일간 완전히 건조한 후 중량의 변화가 없을 때 측정하였다. 엽록소 지수인 SPAD값은 휴대용 엽록소 측정기(SPAD-502 Plus, KONICA MINOLTA, Japan)로 완전히 전개된 잎을 측정하였다.
엽록소 형광분석
엽록소 형광반응 변화는 형광 이미지 분석기(FluorCam 800MF, PSI, Czech)를 이용하여 15분간 암적응 후 Quenching kinetics analysis방법으로 최대 광화학적 효율(Fv/Fm), 비광화학적 소광(non-photochemical quenching, NPQ) 등의 형광 매개변수를 측정하고 이미지를 촬영하였다(Barbagallo et al., 2003). 카메라 전자 셔터와 주변 광수준에 맞춰 자동으로 감도를 조절하도록 FluorCam을 설정하였다. 측정된 데이터는 Gorbe and Calatayud(2012)가 제시한 정의에 따라 분석하였다.
통계 처리
통계분석 프로그램인 SAS package(statistical analysis system, version 9.4, SAS Institute Inc., Cray, NC, USA)를 이용하여ANOVA 분석(analysis of variance)을 실시한 후 각 처리 간의 유의성은 DMRT(Duncan’s new multiple range test) 5% 수준으로 하였다.
결과 및 고찰
지상부 묘소질 변화
기내 거베라 조직배양묘의 지상부는 저장 기간에 따라 광 유무와 온도인 저장조건의 영향을 달리 받았다(Table 1). 고사 정도는 저장 12주까지 온도 또는 광 유무와 상관없이 모든 처리구에서 0주 차 대비 약 10% 미만으로 고사율이 매우 낮았다. 그러나 24주 차부터 온도 조건, 광 유무에 따라 소식물체 생존력이 차이를 보였다. 24주 차에 고사율은 4°C 광처리구(T-4L)에서 약 26.4%, 4°C 암처리구(T-4D)에서 약 46.3%로 급격히 고사되었고, 48주 차에 T-4L, T-4D는 광의 유무와 관계없이 모두 고사하였다. 반면 8°C 광처리구(T-8L)는 36주까지 지상부가 100% 생존하였고 8°C 암처리구(T-8D)에서는 약 13.3%만이 고사하였다. 하지만 48주 차에는 T-8L에서 약 60%, T-8D에서는 100% 고사율을 나타냈다.
저장 기간이 경과함에 따라 온도 조건별로 묘소질도 뚜렷한 차이를 보였다(Table 1 and Fig. 1). 초장 증가율(Fig. 1A)은 저온 저장 36주까지 광의 유무에 관계없이 8°C에서 4°C 보다 약 5–38% 더 높았고, 엽수(Fig. 1B)도 약 1.4–1.6배 더 많았다. 한편 건물중(Fig. 1C)은 광의 유무가 영향을 주었는데, 특히 T-8L가 유의적으로 증가하여 기내 생장이 진행됨을 알 수 있었다. 반면 4°C는 8°C에 비하여 생장지연에 효과적인 것으로 나타났다.
Table 1.
Effects of the storage temperature and light availability on the quality and shoot withering of in vitro gerbera ‘Harmony’ plantlets under long-term storage conditions
| Treatment |
Storage period (weeks) |
Plant height (cm) |
No. of leaves (per plant) |
Dry weight (g) |
Shoot withering (%) |
| Initial value | 0 | 5.1 ghy | 7.0 gh | 0.021 j | 0.0 e |
| T-4Lz | 3 | 5.6 d-h | 8.0 d-h | 0.037 d-j | 0.0 e |
| 6 | 5.6 d-h | 9.0 d-h | 0.071 ab | 0.0 e | |
| 9 | 5.6 d-h | 8.7 d-h | 0.039 d-j | 4.3 e | |
| 12 | 5.2 gh | 8.7 d-h | 0.036 e-j | 6.7 e | |
| 24 | 4.7 h | 6.3 h | 0.024 hij | 26.7 d | |
| 36 | 5.7 d-h | 7.3 fgh | 0.035 e-j | 57.7 bc | |
| 48 | n/aw | ||||
| T-4D | 3 | 6.1 c-g | 8.0 d-h | 0.032 g-j | 0.0 e |
| 6 | 6.9 a-e | 8.3 d-h | 0.055 e-f | 0.0 e | |
| 9 | 5.4 e-g | 9.3 d-g | 0.030 g-j | 0.0 e | |
| 12 | 5.2 gh | 7.3 fgh | 0.030 g-j | 6.7 e | |
| 24 | 5.1 gh | 8.7 e-h | 0.022 ij | 46.3 c | |
| 36 | 6.1 c-g | 7.0 gh | 0.025 hij | 71.0 a | |
| 48 | n/a | ||||
| T-8L | 3 | 6.8 b-e | 8.7 e-h | 0.037 d-j | 0.0 e |
| 6 | 6.2 c-g | 8.7 e-h | 0.062 abc | 0.0 e | |
| 9 | 6.3 b-g | 8.3 e-g | 0.047 c-g | 0.0 e | |
| 12 | 7.0 a-d | 9.7 c-g | 0.043 c-h | 0.0 e | |
| 24 | 7.2 abc | 12.7 b | 0.055 b-e | 0.0 e | |
| 36 | 7.8 ab | 12.0 bc | 0.079 a | 0.0 e | |
| 48 | 8.8 a | 15.3 a | 0.056 bcd | 60.0 ab | |
| T-8D | 3 | 6.1 c-g | 7.3 fgh | 0.025 hij | 0.0 e |
| 6 | 7.0 a-d | 7.7 e-g | 0.049 c-j | 0.0 e | |
| 9 | 6.2 c-g | 10.7 bcd | 0.034 f-j | 0.0 e | |
| 12 | 6.5 b-g | 9.7 c-g | 0.036 d-j | 0.0 e | |
| 24 | 5.1 gh | 10.0 c-f | 0.033 g-j | 0.0 e | |
| 36 | 6.4 b-g | 10.3 b-e | 0.043 c-h | 13.3 e | |
| 48 | n/a | ||||
| Significancex | |||||
| Light (A) | NS | * | *** | NS | |
| Temperature (B) | *** | *** | *** | *** | |
| Storage period (C) | *** | *** | *** | *** | |
| (A) × (B) | ** | * | NS | *** | |
| (A) × (C) | NS | NS | NS | * | |
| (B) × (C) | NS | ** | *** | *** | |
| (A) × (B) × (C) | NS | NS | NS | NS | |
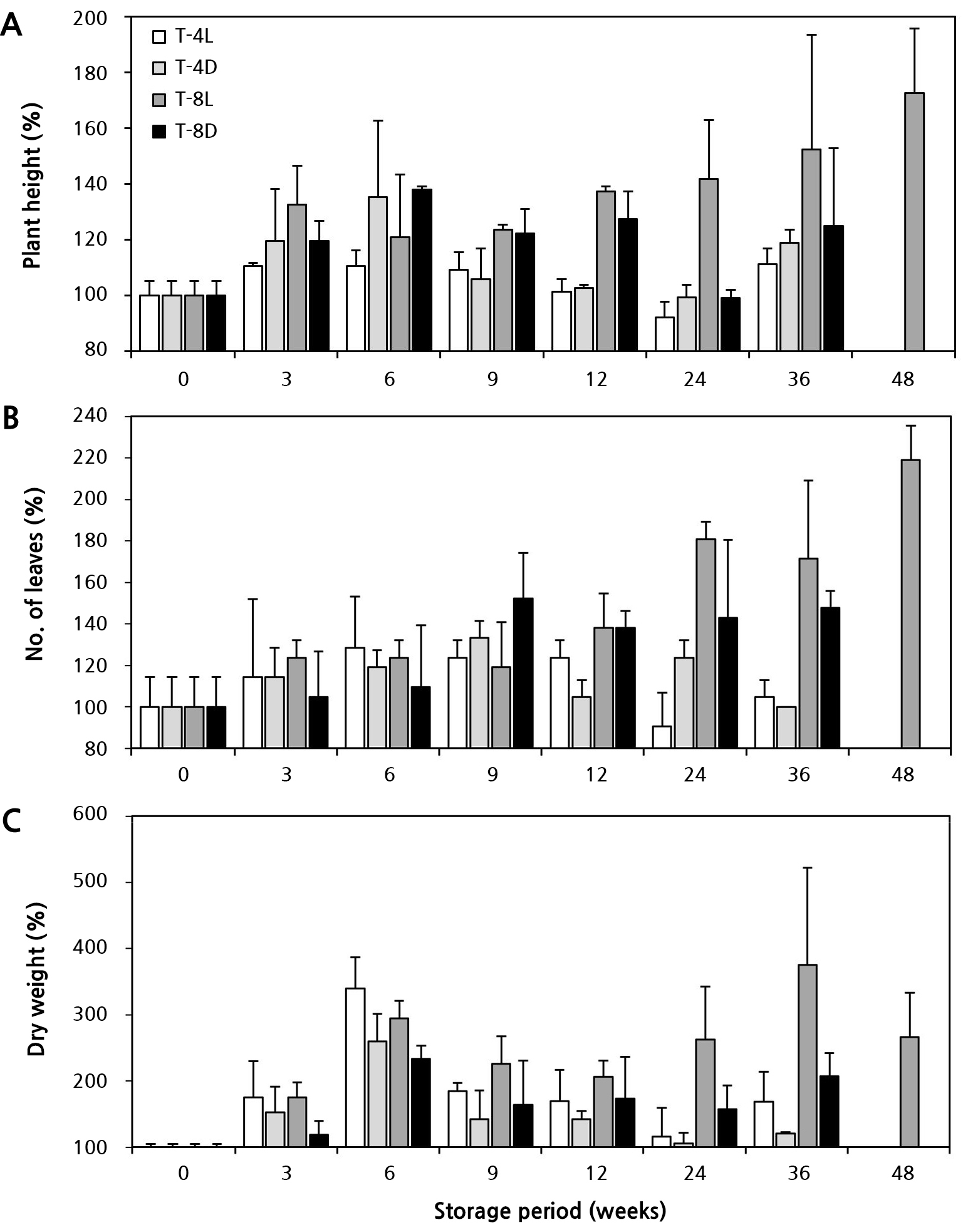
Fig. 1.
Effects of the storage temperature and light availability on the quality of in vitro gerbera ‘Harmony’ plantlets under long-term storage conditions. T-4L (4°C, light), T-4D (4°C, darkness), T-8L (8°C, light), T-8D (8°C, darkness). A: Plant height (%); B: No. of leaves (%); C: Dry weight (%). Vertical bars represent the standard deviation (n = 9).
저온조건에서 지온이 감소하면 물의 점도는 상승하여 배지 내 수분퍼텐셜이 감소한다. 반대로 식물체 뿌리 세포의 생리적 기능은 저하되어 세포벽 팽압이 낮아지면서 생장이나 잎의 확장과 같은 팽압 의존적 과정들이 억제된다(Kant et al., 2008; Ruelland and Zachowski, 2010; Kim et al., 2020; Lee et al., 2020). 축소된 식물의 크기나 엽수는 증산을 낮추어 한정된 수분 공급환경에 효과적으로 대처가 가능한 것으로 보고하였다(Burssens et al., 2000). 본 연구에서 저온 저장 기간이 경과함에 따라 T-4L, T-4D가 T-8L, T-8D에 비하여 초장, 엽수, 건물중 등에서 생장지연 현상이 나타난 것은 상대적으로 온도가 낮고 생장 정지 온도인 5°C 이하 조건으로 인해 휴면 수준의 상태 지속과 함께 표현형적 유연성이 작동한 것으로 판단된다(Debat and David, 2001).
잎의 황화율(Fig. 2A) 역시 저장 기간, 광의 유무에 크게 영향을 받았다. T-4D에서 9주 차에 약 28.1%, 12주 차에 약 32.1%로 나타났으나, T-4L에서는 각각 11.1%, 15.3%로 절반 수준이었다. 저온 저장 36주 차에는 T-4L에서는 약 67.9%까지 늘어나서 12주 차와 비교하여 4.5배 이상 급격하게 증가하였다. 반면 T-8L에서는 12주 차에 약 10.4%로 거의 발생하지 않았고, 24주 차에는 약 13.0%로 4°C 광처리의 12주 차 수준을 나타냈다. 하지만 T-8D는 T-8L보다 약 14–21% 더 높게 나타났다.
잎의 엽록소 지수인 SPAD값은 저장 9주 차까지 가장 높게 유지되었으나, 저장 36주 차에는 T-4L, T-4D에서 광의 유무와 상관없이 약 60.4–80.1%까지 크게 감소하였다(Fig. 2B). 반면 T-8L에서는 36주 차에도 약 50.5% 수준을 유지하였다. SPAD값을 통해 광의 효과는 저장 온도(4°C < 8°C)에 영향을 받는 것을 알 수 있었다(Justus and Kubota, 2010).
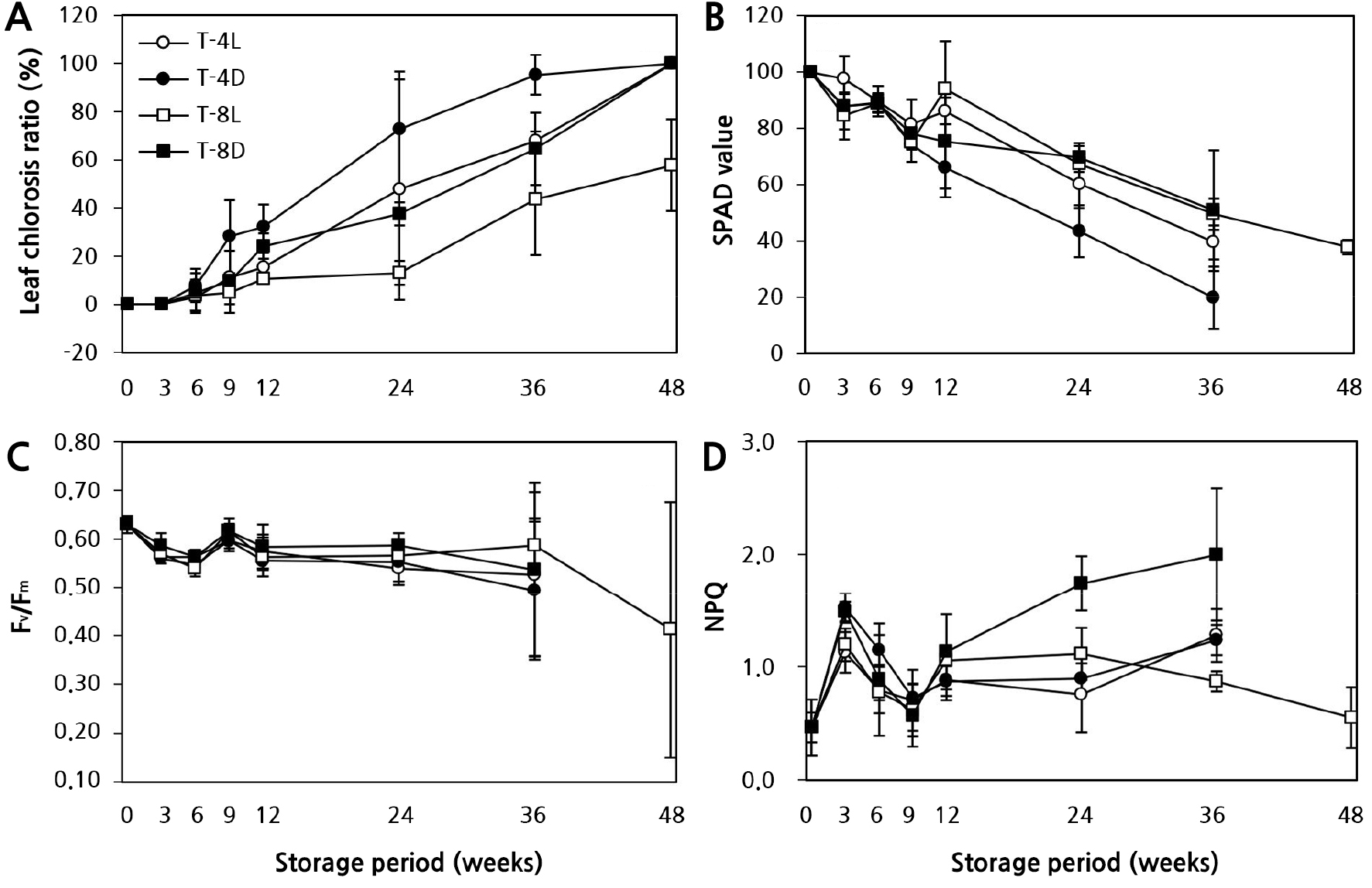
Fig. 2.
Effects of the storage temperature and light availability on the quality and chlorophyll fluorescence parameter of in vitro gerbera ‘Harmony’ plantlets under long-term storage conditions. T-4L (4°C, light), T-4D (4°C, darkness), T-8L (8°C, light), T-8D (8°C, darkness). A: Leaf chlorosis ratio (%); B: SPAD value (%); C: Fv/Fm, Maximum quantum yield of PSII photochemistry; D: NPQ, non-photochemical quenching. Vertical bars represent the standard deviation (n = 9).
비생물적 스트레스는 식물에게 1차적, 2차적 영향을 초래한다. 수분퍼텐셜 감소나 세포 탈수와 같은 1차적 영향은 세포의 물리 ․ 생화학적 성질을 변화시켜 생장을 감소시키고, 순차적으로 생체막 구조 및 광합성기구 손상과 같은 2차적 영향이 나타난다(Anami et al., 2009). 2차적 효과는 일시적으로 불량환경에 대한 저항성을 유도하지만 지속적인 불량환경조건은 식물세포 내 항상성을 저해함으로써 지상부 황백화와 같은 형태적 변화를 유발하며 결국 세포를 죽음에 이르게 한다고 알려져 있다(Ruelland and Zachowski, 2010). 본 연구에서 저온 저장 기간이 경과함에 따라 12주 이후 T-8D, T-8L 대비 T-4L, T-4D에서 지상부 고사율과 잎의 황화현상이 급격히 증가된 것은 1, 2차 저해 현상이 발생한 것으로 보이며, 상대적으로 생장 한계 온도 범위 이상의 T-8L에서는 저장 중에도 광합성과 엽록소 합성 등 물질대사가 작지만 지속적으로 이뤄지고 있었음을 알 수 있다. 특히 엽록소 생합성이 불가능한 T-4D, T-8D에서 세포의 항상성이 저해되어 노화가 가속화한 것으로 생각된다.
엽록소 형광반응
엽록소 형광분석법에 의한 식물의 비생물적 스트레스 지표 연구는 1931년 Kautsky와 Hirsch가 암적응된 잎에 섬광이 조사되면 독특한 양상으로 엽록소 형광이 방출된다는 것(Kautsky effect)을 최초로 밝힘으로써 시작되었다(Govindjee, 2004). 이후 다양한 환경 스트레스에 대하여 광합성 기구 변화를 비파괴적으로 측정할 수 있기 때문에 식물의 생리적 상태와 반응을 연구하는데 유용한 도구로 활용되고 있다(Oh et al., 2014). Fv/Fm값은 광화학반응의 최대 양자수율로서 건전한 식물의 잎에서는 0.78–0.84 범위의 값을 나타내며, 이보다 낮으면 광계II 반응중심이 불활성화 되었거나 손상을 받은 것으로 보고되었다(Takahashi and Murata, 2008). 본 실험에서 저온 저장조건 및 저장 기간에 따른 기내 거베라 조직배양묘에서 나타나는 광계II 반응중심의 들뜬 에너지 포획능 변화를 알아보기 위하여 형광 파라미터를 조사하였다. 그 결과(Fig. 2C and 2D), 거베라 조직배양묘 0주 차의 Fv/Fm은 0.63이하 값을 보였다. 이는 기내 미세환경에서 스트레스가 유발된 것으로 생각된다. 한편 저온저장 36주 차 Fv/Fm 값은 T-4D에서 0.49로 가장 낮았고, T-8L에서 0.59로 상대적으로 가장 높게 나타났다(Fig. 2C). T-8L에서 광계II의 광양자 수율은 증가한 반면, NPQ는 모든 처리구 중 가장 낮게 나타났다(Fig. 2D). 이것은 전자전달의 흐름이 광계I의 순환적 전자전달 등으로 산소가 환원되어지는 것보다 광계II를 통한 전자전달이 증가한 것으로 판단된다. 특히 SPAD값과 가시적 관찰에서는 차이를 알 수 없었지만, NPQ 촬영을 실시한 결과, 저장 기간, 온도 조건, 광 유무에 대한 광화학적 차이를 확인할 수 있었다(Figs. 3 and 4).

Fig. 3.
in vitro gerbera ‘Harmony’ plantlets under different storage conditions. A: in vitro rooting and elongation stage at 21 days (plantlet at the beginning of the experiment); B-E: 36 weeks after low temperature storage; B: T-4L (4°C, light); C: T-4D (4°C, darkness); D: T-8L (8°C, light); E: T-8D (8°C, darkness); F: 48 weeks after low temperature storage; T-8D (8°C, darkness).
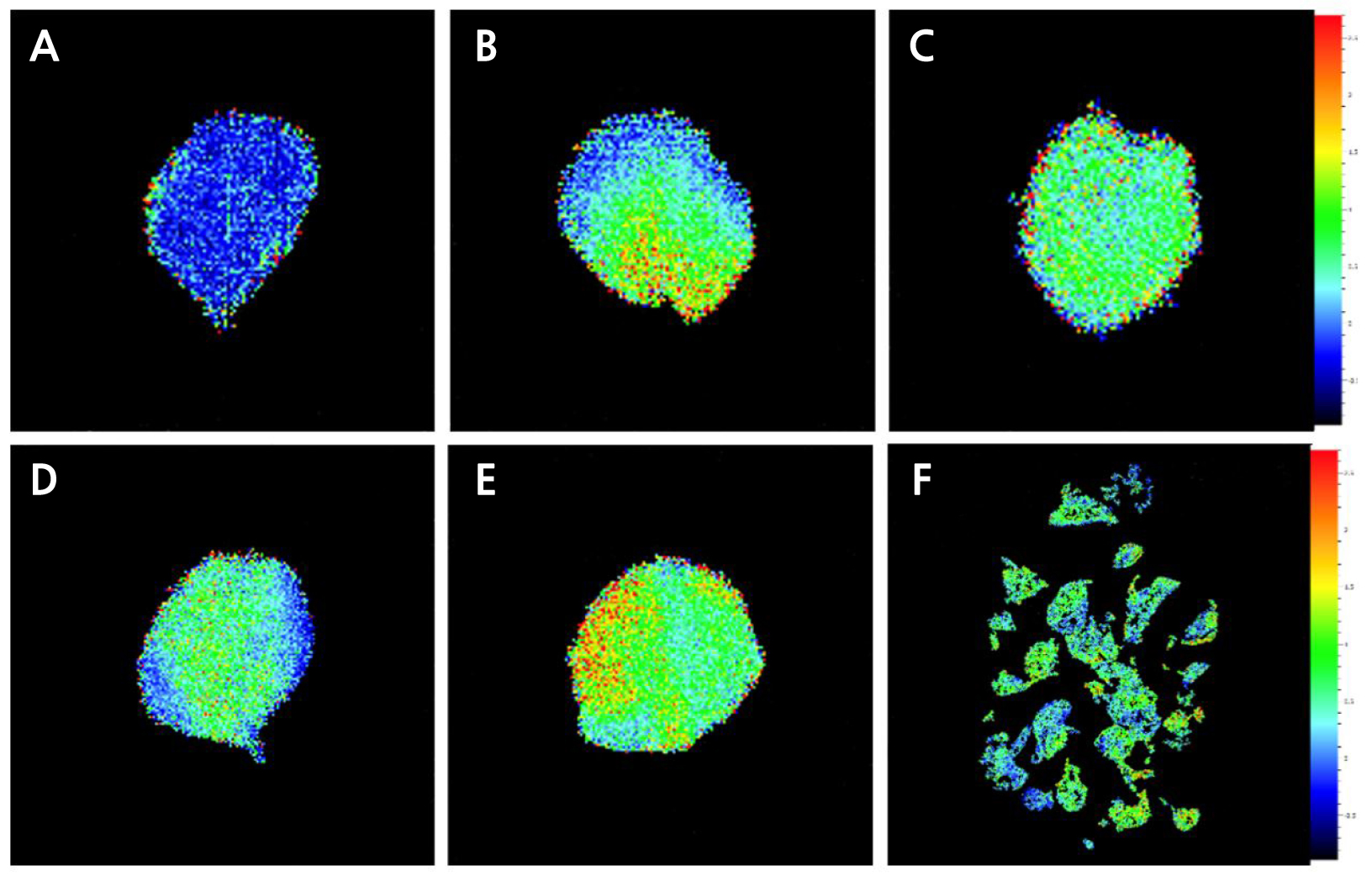
Fig. 4.
Effects of the storage temperature and light availability on the chlorophyll fluorescence imaging (NPQ, non- photochemical quenching) of in vitro gerbera ‘Harmony’ plantlets under long-term storage conditions. A: in vitro rooting and elongation stage at 21 days (plantlet at the beginning of the experiment); B-E: 36 weeks after low temperature storage; B: T-4L (4°C, light); C: T-4D (4°C, darkness); D: T-8L (8°C, light); E: T-8D (8°C, darkness); F: 36 weeks after low temperature storage; T-8D (8°C, darkness).
이상에서 저장조건은 저장 기간에 따라 기내 거베라 조직배양묘의 저장성에 영향을 주었다. 12주 단기 저장조건에서는 4°C, 8°C 온도 차이 없이 광이 있는 조건에서 묘의 품질은 양호하게 유지되었다. 반면 12주 이후 장기 저장 조건에서는 온도(4°C < 8°C)와 광이 묘소질 유지에 직접적인 영향을 나타냈다. 8°C 광조건에서 36주까지 정상적으로 기내 저온저장이 가능하였다(Fig. 3). 현재 거베라 조직배양묘로 저온저장 후 상업적으로 공급하는데 기준이 명확하지 않지만, 순화시켜 정식하기 위해서는 황화율 10% 미만으로 지상부 생존율 90% 이상이 적정할 것으로 기대된다. 본 실험에서 12주까지는 4°C, 8°C 광조건이 이를 충족하며 12주 이상 장기저장에서는 8°C의 광조건이 유리한 것으로 나타났다. 결론적으로 상업적인 저온저장 조건은 지상부 생존율 90% 이상, 황화율 10% 이내를 기준으로 단기(1–12주)는 4°C의 광조건에서, 장기(12주 이상)는 8°C의 광조건이 적합하다. 한편 저온 등 비생물적 환경요인의 불균형에 대한 반응으로 나타나는 기내 거베라 소식물체 유전적 특성 변화, 항산화 체계 활성 기작과 같은 내적 요인들(endogenous factor)의 변화에 대한 추가적인 연구가 필요할 것으로 판단된다.




