서 언
선형과 비선형회귀모델은 작물의 재배관리적 측면에서 시계열, 생육도일 또는 발육단계에 따른 무게, 볼륨, 길이, 엽면적 변화를 단순화 시킬 수 있는 유용한 도구로 활용될 수 있다. 선형모델식은 단위 독립변량에 따라 종속변수의 변화율을 추정할 수 있으며, 비선형회귀모델의 생장곡선은 독립변수의 변화에 따른 종속변수의 변화수준을 동적으로 묘사할 수 있다. 비선형회귀모델은 최대 변화율에 도달하는 일수 및 도함수를 이용하여 동적 변화율을 계산할 수 있으며, 지상부나 근권부 환경에 따라 각 모수들의 변화를 추정할 수 있다. 단순 경험적 모델은 누적 생장량의 변화(Lee et al., 2002; Puiatti et al., 2013; Kim et al., 2021; Park and Kim, 2021; Park and Lee, 2021), 상추 품종 간의 생장의 비교(Carini et al., 2019)와 절화국화의 건물생산과 엽면적지수(Lee et al., 2002), 딸기(Diel et al., 2018)와 토마토(Sari et al., 2019)의 생육관련 연구결과를 정리 및 묘사할 수 있는 도구로 사용하였다. Gompertz, Logistic, Richards 생장모델들은 다양한 생물학적 현상을 묘사하는데 광범위하게 사용되고 있다(Werker and Jaggard, 1997; Archontoulis and Miguez, 2015). 특히 통계소프트웨어를 이용하여 측정값들의 곡선 맞추기(curve fitting)를 통해 생물학적 해석 가능한 매개변수들을 추정 할 수 있기 때문에 처리 효과 분석에 강력한 도구로 사용되고 있다(Werker and Jaggard, 1997). 수학적 생장 모델은 매개변수와 함께 시간에 따라 연속적인 값의 변화를 나타낼 수 있기에 많은 연구자들이 이러한 회귀모델을 이용하여 식물체의 생장과 발육 반응을 해석하고 요약하였다(Cha et al., 2014; Kim et al., 2015; Kleijbeuker and Lee, 2019; Park and Lee, 2021).
절화국화는 단일처리에 의해 화성유도가 된 이후 화아분화를 통해 줄기의 신장율이 급격히 감소하는 전형적인 시그모이드형 생장을 나타낸다. 시그모이드 비선형 회귀 모델은 Gompertz, Logistic과 Richards 생장함수의 독립변수가 무한일 때 점근선의 최대값인 매개변수인 Ymax의 단위는 종속변수 Y 와 동일한 단위를 가지고 있고, 곡선의 변곡점에 도달하는 시간은 독립변수의 단위와 동일하며, 곡선의 변화정도를 나타내는 k는 독립변수 단위의 역수이다(Archontoulis and Miguez, 2015). 많은 측정값을 묘사하는 수학 함수식을 이용하는 경우 회귀식의 결정계수만을 이용하는 경우 많고 회귀식의 적합도를 수렴하고 있지만 기대값에 대한 오차분포의 검증도 확장되어져야 할 것으로 판단된다.
본 연구는 정식 시기와 장일처리 기간이 상이한 국화 초장의 생장데이터의 추세를 추정하기위해 Gompertz, Logistic, Richards 모델들 중 국화의 초장을 잘 묘사할 수 있는 모델을 선택하고자 한다. 본 연구에서는 각 생장함수의 절편의 사용 유무에 따른 모델의 적합성, 정규성, 등분산성, 표준화된 잔차의 분포를 평가하여 그 중 가장 적합한 생장모델을 찾고자 하였다. Gompertz, Logistic, Richards 생장모델이 실제값과 일치하는지를 평가하기 위해서는 결정계수, 잔차의 평균제곱합, 잔차 간의 자기 상관여부를 나타내는 Durbin-Watson 분석, 표준화된 잔차의 정규성, 등분산성의 값을 위해서는 잔차의 Kolmogorov- Smirnov와 Shapiro-Wilk 검정, Skewness와 Kurtosis의 유의성 유무 등으로 가지고 평가하고자 하였다.
재료 및 방법
재배관리 및 자료수집
전남대학교 농업생명과학대학 내 단동 플라스틱 온실(7 × 12.5m)의 스티로폼 성형베드(60 × 900cm) 6베드를 설치하고 펄라이트 배지(경동원, 펄라이트 3호)를 충진하여 포습시킨 후 절화 국화 ‘백마’의 삽수를 재식밀도 64.6주/m2 삽목하여 두상살수하거나 비닐을 덮어 습도를 유지하여 발근시켰다. 절화 국화 초장 생장에 대한 동적 변수를 2월부터 9월까지 정식 시기와 장일처리 기간을 달리하여 총 5회 실험에서 정식 후 일수에 따른 국화 초장을 조사하였다(Table 1). 각 베드는 점적테이프(드리퍼 간격 10cm, 0.72리터/드리퍼/시간)으로 4줄을 설치하여 발근 이후 양액 EC 2.0dS/m과 pH는 6.0으로 공급하였다. 국화의 일장 처리는 LED(주광색과 전구색, 10W, ELBA, China)를 이용하여 장일기간은 16시간, 단일처리는 암막커튼을 이용하여 일장을 12시간으로 하여 처리하였다. 자연 일장이 12시간 이하인 계절은 전조하여 일장의 길이를 12시간으로 조정하였다. 시설내부의 온도와 습도환경은 난방시스템(온수를 이용한 FCU 10,000kcal × 5기)과 환기시스템(측창과 배기팬)을 복합환경조절시스템(Magma, Green CS, Korea)에 연결하여 난방에 필요한 온수조절을 시설내부의 온도와 습도에 따라 설정값을 변경하였다.
Table 1.
Five different experiments to grow standard chrysanthemum ‘Baekma’ were conducted from February to September in two years
난방온도는 15–17°C 범위에서 설정하였고, 일몰 2시간 30분전부터 3–4시간동안 난방온도는 15 °C, 이후 야간온도는 16°C, 일출 후 주간온도는 17 °C 설정하고, 상대습도가 95%이상이면 난방과 환기온도는 각각 1°C 씩 상승하도록 설정하였다. 난방시 FCU 난방수의 온도는 20–45 °C범위를 설정하고 온수온도를 측정하여 보일러의 온수와 회수된 온수를 3Way 밸브를 이용하여 온수온도가 급격히 올라가지 않도록 조절하였다. 기본 환기온도 설정은 18°C로 설정하고 외부 광량에 의한 영향값 적용범위는 최소범위 100–250J·cm-2에 최대범위 250–1,200J·cm2으로 계절에 따라 그 값을 변경하였고 광량에 의한 영향값은 10°C로 설정하고 1°C 상승시간은 상대습도가 낮은 조건(75%이하)에서는 30분, 습도가 높은 조건에서는(85%이상) 60분이 소요되도록 시간을 변경하였다. 외부의 온도환경에 따라 환기율을 조절할 수 있도록 계산된 환기온도보다 온실내부의 온도가 높을 때 외부 온도 조건에 따라 측창의 개도율을 달리 하기 위해 외부온도 15°C 이상에서는 풍하창 최소 P-band값 10, 풍상창의 최소 P-band값이 15로 설정하였고, 외부 온도가 10°C이하에서는 풍하창 최대 P-band값 20, 풍상창 최대 P-band값 30으로 설정하여, 외부 온도가 10°C에서 15°C사이 온도에서는 풍상창과 풍하창의 최소와 최대 P-band값이 비례적으로 적용되게 환기창의 개도율 조절하였다. CO2공급은 대기중의 농도(350ppm)이하가 되지 않도록 액화탄산가스를 이용하여 온실에 공급하였다. 실험구 배치는 난괴법으로 3반복하여 반복당 630주의 ‘백마’를 정식하였고, 정식 후 생육조사는 초기 15일 간격, 이 후 7일 간격으로 3반복으로 반복당 6주의 샘플을 샘플을 설상화의 바깥 꽆잎이 수평으로 펼쳐진 상태를 기준으로 실험을 종료하여 식물체의 개별 초장을 측정하였다.
통계분석
기간별로 측정한 초장을 비선형회귀모델 Gompertz 식 (1), Logistic 식 (4), Richards 식 (7) 생장모델을 이용하여 각 생장함수의 파라미터를 추정하였다(Archontoulis and Miguez, 2015). 각 생장모델의 1차 도함수는 각각 식 (2), (5), (8)와 2차 도함수는 식 (3), (6), (9)이다. 1차 도함수는 각 함수의 절대생장율을 계산할 수 있으며, 2차 도함수가 0일 때 최대 생장율을 계산할 수 있다.
Gompertz 생장모델식
Logistic 생장모델식
Richards 생장 모델식
x는 정식후 일수(d), k는 곡선의 변화율, tb는 최대 생장율에 도달하는 정식 후 일수 이다. 이때 x = tb일 때 이다.
Gompertz, Logistic, Richards 생장함수는 x → ∞일 때 값이 y = ymax 의 근사치에 도달하게 된다. 각 함수의 1차 도함수는 초장의 절대생장율을 나타내며 2차 도함수의 값이 0에 도달한 때의 x 값이 최대 생장율에 도달한 한다. x = tb일 때 세 생장함수의 2차 도함수 값이 0이므로 tb는 최대 생장율에 도달한 정식 후 일수가 된다. 최대 생장율은 1차 도함수에 지수함수의 이다. v는 asymmetric 생장매개변수이며, v = 1일 때 Richards 생장모델은 Logistic 생장모델과 동일하게 된다.
세개 비선형회귀 모델의 파라미터들의 추정은 SPSS(SPSS Statistics, IBM, USA)의 분석도구 중 비선형회귀분석 방법을 선택하고 독립변수를 정식 후 일수(x)로 종속변수를 초장(y) 으로 하여 SPSS의 비선형회귀분석의 옵션의 붓스트랩 추정값의 순차 2차 계획법을 사용하여 회귀모델의 분산분석과 각 생육모델의 파라미터를 추정하였다. 모델의 정확도는 회귀분석의 분산분석 표의 전체 자승합(TSS)과 오차의 평균자승합(MSE), 파라미터의 개수와 조정된 결정계수(adj. R2)를 계산하였다. 모델의 적합도를 판단하기 위해 관찰값과 기대값의 편차를 표준화하여 기대값에 대한 산포 정도를 아래 식으로 계산하여 도식화 하였다.
관찰값인 초장에 대한 Gompertz, Logistic, Richards 생장모델의 정규성, 독립성, 선형성, 등분산성을 분석을 위해 예측치에 대한 표준화된 잔차들의 산포를 분석하였다. Kim(2013)은 표본수가 50이하의 경우 왜도나 첨도의 값을 각각의 표준오차로 나눠 값의 절대치가 1.96보다 크면 샘플의 정규분포를 따른다고 보기 어려우며, 50 < n < 300이 경우 3.29 보다 크면 정규분포를 따르지 않는다고 하였다. 표본의 수가 300 이상이면 왜도(Skewness)의 절대값이 2 보다 크거나 첨도(Kurtosis)의 절대값이 7보다 크면 정규분포를 따르지 않는다고 하였다. 정규성 검정에 사용되는 Kolmogorov-Smirnov과 Shapiro-Wilk 분석은 유의확률이 5%이상에서는 정규성이 인정되고, 그 미만은 정규성이 인정되지 않는 것으로 판단하였다(Ghasemi and Zahedias, 2012).
결과 및 고찰
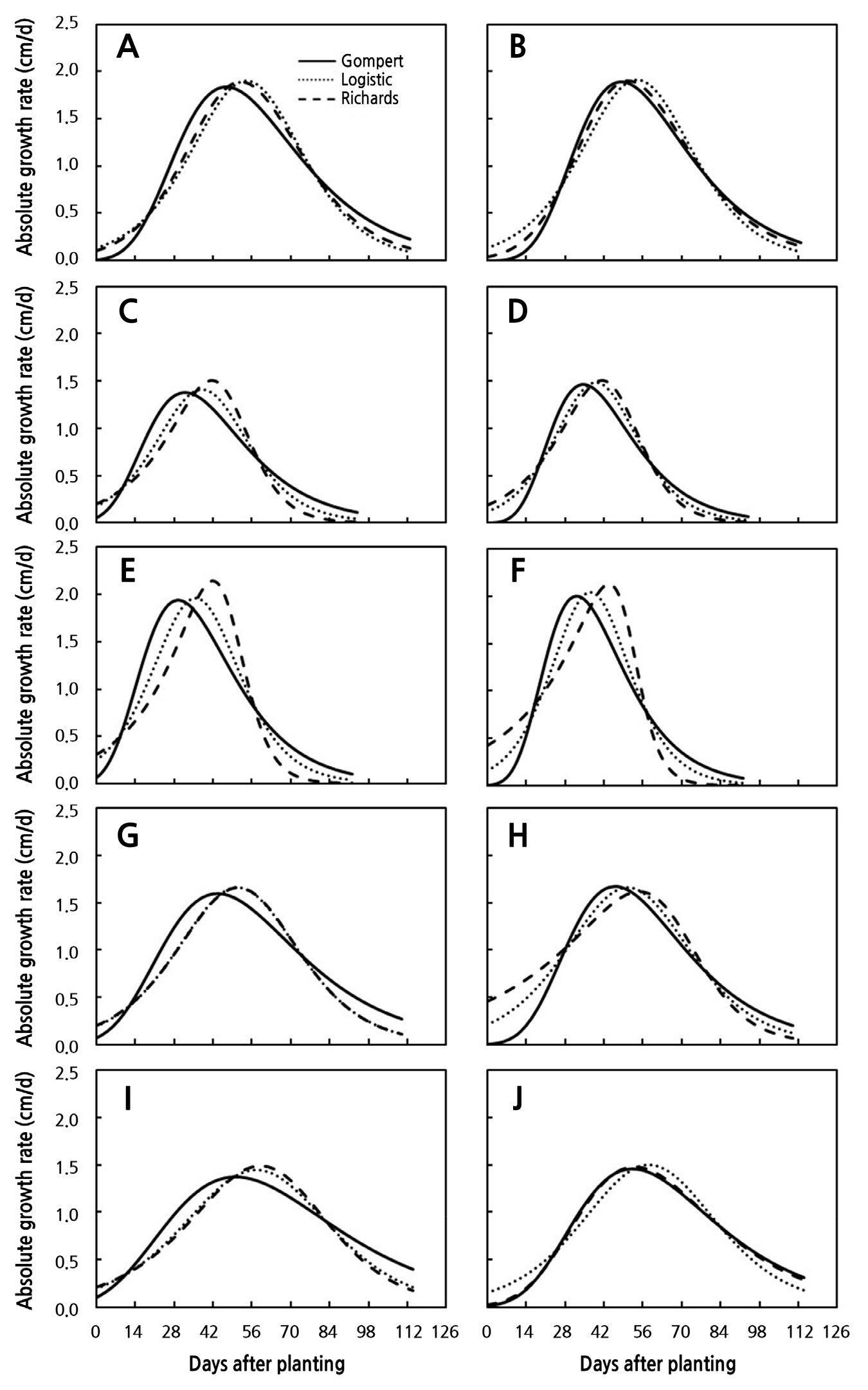
정식 시기를 달리한 5개의 실험의 스탠다드 절화 국화 초장을 정식 후 일수에 따라 산점도를 Fig. 1A, 1C, 1E, 1G, and 1I에 나타냈다. 모든 실험에서 정식 후 일수에 따른 초장의 변화 경향은 생육초기의 낮은 생장율을 나타냈으며 점차적으로 증가하고 급격한 생장 이후 생장율이 감소하는 S자 생장곡선 패턴을 나타냈다. 대표적인 S자 생장 곡선을 잘 묘사할 수 있는 Gompertz와 Logistic 생장함수를 이용하여 생장함수 3개의 파라미터를 추정하였고 Richards 생장함수를 이용하여 4개의 파라미터를 추정하였다(Archontoulis and Miguez, 2015; Korkmaz, 2021). 최대 생장량을 나타내는 ymax, 곡선의 변화율을 나타내는 k, 곡선의 기울기가 최대일 때 나타내는 시간 tb의 3개 파라미터를 가지는 Gompertz와 Logistic 생장함수와 점근 곡선 생장(v = 1이 이면 Richard 생장모델은 Logistic 모델이 됨) 조절 변수 v를 포함하고 있는 Richards 생장 함수를 포함한 세 개의 생장함수들이 추정된 값들은 측정값들을 96.9% 이상 유의적으로 묘사하였고 도함수를 이용한 절대생장율도 잘 묘사되었다(Table 2, Fig. 1A, 1C, 1E, 1G, and 1I). 각 실험에서 초장의 최대값인 ymax는 Gompertz 생장함수에서 가장 높았고, 그래프의 Steepeness를 결정하는 k값은 Richards 생장함수가 가장 높았으며, 반면 k값은 Gompertz 생장함수에서 가장 낮게 추정하였다(Table 2). 각 생장함수의 최대생장율에 도달하는 정식 후 일수는 Gompertz 생장함수가 평균 40.0일, Logistic 생장함수가 평균 47.3일과 Richards 생장함수가 평균 49.2일로 가장 지연되었다(Table 2, Fig. 1B, 1D, 1F, 1H, and 1J). 전체 실험에서 각 함수의 평균 결정계수(R2)는 Gompertz 생장모델이 97.8%, Logistic 생장 모델은 98.2%, Richards 생장모델은 98.3%로 측정된 초장의 변화량을 매우 유의하게 잘 설명할수 있었지만, Archontoulis and Miguez(2015)는 비선형모델의 성능이 단순히 R2 값이 높다고해서 모델이 적합하다고 할 수 없다 하였다. Archontoulis and Miguez(2015)은 비선형모델의 성능을 비교할 때 측정값과 그래프 비교는 모델의 시각적인 적합도를 제공하며, 추가적으로 R2, 조정된 R2와 같은 수치 통계지표, bias, 평균 오차 자승합(MSE), 평균 제곱근의 오차(RMSE) 등 수치화된 통계지표를 제시하기도 한다. 또한 Archontoulis and Miguez(2015)는 모델의 충족여부를 확인하기 위해서는 추정값에 따른 표준화된 잔차의 분포를 확인하는 것이 첫 과정이라 하였다. 본 연구에서는 모델들의 적합도 평가는 Archontoulis and Miguez(2015) 연구에서 제시한 기대값에 대한 표준화된 잔차의 분포(Fig. 1B, 1D, 1F, 1H, and 1J) 와 표준화된 잔차의 정규성을 Skewness와 Kurtosis 분석과 Kolmogorov-Smirnov와 Shapiro-Wilk 검증 결과를 근거로 모델의 적합도를 평가하였다(Table 3). Fig. 1B, 1D, 1F, 1H, and 1J는 정식 후 일수 에 따른 잔차의 분포를 각 함수와 실험별로 나타냈다. 생육초기의 측정값과 추정값의 표준화된 잔차들은 편의를 나타냈다. 잔차의 분포가 정규분포를 가지고 있다고 판단 할 수 있는 근거는 Kolmogorov-Smirnov검정시 5% 유의수준에서의 유의성이 없거나, Skeweness이나 Kurtosis값이 –1에서 1사이에 있는 경우이다(Blanca et al., 2013; Kim, 2013; Mishra et al., 2019). Kolmogorov-Smirnov검정시 5% 유의수준에서 유의하지 않거나 Skeweness 이나 Kurtosis 값이 ±1이내에 있는 함수와 실험은 Gompertz 생장함수에서는 잔차의 정규성이 인정되지 않았으며, Logistic 생장함수는 Expt 3과 4와 Richards 생장함수는 Expt 2, 3과 4가 표준화된 잔차의 정규분포를 나타냈다(Table 3). 절화 대국의 정식 후 일수에 따른 생장함수들의 적합도는 실험에 따라 상이하게 나타냈다. Gompertz와 Logistic 생장함수의 3개 파라미터와 Richards 생장함수의 4개 파라미터를 이용하여 추정된 값과 측정된 값에 대한 표준화된 잔차의 분포의 정규성이 낮은 문제를 해결하기 위해 각 생장 함수에 매개변수 h0를 더하여 측정값을 추정하였다. 각 함수에 파라미터 h0를 더하여 분석한 결과 비선형 회귀모델의 결정계수는 97% 이상 측정값을 유의적으로 묘사하여 매개변수의 추가 전후 결정계수의 차이는 미비하였다(Fig. 2A, 2C, 2E, 2G, 2I, and Table 4). 반면 Gompertz 생장 모델의 Kolmogorov-Smirnov와 Shapiro-Wilk 모두 유의성이 인정되지 않았으며, Skewness와 Kurtosis는 ±1 범위내에 표준화된 잔차의 정규성이 인정되었다(Fig. 2B, 2D, 2F, 2H, 2J, and Table 5). Logistic과 Richards 생장모델은 Skewness와 Kurtosis는 ±1 범위내에 모든 실험이 범위내 있었으나, Kolmogorov-Smirnov의 Shapiro-Wilk 표준화된 잔차의 유의성은 Expt. 1과 5, Richard 생장모델은 Expt. 1, 3, 4에서 표준화된 잔차 분포의 유의성이 인정되어 잔차들의 정규성이 낮게 나타났다(Table 5). 한 개의 파라미터가 추가된 생장함수들의 표준화된 잔차의 Skewness와 Kurtosis의 절대값들은 Expt 1의 Logistic 생장함수를 제외하고 모두 1이내로 계산되었다(Table 5). 각 실험별로 기존 생장 함수에 파라미터를 한 개 더 추가하여 추정된 모수를 이용한 계산한 값의 표준화된 잔차 분포의 정규성은 Kolmogorov-Smirnov와 Shapiro-Wilk 유의확률 5%수준의 검정에서 표준화된 잔차분포가 유의한 정규분포를 나타냈다(Tables 4 and 5). 표준화된 잔차의 분포가 가장 높은 정규성을 가지는 생장함수는 파라미터가 추가된 Gompertz 생장함수로 평가되었다(Fig. 2 and Table 5).
Table 2.
The estimated growth parameters without intercepts based on the Gompertz, Logistic, and Richards growth functions were fitted with measured plant height of standard cut chrysanthemum ‘Baekma’ grown on different planting dates and with different long-day periods. ymax, maximum plant height (cm); k, relative growth rate (d-1); tb, days after planting at maximum growth rate (d); and v, determinator of curve shape of Richards growth function
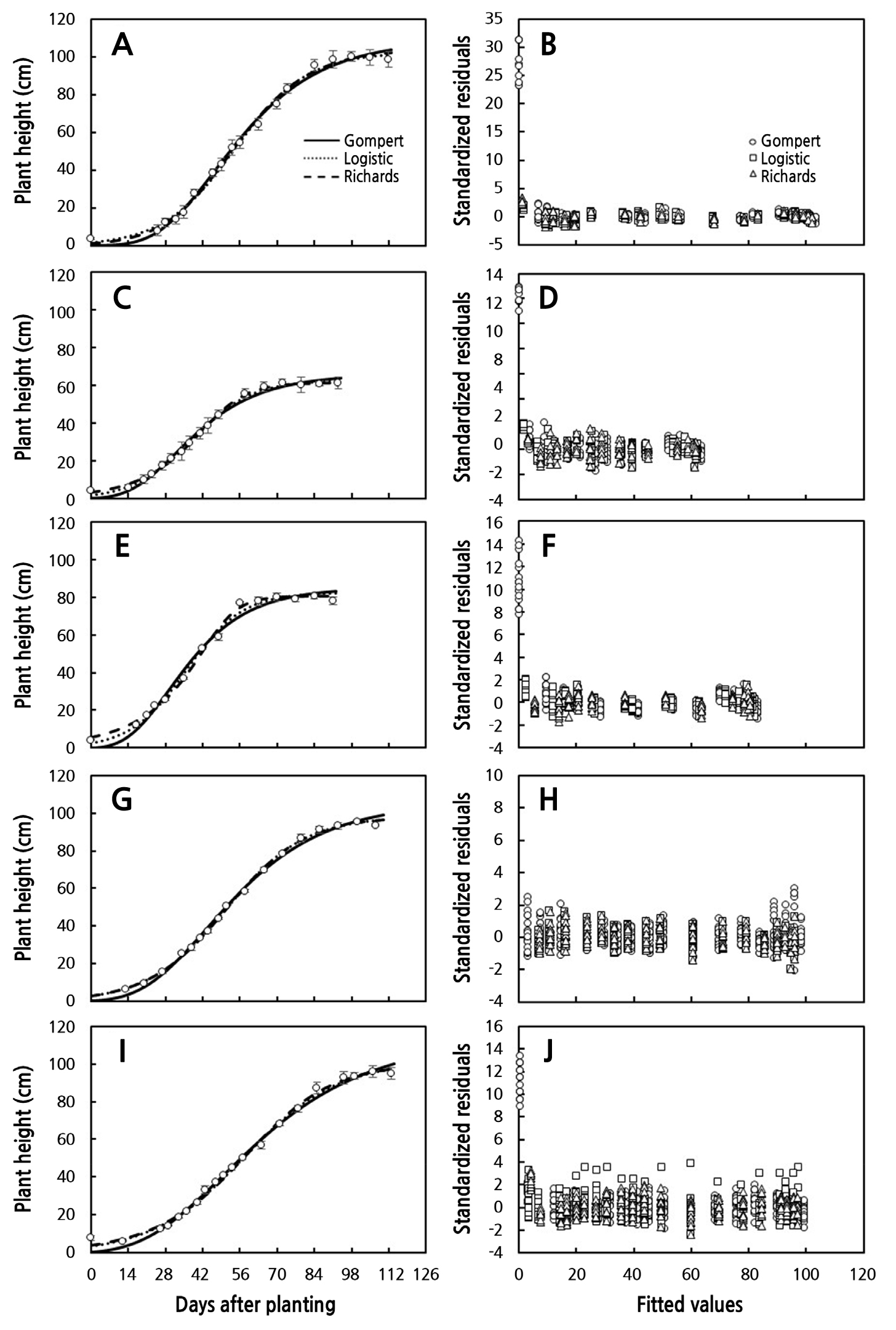
Fig. 1.
Dynamics of plant height of standard cut chrysanthemum grown under hydroponic cultivation at different planting dates and with different long-day periods. The lines are fitted values by Gompertz (solid lines), Logistic (dot lines), and Richards growth functions (dash lines) without an intercept (A, C, E, G, I) and distribution of standardized residual in time (B, D, F, H, J). Vertical bars indicate the standard error of means from three replicates, where each replicate consisted of 6 samples.
Table 3.
Normality test for standardized residuals between measured and predicted values using Gompertz, Logistic, and Richards growth functions for estimated parameters without an intercept
| Experiment | Function | Skewness | Kurtosis | Kolmogorov-Smirnov | Shapiro-Wilk |
| Expt. 1 | Gompertz | 3.95 ± 0.181 | 14.19 ± 0.36 | 0.000z | 0.000z |
| Expt. 2 | Gompertz | 3.53 ± 0.186 | 11.34 ± 0.37 | 0.000 | 0.000 |
| Expt. 3 | Gompertz | 3.21 ± 0.154 | 9.60 ± 0.307 | 0.000 | 0.000 |
| Expt. 4 | Gompertz | 0.94 ± 0.141 | 1.84 ± 0.281 | 0.000 | 0.000 |
| Expt. 5 | Gompertz | 3.61 ± 0.129 | 13.03 ± 0.256 | 0.000 | 0.000 |
| Expt. 1 | Logistic | –0.11 ± 0.181 | 0.87 ± 0.36 | 0.057 | 0.017 |
| Expt. 2 | Logistic | 0.731 ± 0.186 | 1.31 ± 0.37 | 0.001 | 0.000 |
| Expt. 3 | Logistic | 0.34 ± 0.154 | 0.16 ± 0.307 | 0.200 | 0.096 |
| Expt. 4 | Logistic | 0.09 ± 0.141 | 0.37 ± 0.281 | 0.200 | 0.502 |
| Expt. 5 | Logistic | 1.19 ± 0.129 | 2.51 ± 0.256 | 0.000 | 0.000 |
| Expt. 1 | Richards | 1.36 ± 0.181 | 3.66 ± 0.36 | 0.000 | 0.000 |
| Expt. 2 | Richards | –0.07 ± 0.186 | 0.366 ± 0.37 | 0.200 | 0.241 |
| Expt. 3 | Richards | –0.32 ± 0.154 | 0.52 ± 0.307 | 0.200 | 0.040 |
| Expt. 4 | Richards | 0.08 ± 0.141 | 0.33 ± 0.281 | 0.200 | 0.608 |
| Expt. 5 | Richards | 0.83 ± 0.129 | 1.30 ± 0.256 | 0.000 | 0.000 |
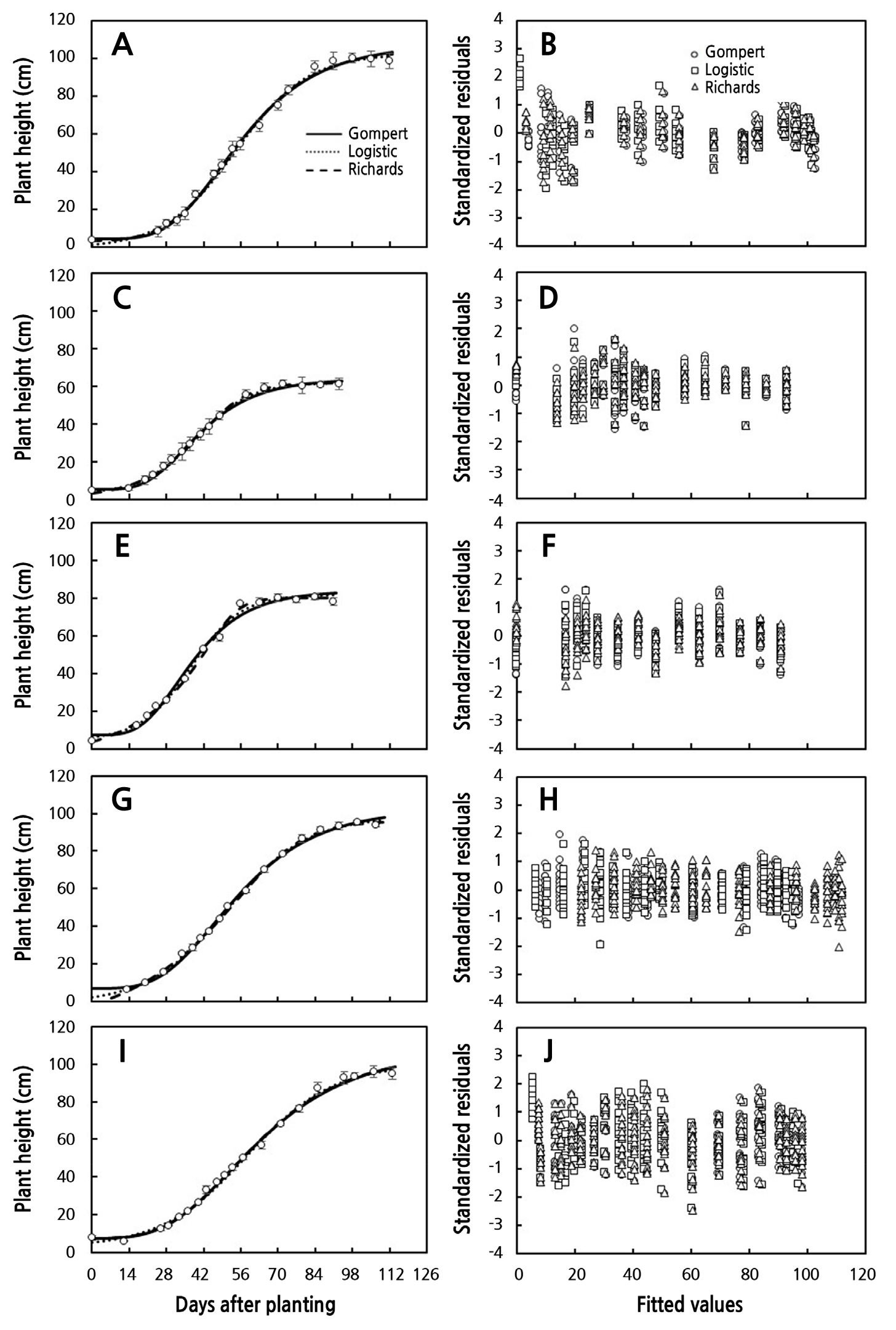
Fig. 2.
Dynamics of plant height of standard cut chrysanthemum grown under hydroponic cultivation at different planting dates and with different long-day periods. The lines are fitted values by Gompertz (solid lines), Logistic (dot lines), and Richards growth functions (dash lines) with an intercept (A, C, E, G, I) and distribution of standardized residual in time (B, D, F, H, J). Vertical bars indicate the standard error of means from three replicates, where each replicate consisted of six samples.
Table 4.
Estimated growth parameters with an intercept for Gompertz, Logistic, and Richards growth functions fitted with measured plant heights of standard cut chrysanthemum ‘Baekma’ grown at different planting dates and with different long-day periods. ymax, maximum plant height (cm); k, relative growth rate (d-1); tb, days after planting at maximum growth rate; v, determinator of curve shape of Richards growth function; and h0, the intercept of the function
전형적인 S 생장 함수인 Gompertz, Logistic과 Richards 함수들 이용하여 다양한 재배조건에서 측정된 동적 초장의 변화를 높은 결정계수과 표준화된 잔차의 정규성과 함께 유의적(p < 0.01)으로 설명할수 있었다(Figs. 1 and 2). 반면 모델의 적합성을 검정하기 위해서는 결정 계수 뿐만 아니라 실제관측치와 모델에 의한 예측치와의 거리인 잔차의 분포가 잔차의 산점도 0을 중심으로 수평한 상태로 랜덤으로 분포되어 있어야 한다(Fig. 2). 독립성 검토를 위해 표준화된 잔차가 산점도에서 특별한 경향이 나타나지 않아야 하고, 정규성 검토에서는 정규확률 그림에서 직선상에 있어야 하며, 등분산성의 검토에서는 표준화된 잔차들을 이용한 변수들을 산점도 나타냈을 때, 대략 0을 중심으로 대칭으로 나타나야 하며 모두 +2, –2범위내에 존재하여 등분산성의 가정이 만족되어야 한다(Table 5). 생장함수의 파라미터가 3개인 Gompertz와 Logistic, 4개인 Richards 생장함수가 예측한 값에 대한 표준화 잔차의 Expt. 4를 제외하고 초기값의 편의를 나타냈으며, 생육초기의 절대생장율을 과잉추정 하였다(Figs. 1B, 1D, 1F, 1H, 1J, 3A, 3C, 3E, 3G, and 3I). Birch(1999)는 Richards 모델에서의 생장 초기의 추정이 낮게 또는 높게 추정되어 최대 상대생장율의 추정이 가장 안좋았다고 보고하였다. Korkmaz(2021)의 Gompertz와 Logistic 생장 모델의 파라미터의 개수에 대한 연구에서 3개 파라미터의 적합도는 4개 파라미터 보다 낮았다고 하였으며, 연구자들이 모델을 이용하여 자료 분석 시 잔차의 자승합과 Akaike information criterion(AIC)를 이용하여 적합한 모델을 선택하는 것이 중요하다고 하였다(Akaike, 1998; Aho et al, 2014). 본 연구결과 국화의 다이내믹 생장을 묘사하고 분석하는데 각 생장함수에 파라미터를 추가하였을 때 표준화 잔차들의 정규성, 독립성, 등분산성이 높게 나타나 국화 초장 생장을 분석하기 위한 비선형 모델 중 Gompertz 생장모델이 Logistic과 Richards 생장 모델보다 더 적합한 것으로 판단되었다(Table 5, Figs. 2, 3B, 3D, 3F, 3H, and 3J). 반면 합리적인 생장모델은 파라미터 간의 낮은 상관과 독립성이 있을 때 더 좋은 모델이라 할 수 있기 때문에 모델의 개선을 위해 조정된 모델의 개발도 필요할 것으로 판단된다.
Table 5.
Normality test for standardized residuals between measured and predicted values by Gompertz, Logistic, and Richards growth functions for their estimated parameters with an intercept
| Experiment | Function | Skewness | Kurtosis | Kolmogorov-Smirnov | Shapiro-Wilk |
| Expt. 1 | Gompertz | –0.038 ± 0.181 | 0.643 ± 0.36 | 0.200z | 0.105z |
| Expt. 2 | Gompertz | 0.046 ± 0.186 | 0.884 ± 0.37 | 0.200 | 0.346 |
| Expt. 3 | Gompertz | 0.122 ± 0.154 | –0.483 ± 0.307 | 0.200 | 0.068 |
| Expt. 4 | Gompertz | 0.240 ± 0.141 | 0.473 ± 0.281 | 0.200 | 0.224 |
| Expt. 5 | Gompertz | –0.016 ± 0.129 | –0.304 ± 0.256 | 0.037 | 0.330 |
| Expt. 1 | Logistic | 0.657 ± 0.181 | 2.000 ± 0.36 | 0.001 | 0.000 |
| Expt. 2 | Logistic | –0.106 ± 0.186 | 0.846 ± 0.37 | 0.097 | 0.058 |
| Expt. 3 | Logistic | 0.025 ± 0.154 | –0.162 ± 0.307 | 0.200 | 0.932 |
| Expt. 4 | Logistic | 0.079 ± 0.141 | 0.376 ± 0.281 | 0.200 | 0.535 |
| Expt. 5 | Logistic | 0.237 ± 0.129 | –0.169 ± 0.256 | 0.030 | 0.081 |
| Expt. 1 | Richards | –0.415 ± 0.181 | 0.539 ± 0.36 | 0.001 | 0.025 |
| Expt. 2 | Richards | –0.117 ± 0.186 | 0.482 ± 0.37 | 0.200 | 0.206 |
| Expt. 3 | Richards | –0.452 ± 0.154 | 0.831 ± 0.307 | 0.063 | 0.006 |
| Expt. 4 | Richards | –0.069 ± 0.141 | 0.223 ± 0.281 | 0.200 | 0.648 |
| Expt. 5 | Richards | –0.015 ± 0.129 | –0.295 ± 0.256 | 0.018 | 0.323 |