서 언
재료 및 방법
식물 재료 및 배주 배양
DNA 추출, 증폭 및 분석
종간 교잡체 특성 조사 방법
결 과
교배와 배주배양
종간 교잡체의 특성
혼종성 확인 및 분석
고 찰
배주 배양
종간 교잡 특성
종간 교잡 혼종성
서 언
종속간 교배는 화훼식물에서 상업적으로 인기있는 형질의 품종 개발을 위한 유전적 다양성을 넓힐 수 있고 다양한 형질을 섞을 수 있는 중요한 방법이다(Langton, 1987). 하지만 여러가지 요인에 의해 종간교배 후 종자 형성은 매우 어렵다. 교잡 불화합성의 주요 원인은 수정 전 장벽(Pre-fertilization barrier)과 수정 후 장벽(Post- fertilization barrier)이 있다(van Tuyl et al., 1990; Kim et al., 2001). 수정 전 장벽은 수분 후 꽃가루가 주두에서 발아되지 못하거나 발아관이 발아되어 주두를 통해 내려가는 도중 정지하는 것이고, 수정 후 장벽은 수분 후 꽃가루가 주두에서 발아되어 자방까지 발아관이 내려가 수정은 이루어졌으나 이후 수정란이 어느 단계에서 퇴화하거나 발달을 정지하여 정상 종자가 되지 못하는 것이다. 수정 전 장벽은 수정이 이루어 지지 못하기 때문에 자방의 비대가 없어 자방의 비대가 확인되면 수정 전 장벽으로 볼 수 없다고 보고된 바 있다(Cai et al., 2015). 과거부터 최근까지 배주 배양을 통한 수정 후 장벽 극복으로 종간 교잡체를 획득한 사례가 있다(Buitendijk et al., 1995; Laojunta et al., 2019). 수국은 종간 교배 후 자방의 비대가 확인되어 수정 후 장벽이 존재한다고 알려져 있다. 이것을 극복하는 방법으로 배주 배양을 이용하여 종간 교잡체를 획득한 사례가 보고되었다(Reed, 2000; Jones and Reed, 2006; Reed et al., 2008; Kudo et al., 2008; Cai et al., 2015).
수국은 전세계적으로 직립성 또는 넝쿨성의 23개 종이 분포하고 있다고 알려져 있다(McClintock, 1957). 대표적으로 재배되는 종으로는 수국(Hydrangea macrophylla), 산수국(H. serrata), 미국수국(H. arborescens), 나무 수국(H. paniculata), 떡갈잎 수국(H. quercifolia), 등수국(H. anomala), 아스페라 수국(H. aspera)이 있다. 수국 종에 속하는 H. arborescens은 직립 또는 반직립으로 2–3m 정도 자라며 원산지는 북아메리카이다(Cai et al., 2015). 꽃은 연한 줄기의 원형 산방화서를 갖고 흰색 또는 분홍색 꽃을 5월 말부터 피운다. 잎은 줄기와 마찬가지로 매우 얇고 연하며 모양은 심장형 또는 원형에 가깝고 잎에 털이 있기도 하다. 수국 종들 중에 저온 저항성이 있는 편으로 USDA Zone 4(–34.4°C~–28.9°C)에 속한다(Reed et al., 2001). 다수의 신초를 발생하고 꽃눈은 당 해에 올라온 신초에서 형성되기 때문에 봄철 전정이 가능하고 이른 봄 서리에 꽃눈이 죽어 꽃을 피우지 못하는 일이 발생하지 않으며, 이른 여름 개화 후 전정을 해주면 9월까지 꽃을 피워 관상 기간이 길다. 유전적으로 많은 것이 밝혀 지지는 않았지만, 유전체 크기는 H. macrophylla, H. serrata, H. paniculata, H. involucrate 그리고 H. aspera와 비교하여 작은 편에 속하고(2.64pg/2C), 염색체 개수는 2n = 38로 알려져 있다(Cerbah et al., 2001). H. quercifolia은 다년생 관목형 식물로 3m 이상으로 자랄 수 있다. 옆으로 퍼지는 포복지의 마디에서 발근되어 옆으로 번져 나가는 특징이 있다(Dirr, 1990). 식물체는 직립하며 줄기 수가 적고 전체적인 수형은 둥근 형태로 자란다(Reed and Alexander, 2015). 원산지는 미국으로 꽃은 약 30 cm 이상으로 매우 큰 원뿔형의 흰색 꽃을 피우고, 줄기의 껍질은 탈각이 일어나며 잎은 붉은 자주색으로 단풍이 들어 매력적이다(Ledbetter and Preece, 2004). 잎은 매우 크고 거칠며 모양은 떡갈잎 모양으로 단풍잎과 같이 열편이 있다. 꽃 눈은 이전 해에 형성되어 다음해에 개화하고 저온저항성은 일반 수국과 비교해 강한 USDA Zone 5(–28.9°C ~ –23.3°C)에 속한다(Reed et al., 2001). 또한, 보통 질병에 감염되는 경우가 드물어(Mmbaga and Oliver, 2007), 정원 식재용으로 적합하다. 유전체 크기는 조사된 수국 종들 중 가장 작고(2.17pg/2C) 염색체 개수는 2n = 36로 보고되어 있다(Cerbah et al., 2001).
최근 H. arborescens와 H. quercifolia의 품종 개량에 관심이 증가함에 따라 두 종에 대한 육종이 증가하는 추세이다(Rinehart et al., 2006). H. quercifolia의 품종 개발은 주로 자연 방임 수분에 의해 형성된 종자에서 선발되어진 것으로 알려져 있다(Mallet et al., 1994; Lawson-Hall and Rother, 1995). 게다가 H. quercifolia는 원산지의 분포 범위가 매우 좁고 유전적 다양성에 대해 알려진 바도 매우 드물어(Sherwood, 2021), 다양한 교배가 시도되지 못해 유전적으로 다양하지 못하다. 이를 극복하여 유전적 다양성을 증가시키고 매력적인 형질의 품종을 만들기 위해 종간 교배를 통한 다양한 교배가 시도되어야 하지만 종간 교잡은 모부본의 유전체 크기와 염색체 수의 차이로 인해 매우 어렵다(Rinehart et al., 2006). 수국에서 종간 교잡은 1997년에 H. macrophylla의 저온저항성과 화색의 혼합을 위해 최초로 시도되었다(Reed et al., 2001). 미국과 일본에서는 H. macrophylla의 개량을 위해 다수의 종간 교잡 프로젝트가 진행되기도 했지만 성공적이지 못했다(Kudo et al., 2008). 그럼에도 종간 교잡종 개발을 위한 많은 시도가 있었고 식물체도 획득하였다. 이전에 보고된 종간 교잡은 H. macrophylla × H. paniculata, H. macrophylla × H. angustipetala, H. macrophylla × Dichroa febrifuga, H. macrophylla × H. arborescens, H. sandens ssp. chinensis × H. macrophylla, H., arborescens × H. involucrate, H. peruviana × H. serratifolia으로(Reed et al., 2001; van Gelderen and van Gelderen 2004; Jones and Reed, 2006; Reed et al., 2008; Kudo et al., 2008; Kardos et al., 2009; Cai et al., 2015), 몇 종들을 이용한 종간 교잡이 시도되었으나 획득된 종간 교잡종 대부분 수세가 약하거나 특별한 외형을 갖지 못하여 상업적 및 유전적으로 이용성이 있는 종간 교잡이 드물다. 그 중 Kudo et al.(2008)는 늘 푸른 잎과 겨울 개화성을 혼합하고자 종간 교잡을 시도했고 최종적으로 한 개의 우수한 형질을 선발하여 상업성이 있는 교잡종으로 보고하였다. 이외의 보고된 대부분의 종간 잡종은 죽거나 세력이 너무 약하여 생육을 하더라도 상업적으로 이용 가치가 없었다(Kardos et al., 2009).
본 연구는 종간 교배를 통한 유전적 다양성 확대와 종간 교배의 교량 역할을 할 수 있는 식물체 개발을 위해 최초로 H. arborescens와 H. quercifolia를 이용한 종간 교잡을 수행하였으며, 염색체 개수와 유전체 크기의 차이와 같은 유전적 차이로 인한 교배의 어려움을 배주 배양을 통해 극복하여 획득한 자손의 특징을 분석하고 혼종성을 확인하였다. 획득된 자손에서 새로운 형태의 화서와 잎이 출현하였고 그것을 교량 식물 및 육종 소재로 삼아 품종 개량에 이용하여 종간 교잡 자손 획득률 향상, 우수 품종 개량 및 유전적 다양성 증대에 이용될 것으로 기대된다.
재료 및 방법
식물 재료 및 배주 배양
2019년 6월 H. arborescens ‘Magical Pinkerbell’을 모본으로 H. quercifolia JNHQ01를 부본으로 삼아 총 150화를 교배하여 종간 교잡체 획득을 유도하였다. 교배 후 자방의 비대 정도를 확인하였고 생존 한 자방은 수분 후 7주 뒤 배주 배양을 시행하였다. 수집된 자방은 70% 에탄올에 30초, 차아염소산나트륨에 15분 침지시킨 후 멸균수로 3회 수세하여 소독하였다. 소독된 자방은 실체현미경 하에서 메스와 핀셋을 이용해 절단하여 종자를 적출 후 배지에 치상하였다. 배주 배양 배지는 sucrose 30g·L-1와 gelite 2.5g·L-1을 첨가하여 pH 5.8로 조정한 1/2 Gamborg B5배지를 사용하였으며, 치상 된 배주는 기온 23°C인 배양실에서 명기 20시간과 암기4시간의 조건하에서 배양하였다. 발아 후 2장 이상의 잎과 뿌리를 가진 유식물체는 44mm 지피포트(Jiffy 7, Jiffy®, Netherlands)에 옮겨 25°C 식물 재배실에서 명기16시간과 암기 8시간의 조건하에 1달간 순화하였다. 순화 이후에는 25°C 식물 재배실에서 명기 20시간과 암기 4시간의 조건하에 재배하여 충분한 생육 후 2020년 5월에 15cm 원형 플라스틱 화분에 옮겨 온실로 이동시켜 재배하였다. 비료 관리는 6개월을 주기로 멀티코트 6(14-14-14, Haifa, Israeli)를 각 화분에 약 6g씩 연 2회 처리하였다.
DNA 추출, 증폭 및 분석
종간 교잡체의 혼종성 및 유연관계 파악을 위해 모부본을 포함한 자손 식물 7개의 어린잎에서 gDNA를 추출하였다. 추출은 HiGeneTM Genomic DNA Prep Kit(GD263-060, Solgent, Korea)를 이용하여 매뉴얼에 따라 추출하였다. 추출된 gDNA는 1.6% agarose gel상에서 전기영동 후 UV 조명 하에 형광 밝기를 상대 비교하여 농도를 확인하였다. 증폭은 SSR marker primer 8개를 이용하였으며(Table 1), SologTM e-Taq DNA Polymerase(SET15-R500, Solgent, Korea)를 사용하여 10X e-Taq Reaction Buffer(25mM MgCl2 mixed), 10mM dNTP Mix, e-Taq DNA Polymerase(5U/ul), forward primer, reverse primer, distilled water를 혼합하고 DNA 2ul를 첨가하여 총 볼륨 10ul가 되도록 조성하여 시행하였다. 조제된 PCR mixture는 95°C에 3분동안 최초 denaturation 후, 95°C에 1분, 60°C에 1분으로 구성된 반응을 2번 반복, 그 후 95°C에 30초, 60°C에 30초, 68°C에 30초로 구성된 반응을 27번 반복한 후 최종적으로 68°C 4분 extension 후 4°C에서 보관하였다. 샘플은 1X TBE buffer를 이용하여 1.6% agarose 젤에 75 volt, 50분 전기영동 진행 후 밴드를 확인하였다. 결과 분석은 PAST(PAST ver 4.03, LO4D.com, Norway)를 이용하여 주성분 분석(PCoA)을 시행하였다.
Table 1.
List of SSR markers used to verified hybridity
종간 교잡체 특성 조사 방법
종간 교배를 통해 획득된 자손 9개체는 2년생이 되던 2021년 5–8월 개화기에 국립종자원의 수국 특성조사요령에 따라 전체적인 특성을 조사하였다. 부본은 삽목 후 2년생을 대상으로 특성조사를 실시하였다. 화서 유형은 특성조사서에 명시되어 있는 세가지 유형으로 분류하였으며, 잎은 최상단으로부터 아래로 세번째 마디 잎을 기준으로 조사하였고 특성조사요령을 통해 구별할 수 없는 잎 모양의 경우 사진을 기록하여 분류하였다. 이미지 편집은 Imagej software(ImageJ 1.52a, National Institutes of Health, USA)를 이용하였다. 임성 확인을 위한 화분의 활력 측정은 sucrose 10%, Boric acid 100mg·L-1, Agar 0.8%로 배지를 조성하여 슬라이드 글라스에 0.2mL 분주하고 화분을 붓에 묻혀 배지에 산포하였다. 분주 된 배지가 마르지 않도록 페트리디시에 증류수를 적신 와이퍼를 깔아준 뒤 슬라이드글라스를 올려 뚜껑을 닫고 상온(25°C)에 12시간 보관하였다. 한 품종당 100개씩 5반복하여 발아율은 백분율로 표시하였다.
결 과
교배와 배주배양
H. arborescens ‘Magical Pinkerbell’을 모본으로 H. quercifolia JNHQ01를 총 150화 종간 교배를 수행하였다(Table 2). 교배 된 꽃은 수분 후 7주 뒤 배배양을 위해 자방을 채취하였고 59개의 자방만이 생존했다. 59개의 자방을 이용하여 배주를 적출 한 결과 총 483개의 종자를 치상하였으며, 자방 당 약 8개의 배주를 형성하였다. 약 9주뒤 잎과 뿌리를 가진 식물로 발아된 배주는 총 32개였으며 발아된 식물은 지피포트에 옮겨 순화하였다. 순화한 식물체들은 32개중 최종적으로 10개체만이 생존하였으나, 온실 생육 중 한 개체가 고사하였다.
Table 2.
Results of controlled pollinations and ovary culturing of H. arborescens ‘Magical Pinkerbell’ × H. quercifolia JNHQ01
| Hybridization | No. pollinated flowers | No. capsules | No. cultured ovules |
Germination rate (%) |
Survival rate (%) |
| H. arborescens ‘Magical Pinkerbell’ x H. quercifolia JNHQ01 | 150 | 59 | 483 | 6.63 | 31.25 |
종간 교잡체의 특성
종간 교잡을 통해 획득한 총 9개의 새로운 특성을 지닌 식물을 대상으로 주요 특성을 조사한 결과 초장이 가장 작은 식물체는 HD18로 45cm였고, HD13이 가장 큰 초장으로 109cm였다(Table 3). 모본인 ‘Magical Pinkerbell’은 하부에서 신초가 다수 발생되는 특징이 있고, 부본인 JNHQ01은 상대적으로 신초 발생이 적은 특징이 있다. 부본은 줄기가 2개였고 하부에서 발생되는 신초는 확인할 수 없었으나, 교배를 통해 개발된 잡종들은 대체적으로 신초 발생이 활발하였다. 그 중 HD12, HD13, HD16, HD17은 다수의 줄기와 신초가 발생됨을 확인하였다(Table 3 and Fig. 1). 특성 중 눈에 띄는 특이점은 화서의 모양과 잎 모양이었다. 모본은 신초에서 꽃을 피울 수 있는 종이고, 부본은 이전 해에 형성된 꽃눈에서 꽃이 피는 특징을 가졌는데, 모든 자손이 2019년 1년생의 꽃을 확인할 수 없었다. 2년생이 된 2021년에는 자손 중 두개의 식물만이 꽃을 확인할 수 있었고, 나머지 식물에서 꽃이 확인되지 않아 생식 기관인 꽃이 없는 식물로 사료된다.
Table 3.
Morphological measurements of H. arborescens ‘Magical Pinkerbell’ × H. quercifolia JNHQ01 and their hybrids
|
Plant height (cm) |
Stem diameter (mm) |
No. basal stems |
No. new basal shoots |
Leaf shape (lobe/sinus degree)z | Leaf lobey |
Flower typex |
Flower diameter (mm) |
Flower height (cm) |
Pollen germination rate (%)W | |
|
Maternal parent | - | - | Multi- | Multi- | 1 | N | M | 20.3 | 16.8 | 59.3 ± 1.5 |
| Paternal parent | 75 | 8.74 | 1 | 0 | 9 | Y | C | 15.5 | 34.2 | 88.4 ± 1.9 |
| HD10 | 50 | 6.94 | 2 | 0 | 5 | Y | N | - | - | - |
| HD11 | 55 | 4.27 | 6 | 0 | 1 | N | N | - | - | - |
| HD12 | 77 | 6.55 | 11 | 6 | 3 | N | N | - | - | - |
| HD13 | 109 | 7.8 | 3 | 5 | 3 | Y | L | 15.78 | 5.71 | 0 |
| HD14 | 63 | 5.64 | 4 | 0 | 5 | Y | N | - | - | - |
| HD15 | 55 | 8.07 | 1 | 3 | 7 | Y | N | - | - | - |
| HD16 | 67.4 | 6.03 | 9 | 1 | 5 | Y | L | 8.93 | 5.54 | 0 |
| HD17 | 58 | 8.06 | 8 | 13 | 3 | Y | N | - | - | - |
| HD18 | 45 | 6.09 | 4 | 6 | 7 | Y | N | - | - | - |
zBased on scale of 1,3,5,7,9 where 1 = no, 3 = 25%, 5 = 50%, 7 = 75%, 9 = 100% of the leaves margin with lobes and sinus. Lobed leaves have distinct rounded or pointed projections. Some lobed leaves are also pinnate, others palmately radiating from a single point. Sinus is a space or indentation between two lobes or teeth.

Fig. 1.
Shoot and stem formation characteristics from plant bases of parent plants and representative interspecific hybrids. H. arborescens ‘Magical Pinkerbell’ as maternal plant (A), H. quercifolia JNHQ01 as paternal plant (B), plant base of HD12 (C), plant base of HD13 (D), and plant base of HD17 (E).
꽃이 확인된 두개의 식물은 HD13과 HD16이였으며, 육안으로 보기에 암술과 수술을 모두 갖고 있어 임성 확인을 위해 꽃가루를 수집하여 발아력을 검정한 결과 두 식물 모두 꽃가루 발아율이 0%로 부본으로서 사용할 수 없는 상태였다. 또, 모본의 화서 모양은 원형이고, 부본의 화서 모양은 원뿔형이으로 자손들은 부모본 화서 모양을 각각 따르거나 중간형을 기대하였으나, 꽃을 피운 자손 모두 모부본의 화서 모양이 전혀 아닌 2열 이상의 편평형 화서가 확인되었다(Fig. 2). 불임화의 모양은 부본과 유사했으며, 모부본 모두 홑꽃의 3–4매의 꽃받침을 가진 것과 동일하게 확인되었다. 모본의 불임화는 환경에 따라 분홍색이 되기도 하지만 부본은 변하지 않는 흰색 꽃받침을 갖는데 두 종간 교잡 식물 모두 흰색의 꽃받침이었다. 수술대의 모양이 구불구불한 것은 부본의 영향을 받은 것으로 확인된다.

Fig. 2.
Morphological characteristics in inflorescence and sepal of parents and hybrids. Upper part of the flower in the maternal plant at high temperature, H. arborescens ‘Magical Pinkerbell’ (A), sepal in the maternal plant (B), bloom in the paternal plant, H. quercifolia JNHQ01 (C), side part of the flower in the paternal plant (D), sepal in the paternal plant (E), upper part in the flower of the hybrid HD13 (F), side part of the flower in the hybrid HD13 (G), and sepal in the hybrid HD13 (H), arrow indicates the curly filaments in the hybrid HD13.
잎은 모본의 경우 둥근 달걀형이고 부본은 떡갈잎 형태인 반면, 자손들은 어느 한쪽을 따르는 것이 아닌 각 모부본의 특성들을 혼합해 놓은 듯한 잎이 확인되었다(Fig. 3). 특히 열편의 유전력에 따라 거치의 깊이가 나뉘는 것으로 보였고 이전에 수국에서 보기 어렵던 잎모양이 출현하였다. 그 중 HD12, HD17은 가장 모본의 잎과 비슷하게 생겼으나, 모본에 비해 잎몸 가장자리의 거치가 깊고 뾰족한 형태였다. 가장 부본의 잎과 유사하게 열편의 흔적이 있는 자손은 HD18이다. 전체 자손들은 열편과 거치의 정도가 모부본의 특성과 혼합되어 중간형태 또는 어느 형태로도 표기할 수 없는 형태가 확인되었으며, 자손들의 잎은 거치와 열편의 흔적이 보이는 잎은 잎이 뒤틀리거나 말리는 형태의 식물체를 획득하였다.

Fig. 3.
Leaf shape of hybrids developed through interspecies crossbreeding and the leaf shape of the parent plant. MP means maternal plant; PP means paternal plant. leaf of HD10 (A), leaf of HD11 (B), leaf of HD12 (C), leaf of HD13 (D), leaf of HD14 (E), leaf of HD15 (F), leaf of HD16 (G), leaf of HD17 (H), leaf of HD18 (I).
혼종성 확인 및 분석
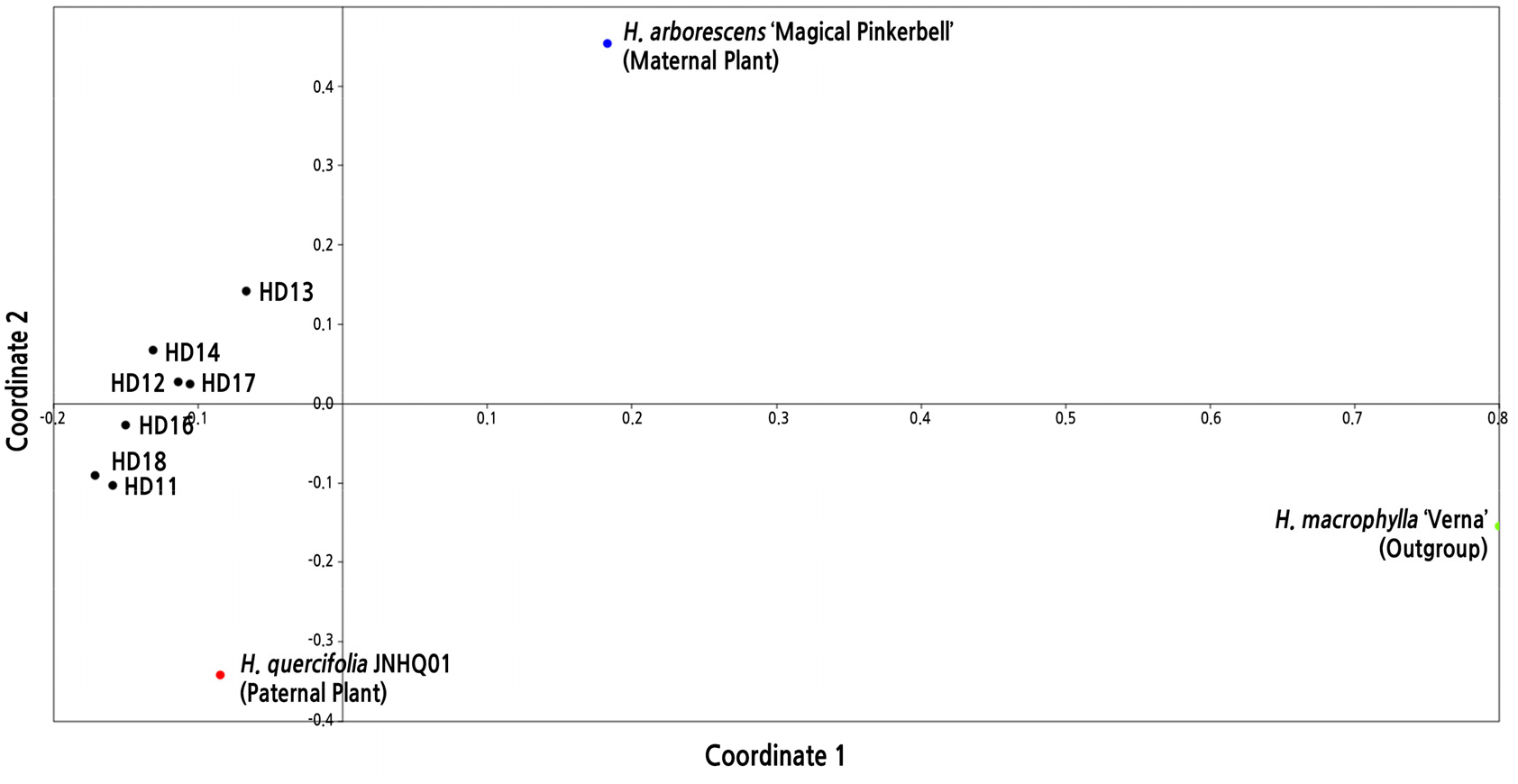
SSR 프라이머 STAB125-126은 모본인 H. arborescens ‘Magical pinkerbell’과 부본 H. quercifolia JNHQ01에 명확한 다형성을 보여준다(Fig. 4). 모부본 특이적 밴드 각각은 종간 교잡체에서 모두 확인되었다. STAB111-112 프라이머에서도 모부본 특이적 밴드가 각각 나타났으며, 자손들은 모부본의 특이적 밴드를 모두 갖고 있었다. STAB111-112 프라이머에서 모본 특이적 밴드가 750bp에서 확인되었고, 모든 종간 교잡체가 갖고 있었다. SSR 프라이머는 7개 식물에서의 혼종성을 보여줄 수 있었다. SSR 프라이머를 기반으로 주성분분석(PCoA)을 시행한 결과 모본과 부본 그리고 그들의 종간 잡종들은 완전히 분리되어 나타났다(Fig. 5). 유전적으로 모본과 근접한 위치의 자손은 없었으나, 부본과 근접한 위치의 자손으로는 HD11, HD18이 확인되었고 잡종들간 그룹으로 볼 수 있을 만큼 모여 있었다. 잡종들 중 HD12와 HD17 그리고 HD11과 HD18은 아주 근접한 위치에 놓여 서로 간의 유사성이 높은 것으로 확인되었다. 하지만 전체 자손 모두 모부본과는 그룹화 되기에는 다소 거리가 있어 모본, 부본, 잡종으로 따로 놓였다. 모부본과 공통성이 적었으며 대부분의 자손들은 모부본과 그룹화되기엔 상대적으로 멀었다.
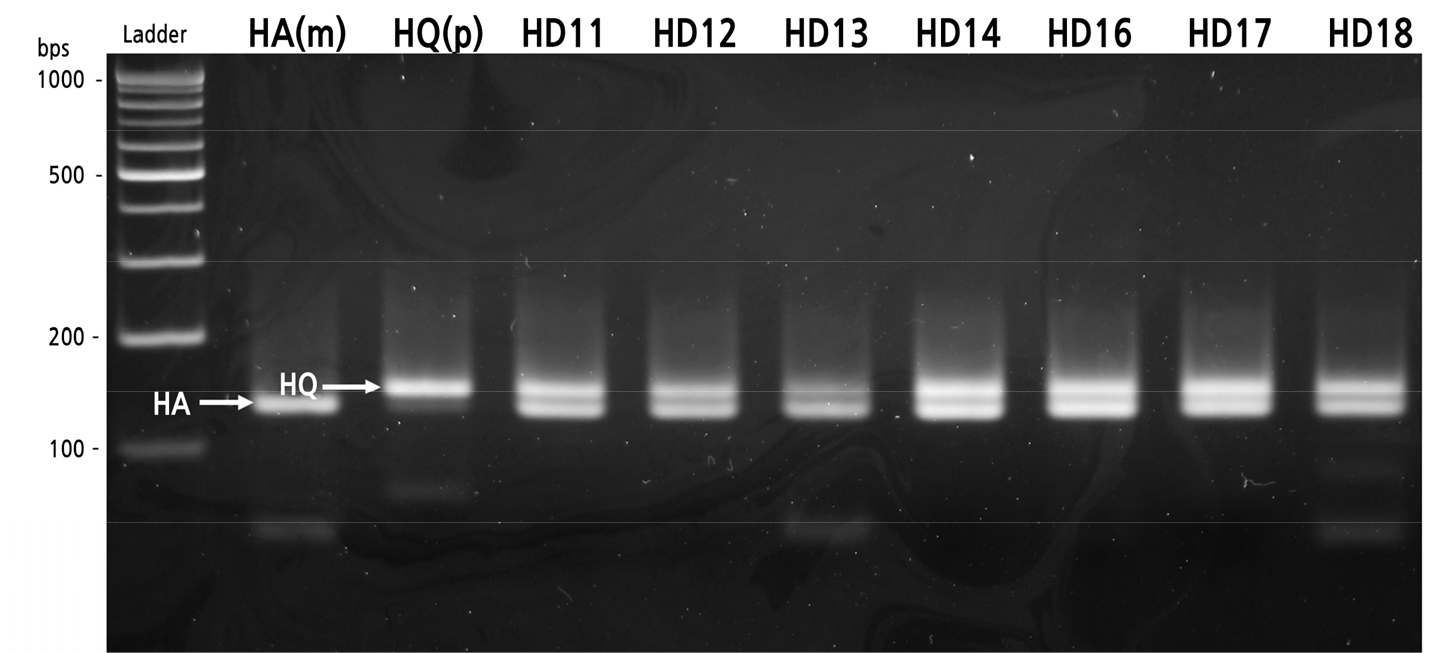
Fig. 4.
SSR marker profiles of H. arborescens as maternal plant (HA), H. quercifolia as paternal plant (HQ), and their hybrids (HD11, HD12, HD13, HD14, HD16, HD17, HD18) using the primer STAB125-126. Arrows (HA) and (HQ) indicate bands specific to H. arborescens and H. quercifolia, respectively. Ladder represents a molecular size marker (100-bp DNA ladder). bps, base pairs.
고 찰
배주 배양
수분 후 3주 뒤부터 교배 된 모든 꽃의 자방이 초록빛을 띄며 비대되는 자방을 부분적으로 관찰하였으나 4주부터 급격히 갈변이 오면서 고사하기 시작하였다. 자방의 비대는 3주째 눈에 띄기 시작했으나 4주차에 급격히 고사하는 것을 확인할 수 있었고 이는 수정 후 배의 형성으로 팽창이 시작된 자방이 배의 초기 발달 단계 또는 수정 직후 더 이상 발달하지 못하고 매우 이른 단계에 발달이 정지하여 자방 자체가 고사한 것으로 보인다. 이러한 결과로 종간 교배 자손 획득 어려움에 대한 가장 주요 원인은 수정 후 장벽으로 사료된다. 수정 후 장벽은 배주 배양을 통해 극복이 가능하나 배주 배양 시행 후 보통 배 발달이 확인되지 않는 종자이거나 배 발달이 미숙한 종자로 인해 발아에 어려움이 있는 것으로 생각된다. 또한, 유묘가 일찍 고사하거나 떡잎이 발생되는 과정 중에 첫번째 떡잎이 나온 후에 죽었는데 이는 이전 보고된 사례들과 동일한 결과로 보인다(Reed, 2000; Jones and Reed, 2006; Cai et al., 2015). 본 실험에서 총 483개의 배주를 배양하였고 32개가 발아되어 발아율이 6.63%로 매우 낮았다. 게다가 발아된 식물 중 10개의 식물만이 정상적인 식물체로 생육할 수 있었다(Table 2). 나머지 22개의 식물은 대부분이 어린 식물의 순화 과정에서 더 이상 자라지 못하거나 비정상적인 생육을 극복하지 못하고 토양에 활착이 더뎌 끝내 고사하였다. 결과적으로 수분 후 비대 된 자방을 이용해 배주 배양을 시행한 결과, 32개의 식물이 발아하고 그 중 10개의 식물이 온실 생육이 가능하였으나 한 개체가 생육 중 고사하여 최종적으로 9개의 종간 교잡 식물을 획득하였다. 이것은 배주 배양은 종간 교배(H. arborescens × H. quercifolia)수정 후 장벽 극복에 적합한 방법임을 보여주는 하나의 사례가 될 것으로 생각된다.
종간 교잡 특성
종간 교잡을 통해 나온 식물들은 형태적으로 모본과 매우 유사하고 대표적으로 잎의 모양과 화서의 모양이 모본과 유사하거나 같은 모양이 보고된 바 있다(Reed et al., 2001; Kudo et al., 2008; Cai et al., 2015). 하지만 본 실험에서 H. arborescens × H. quercifolia 교배를 통해 획득된 자손들은 외형적으로 식물 줄기 부분이나 두께 등이 부본의 영향을 많이 받은 듯한 모습을 보였다. 생장형은 부본으로 사용된 H. quercifolia는 직립형으로 자라며, 적은 가지를 갖는 특징이 있다(Reed and Alexander, 2015). 반대로 모본으로 사용된 H. arborescens ‘Magical Pinkerbell’은 많은 가지와 신초를 갖는 특징이 있다. 본 연구를 통해 개발된 잡종들은 대부분 가지가 부본보다는 많거나 또는 식물의 기부로부터의 신초 형성이 활발함을 확인하였다(Table 3 and Fig. 1). 이를 통해 부본의 단점인 가지가 적은 점을 보완하는 식물체를 개발하는데 H. arborescens와의 종간 교배는 H. quercifolia에 필요한 좋은 형질을 도입하는 훌륭한 조합으로 생각된다. 화서의 모양은 모본으로 사용된 H. arborescens ’Magical Pinkerbell’은 원형 화서이고, 부본으로 사용된 H. quercifolia JNHQ01는 원뿔형이나 꽃이 있는 자손은 모두 편평형 화서로 새로운 형태가 출현하였다(Fig. 2). 또 잎은 모부본 중 어느것과도 같지 않았으며 새로운 형태를 보였다(Fig. 3). Kudo et al.(2008) 의 종간 교배에서 불임화의 모양이 모부본 모두 홑꽃이었으나, 획득 자손에서 겹꽃의 형질이 출현 된 적이 있었지만 화서의 모양이나 잎의 모양에 대한 새로운 형질 출현은 없었다. 새로운 형질 출현의 이유는 정확하게 설명할 수는 없지만 모부본의 교배를 통한 유전자 상호작용, 자손 식물의 유전자 재배치 또는 꽃 발달 과정 중에 후성유적학적 재프로그래밍이 의심된다(McClintock, 1957; Comai et al., 2000; Grant-Downton and Dickinson, 2006; Kudo et al., 2008). 이처럼 종간 교배를 통해 예상하지 못한 새로운 형질이 출현하기도 하면서 유전적 다양성을 높이게 되고 본 실험을 통한 종간 교잡체 개발이 앞으로 종간 교배 성공 확률을 올려 줄 수 있는 새로운 교량 식물로서 사용될 것을 기대하며, 두 개의 교잡 식물의 종자를 수확해 추후 모본의 능력을 평가할 예정으로 교배에 다리 역할을 하는 새로운 교배 자원으로의 역할을 기대한다.
종간 교잡 혼종성
형태적으로 모본과 유사한 자손을 얻은 경우 검정 결과 부분적으로 모본의 자가수분 결과이거나 혹은 타가 수분이 아닌 경우가 있다(Jones and Reed, 2006; Kardos et al., 2009). 또, 종간 교잡 시 발생되는 장벽을 배 배양을 이용하여 극복한 식물체는 종종 캘러스로부터 유래되어 모체인 경우가 있는데 본 실험에서 개발한 자손 9개 모두 모본의 형태보다는 대부분 부본의 형태를 갖고 있었고 배주 배양을 통한 종자의 발아로 직접적인 식물 발생이 이루어져 타가수분에 의한 종간교배로 식물체가 획득되었음을 뒷받침한다. 게다가 8개의 SSR 프라이머를 통해 모부본 특이적 밴드를 각각 확인하여 혼종성 및 유전적 유연관계를 파악하였다(Fig. 4). 이전에 보고되어진 종간 교잡을 통한 식물체들은 모본과의 유사도가 상당히 높았고, 주성분분석을 실시한 결과 대부분 그룹화 될 수 있는 거리에 위치해 있거나(Kardos et al., 2009), 모본의 근처에 그룹화 되었다(Cai et al., 2015). 또는 모본과 부본의 중간 부분에 그룹화되어 있었으나 다소 모본에 가깝게 그룹화되어 있다(Kardos et al., 2009). 본 연구의 결과로 얻은 자손들은 모부본 어느 한쪽에 집단으로 있기보다는 모본과는 상대적으로 거리가 있고 부본과는 상대적 거리가 가까운 곳에 집단으로 분포되어 있었다(Fig. 5). 자손들은 대부분 화기 구조가 확인되지 않았지만 그 중 HD13과 HD16은 화기 구조가 확인되는 식물체였고 모본과 부본의 화분 발아율이 각각 59.3%와 88.4%인데 반해 자손들의 화분 발아율은 각각 0%였다(Table 3). 염색체가 홀수일 경우 꽃이 피는 잡종에 불임이 초래되는 경우가 있다(Cai et al., 2015). 본 연구를 통해 개발된 종간 교잡 식물은 꽃이 확인되는 식물은 웅성 불임으로 확인되고 나머지 교잡 식물은 꽃이 확인되지않았는데 이는 서로 다른 염색체 개수의 모부본을 이용한 종간 교잡을 통한 염색체의 재구성으로 염색체가 홀 수개 일 것으로 추측된다. 본 연구를 통한 전체 자손들은 모부본과 거리가 있는 곳에 위치해 있었고 자손들간 그룹화가 되었다. 또, 획득 자손의 불임성을 확인하여 염색체의 재구성이 일어났을 것으로 추측됨에 따라 본 연구를 통해 H. arborescens와 H. quercifolia가 상당히 유전적 다양성이 넓혀 진 것으로 사료된다.