서 언
재료 및 방법
식물재료 및 재배조건
생육기간 별 생물계절 생육단계
OJIP 분석 및 엽록소형광 변수 산출
생육특성 및 내부갈변 여부
통계분석
결 과
재배온도별 무의 종자 발아 특성
생육기간별 무의 생물계절 생육단계
재배온도별 무 잎의 OJIP 곡선과 광계Ⅱ 활성의 변화
재배온도별 무 지상부의 생육특성
재배온도별 무 지하부의 생육특성
재배온도별 무의 내부 갈변양상
고 찰
서 언
무(Raphanus sativus L. var. hortensis Backer)는 뿌리 뿐만 아니라 잎까지 식용이 가능한 대표적인 근채류이며(Prakash and Hinata, 1980), 배추(Brassica campestris subsp. napus var. pekinensis, Makino)와 함께 김치의 주재료로 사용되고 있는 중요한 채소작물이다. 무는 생육기간이 짧고 영양학적 가치도 높아 국내에서 뿐만 아니라 전 세계적으로 널리 생산되고 소비되고 있으며, 각 나라의 기후와 토양, 소비자 기호에 맞게 다양한 품종들이 재배되고 있다(Akram et al., 2015; Zha and Liu, 2018). 한국, 중국, 일본 등 동아시아에서는 주로 흰색의 크기가 크고 긴 뿌리를 가지는 무를 많이 재배하고 있다. 제주도는 다른 지역과는 달리 온난한 기후로 인해 겨울철에도 노지에서 무를 재배할 수 있다. 무는 제주농업에 있어 감귤에 이어 단일품목 조수입 2위의 중요 작물이며, 제주산 무가 전국 생산량에서 차지하는 비중이 28%에 달할 만큼 지역 집중도가 높은 작목이다(Kim and Ko, 2014). 또한 무는 생육기간이 짧아 당근이나 감자 등의 파종 시기에 가뭄이나 태풍 피해를 입을 경우 대체작물로의 역할도 하고 있어, 농가소득 안정에 기여하는 효과가 크다.
그러나, 무는 고온에서 광합성 능력이 저하되고 활발한 호흡작용으로 양분 소모가 많아져, 뿌리의 발육이 현저하게 낮아지고 지하부에 축적되는 전분 함량 또한 극히 낮아진다(Lee et al., 2009; Oh et al., 2015b). 또한 고온에 노출된 무 뿌리의 내부에서 갈변 현상이 관찰되며, 높은 토양 온도가 내부 갈변을 유발하는 중요한 요인 중 하나로 보고되었다(Fukuoka and Enomoto, 2001; Fukuoka and Hamada, 2021). 이러한 현상은 무의 생산성 및 상품성 저하의 직접적인 요인이 된다. 따라서 안정된 무의 생산을 위해서는 고온이 무의 생육에 미치는 영향을 정량적으로 파악하고 고온 스트레스의 영향을 조기에 진단할 수 있는 기술을 개발할 필요가 있다. 광계II 활성은 환경 스트레스에 민감하여 식물 스트레스 분석을 위한 지표로 사용되고 있다(Ball et al., 1994; Strasser and Strasser, 1995; Oh et al., 2014). 또한 식물의 잎에 빛을 조사하였을 때 방출되는 형광의 시간대 별 밀도를 나타내는 OJIP 곡선(OJIP transient curve)의 분석으로 광계II에서의 에너지 흐름의 변화와 전자수용체의 환원 등 다양한 정보를 정량적으로 얻을 수 있다(Strasser et al., 2000). 호냉성 채소작물인 배추나 한지형 마늘(Allium sativum L.)에서도 엽록소형광이 고온 스트레스의 영향을 조기에 예측하는데 유용하게 이용될 수 있으며(Oh et al., 2014; Oh et al., 2015a), 밀(Triticum aestivum L.), 토마토(Solanum lycopersicum L.)의 고온 내성 품종을 선별하는데 있어서도 유용하여 작물 육종 분야에서도 이용가능성을 제시한 바 있다(Jain et al., 2018; Zhou et al., 2018).
최근 기후변화와 관련하여 휴면, 발아, 생장, 개화에 이르는 전 과정에서 기상환경이 작물생장에 어떠한 영향을 미치는지에 대한 생물계절 생육단계가 많은 관심을 받고 있다(Zhang et al., 2018). 생물계절은 온도, 토양수분, 일장 등 다양한 환경요소에 의해 결정되며, 그 중에서도 온도가 가장 지배적으로 작용하는 것으로 알려져 있다. 생물계절 연구에 널리 이용되는 Biologische Bundesanstalt, Bundessortenamt und Chemische Industrie(BBCH) stage는 식물 종의 생활사를 10 진수의 숫자 코드로 표현한 것이며, 작물의 생장 단계를 설명하는 데 유용하다(Lancashire et al., 1991). 또한, 식물의 여러 발달 단계에 대한 정확하고 표준화된 특성을 제공하기 때문에 잠두(Vicia faba L.), 감자(Solanum tuberosum L.), 홍화(Carthamus tinctorius L.)와 같은 여러 작물에 대한 연구에서도 BBCH stage가 사용되고 있으며(Lancashire et al., 1991; Hack et al., 1993; Flemmer et al., 2015), 육종, 해충 방제 등 응용 가능성도 많다(Leather, 2010).
본 연구에서는 주야간 온도를 달리한 조건(14/8°C, 19/13°C, 24/18°C, 29/23°C, 34/28°C)에서 무를 파종하여 재배하였을 때, 주야간 온도가 종자 발아, 잎과 뿌리의 생장에 따른 생물계절 생육단계, 엽록소형광, 지상부와 지하부의 생장 및 생산성에 미치는 영향을 조사하였다.
재료 및 방법
식물재료 및 재배조건
무는 근장이 짧고 근미 비대가 우수한 품종인 영동무(R. sativus L. var. hortensis Backer cv.Youngdong, Nongwoobio Co., Suwon, Korea)를 사용하였으며, 농암갈색 화산회토양(제주통 미사질양토)으로 채워진 20개의 대형포트(100 × 70 × 60cm)에 30cm 간격으로 종자를 파종하였다. 그리고, 광량 800µmol·m-2·s-1(16h light/8h dark)과 상대습도 60–70%인 조건하에서 주야간 재배 온도가 14/8°C, 19/13°C, 24/18°C, 29/23°C, 34/28°C로 설정된 배양실(2.7 × 5.0 × 2.2m, Model GR96, Conviron, Controlled Environments Inc., Chagrin Falls, USA)로 무 종자가 파종된 대형포트를 옮겨서 12주간 재배하면서 종자 발아, 잎과 뿌리의 발달단계에 해당하는 생물계절 생육단계, 무의 생육 및 광합성 특성 등을 조사하였다. 시비는 파종 전에 N-P2O5-K2O(6.0–3.0–2.5kg·100m-2)를 전량 기비로 시용하고 토양과 고르게 혼합하였다. 관수 관리는 재배기간 동안 2–3일 간격으로 점적관수하였으며, 진딧물 등 병충해 방제를 위하여 저독성 약제인 코니도(0.5g·L-1, FarmHannong Co., Seoul, Korea), 에이팜(0.5g·L-1, Syngenta, Seoul, Korea), 오티바(0.5g·L-1, Syngenta, Seoul, Korea)를 재배기간 중에 각각 1회씩 살포하였다. 무는 농촌진흥청 표준영농재배법에 준하여 관리하였다.
생육기간 별 생물계절 생육단계
파종 후 토양 표면으로 자엽이 출현(BBCH 09)하였을 때의 발아속도, 발아율, 유묘 길이, 생장지수 등의 특성을 비롯하여 잎의 발달단계(BBCH 10–19), 뿌리의 발달단계(BBCH 41–49)에 도달하는데 필요한 생육 일수도 조사하였다. 무의 생물계절 생육단계는 BBCH stage 0(발아)에서 9(노화)까지 단계별로 구분하고, 다시 각 생장단계별로 10개의 2차 생장단계(0–9)를 표시하였다(Feller et al., 1995). 생장지수는 (뿌리 길이 + 지상부 길이) × 발아율을 이용하여 계산하였다(Abdul-Baki and Anderson, 1973).
OJIP 분석 및 엽록소형광 변수 산출
OJIP 분석은 엽록소형광분석기(Plant Efficiency Analyzer, Hansatech Instrument Ltd., King's Lynn, UK)를 이용하여 수행하였다. 파종 후 50–55일 사이에 8–10번째 위치한 녹색의 성숙한 잎(BBCH 19)을 대상으로 샘플 클립을 사용하여 20분간 광을 차단하여 암적응시킨 후 1,500µmol·m-2·s-1의 광량을 5초간 조사하여 OJIP 곡선을 유도하였다. 이때 시간축은 10µs에서 1s의 범위로 설정하고, 10µs에서 2ms까지는 1µs 단위로, 2ms에서 1 s까지는 1ms 단위로 인식하도록 하였다. 그리고 OJIP 곡선으로부터 Fo, Fm, Fv/Fm 등의 기본적 형광변수들과 광계II 활성 상태의 반응중심의 밀도(RC/CSm), 반응중심을 통한 에너지 흐름의 변화(ABS/CSm, TRo/CSm, ETo/CSm, DIo/CSm) 등을 정량적으로 산출하여 제시하였다(Table 1; Strasser and Strasser, 1995). 엽록소형광을 측정한 잎을 대상으로 엽록소계(SPAD-502, Minolta Co., Ltd., Osaka, Japan)를 사용하여 SPAD 값을 측정하였다.
Table 1.
Short description of chlorophyll fluorescence parameters used in the study, according to the OJIP test
생육특성 및 내부갈변 여부
무의 생육특성은 파종 후 20일부터 85일까지 7일 간격으로 재배 온도 별로 각각 6개체를 무작위로 선발하여 지상부 길이, 엽면적, 그리고 뿌리의 길이와 직경, 바이오매스 등을 조사하였다. 바이오매스는 지상부와 뿌리로 구분하여 각각 생체중을 측정한 후, 70°C 건조실에서 5일간 건조시켜 건물중을 조사하였다. 엽면적은 길이가 1cm 이상인 잎을 대상으로 엽면적계(LI-3100, Li-Cor Inc., Lincoln, Nebraska, USA)를 이용하여 측정하였다. 지하부의 내부갈변 여부는 85일 동안 자란 무의 뿌리를 중심 축에서 세로로 자르고 갈변 정도는 육안 검사를 통해 없음(0%), 미세(10%), 조금(20–30%), 보통(50%) 및 심함(70% 이상)으로 변색의 정도를 5 가지 유형으로 분류하였다(Fukuoka and Enomoto, 2001).
통계분석
모든 통계분석은 SPSS 통계 패키지 18.0(SPSS, Chicago, IL, USA)를 이용하여 수행하였으며, 일원배치 분산분석 및 Duncan의 다중검정(p < 0.05)으로 평균치 간의 차이에 대한 유의성을 검정하였다.
결 과
재배온도별 무의 종자 발아 특성
무 종자의 발아는 토양 표면으로 자엽이 출현(BBCH 09)하였을 때를 기준으로 하였다. 파종 후 7일째에 발아율은 주야간 19/13°C 이상의 온도에서 85% 이상 높았으며, 14/8°C에서는 45.7%로 낮았다. 유묘의 길이는 24/18°C 이상의 온도에서 80 mm 이상으로 길었으며, 특히 29/23°C 이상의 온도에서는 하배축이 빠르게 신장하여 뿌리가 비정상적으로 만곡되는 양상을 보였다. 그러나 19/13°C 이하의 온도에서는 50mm 이하로 짧았다. 생장지수는 24/18°C 이상에서 7,000 이상으로 높았고, 19/13°C 이하에서는 낮았다. 그리고, 50% 이상의 종자가 발아하는데 걸리는 기간은 주야간 29/23°C 이상의 온도에서 4일 이내로 짧지만 24/18°C와 19/13°C에서는 5.7일, 14/8°C에서는 9.2일로 좀 더 길었다(Table 2).
Table 2.
Germination performance and seedling growth (BBCH 09) of radish (Raphanus sativus L. var. hortensis Backer cv. Youngdong) under different day/night temperatures
| Temperature (°C) | Germination parameters | |||
| Germinationz (%) | Seedling lengthy (mm) | Vigour indexx | T50w (days) | |
| 14/8°C | 45.7 ± 8.3 bv | 46.8 ± 3.5 d | 2138.7 ± 161.4 e | 9.2 ± 1.6 a |
| 19/13°C | 85.4 ± 7.9 a | 42.1 ± 2.6 d | 3602.9 ± 222.1 d | 5.7 ± 0.9 b |
| 24/18°C | 90.3 ± 5.5 a | 93.8 ± 3.6 b | 8476.2 ± 337.1 b | 5.7 ± 0.9 b |
| 29/23°C | 90.7 ± 6.2 a | 113.0 ± 3.9 a | 10257.8 ± 350.0 a | 3.5 ± 0.6 b |
| 34/28°C | 88.7 ± 2.4 a | 81.1 ± 2.3 c | 7196.7 ± 200.1 c | 3.0 ± 0.4 b |
생육기간별 무의 생물계절 생육단계
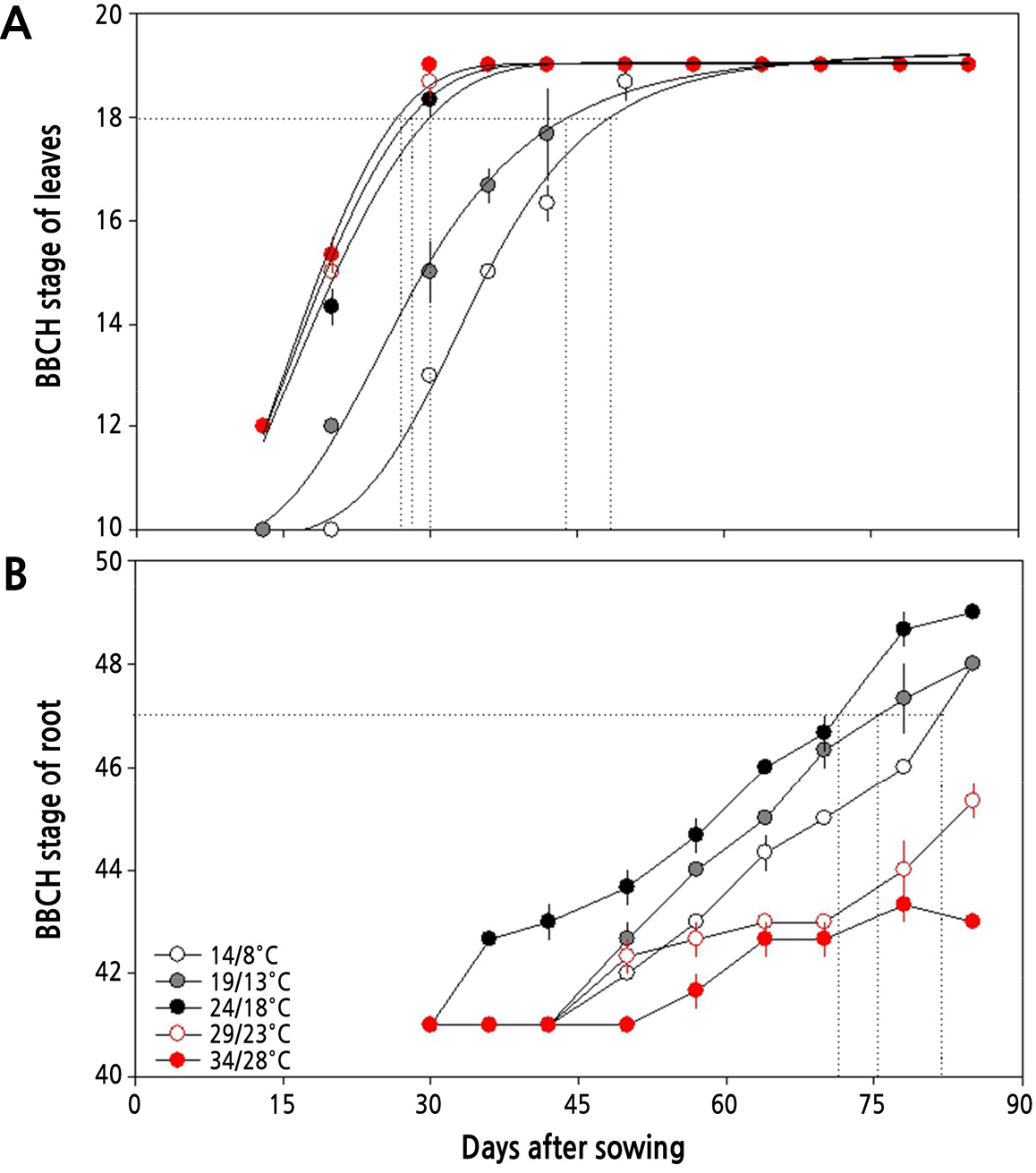
주야간 온도 별 무의 생육기간에 따른 생물계절 생육단계를 살펴보면(Fig. 1), 24/18°C 이상의 온도에서는 파종 후 30일 이내에 지상부의 생육이 BBCH 18 단계에 도달하지만 19/13°C와 14/8°C에서는 각각 43일과 47일이 소요되어, 높은 온도에서는 생장 속도가 빠름을 알 수 있다(Fig. 1A). 파종 30일 후 지상부의 생장은 24/18°C 이상의 온도에서 엽수도 많고 엽면적도 넓어지는 등 잎의 발달이 빠르게 나타나 BBCH 19 단계에 이르렀으며 지상부의 생장 속도가 빨랐다.
그러나 뿌리는 70% 정도 비대한 상태(BBCH 47; 길이와 직경이 각각 20cm와 7cm 이상으로 자랐을 때)로 발달하는데 필요한 기간이 24/18°C, 19/13°C, 14/8°C에서 각각 70일, 75.2일, 82일이 소요되었고 24/18°C 이하의 낮은 온도에서 더 길고 굵은 상태의 무를 생산할 수 있었다(Fig. 1B). 반면, 29/23°C와 34/28°C의 온도에서는 60% 이내로 비대하여 각각 BBCH 45와 BBCH 43 단계에서 더 이상 크지 않았으며, 뿌리가 곧게 자라지 않고 구부러지는 기형의 무가 만들어졌다.
재배온도별 무 잎의 OJIP 곡선과 광계Ⅱ 활성의 변화
재배온도별 BBCH 19 단계의 무 잎을 대상으로 OJIP 곡선의 변화를 조사하고 그로부터 광계II 활성의 변화를 산출하였다(Fig. 2). OJIP 곡선은 O, J, I-단계에서의 엽록소형광 밀도가 주야간 14/8°C와 34/28°C에서 다소 낮았으며, P-단계에서는 19/13°C와 24/18°C에서 월등히 높게 나타났다(Fig. 2A). OJIP 곡선으로부터 유도해낸 형광변수들 중에 광계II의 최대 광화학적 효율(Fv/Fm)은 24/18°C 이하의 온도에서 다소 높고 0.8에 근접한 안정된 값을 보였다(Fig. 2B). 초기형광수율(Fo)은 14/8°C와 34/28°C에서 다소 낮았으며(Fig. 2C), 최대형광수율(Fm)은 19/13°C와 24/18°C에서 높았다(Fig. 2D).
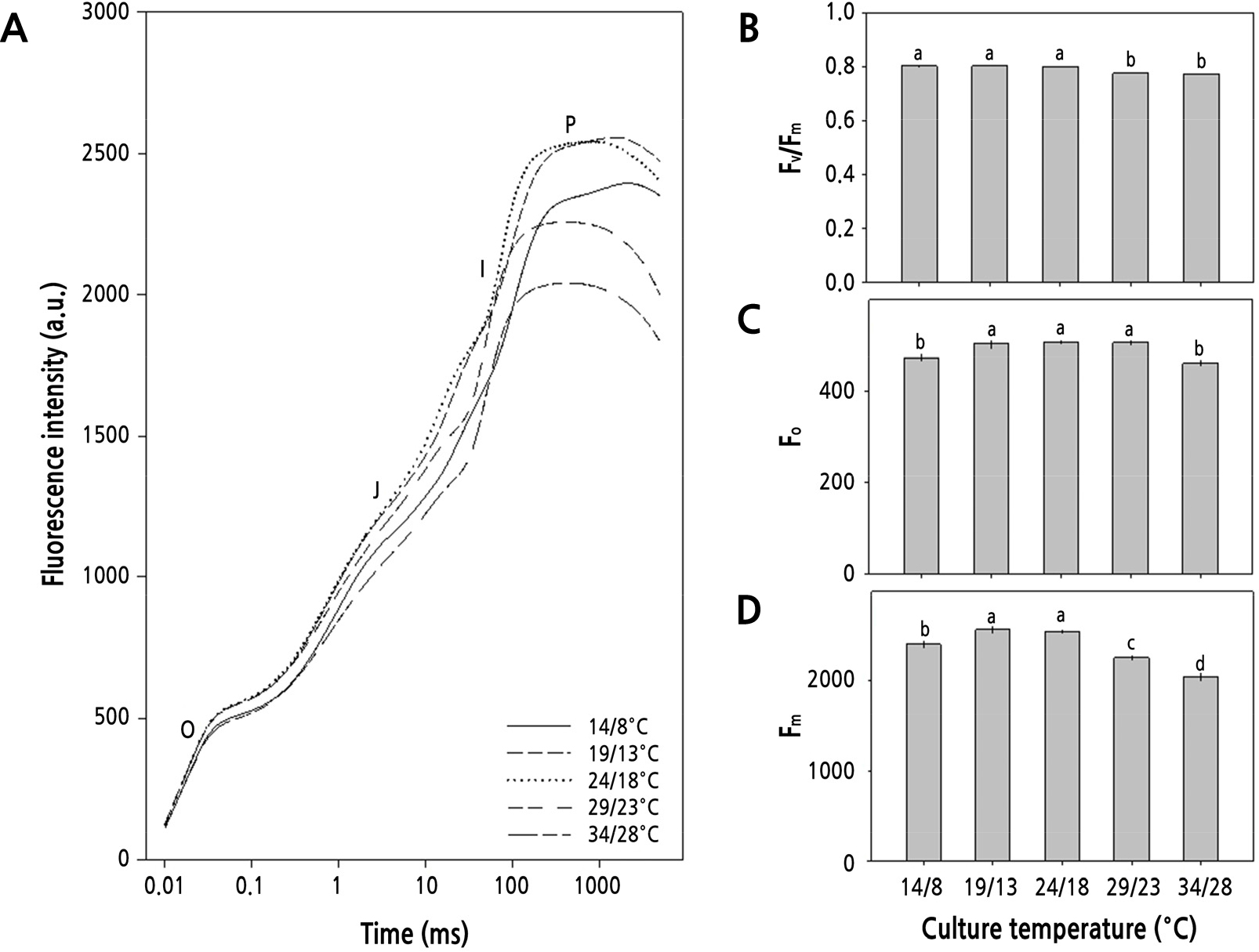
Fig. 2.
Chlorophyll a fluorescence O-J-I-P transient curves (A), photochemical efficiency of photosystem II (Fv/Fm, B), initial fluorescence (Fo, C), and maximal fluorescence (Fm, D) from dark-adapted leaves of radish (Raphanus sativus L. var. hortensis Backer cv. Youngdong) grown for 50 days (BBCH 19) in different day/night temperatures. Each column and error bar represents the mean ± SE of 20 replicates. The different letters above bars indicate significant differences among treatments (p < 0.05) by Duncan’s multiple range test.
광계II의 활성 상태의 반응중심의 밀도(RC/CSm)는 14/8°C와 19/13°C에서 높고 재배온도가 증가함에 따라 감소하는 양상을 보였다. 그리고, 반응중심을 통한 에너지 흐름의 변화를 나타내는 변수 중에 ABS/CSm과 TRo/CSm, ETo/CSm, DIo/CSm은 19/13°C와 24/18°C에서 높았다(Table 3).
Table 3.
Quantum efficiencies and effective absorption per excited cross section of PSII from leaves of radish (Raphanus sativus L. var. hortensis Backer cv. Youngdong) grown for 50 days (BBCH 19) under different day/night temperatures
| Temperature (°C) | Chl a fluorescence parametersz | ||||
| RC/CSm | ABS/CSm | TRo/CSm | ETo/CSm | DIo/CSm | |
| 14/8°C | 1924 ay | 2408 b | 1915 b | 1359 a | 493 b |
| 19/13°C | 1861 ab | 2571 a | 2040 a | 1434 a | 530 a |
| 24/18°C | 1782 b | 2551 a | 2017 a | 1410 a | 534 a |
| 29/23°C | 1467 c | 2256 c | 1725 c | 1168 b | 530 a |
| 34/28°C | 1317 d | 2041 d | 1558 d | 1070 c | 482 b |
재배온도별 무 지상부의 생육특성
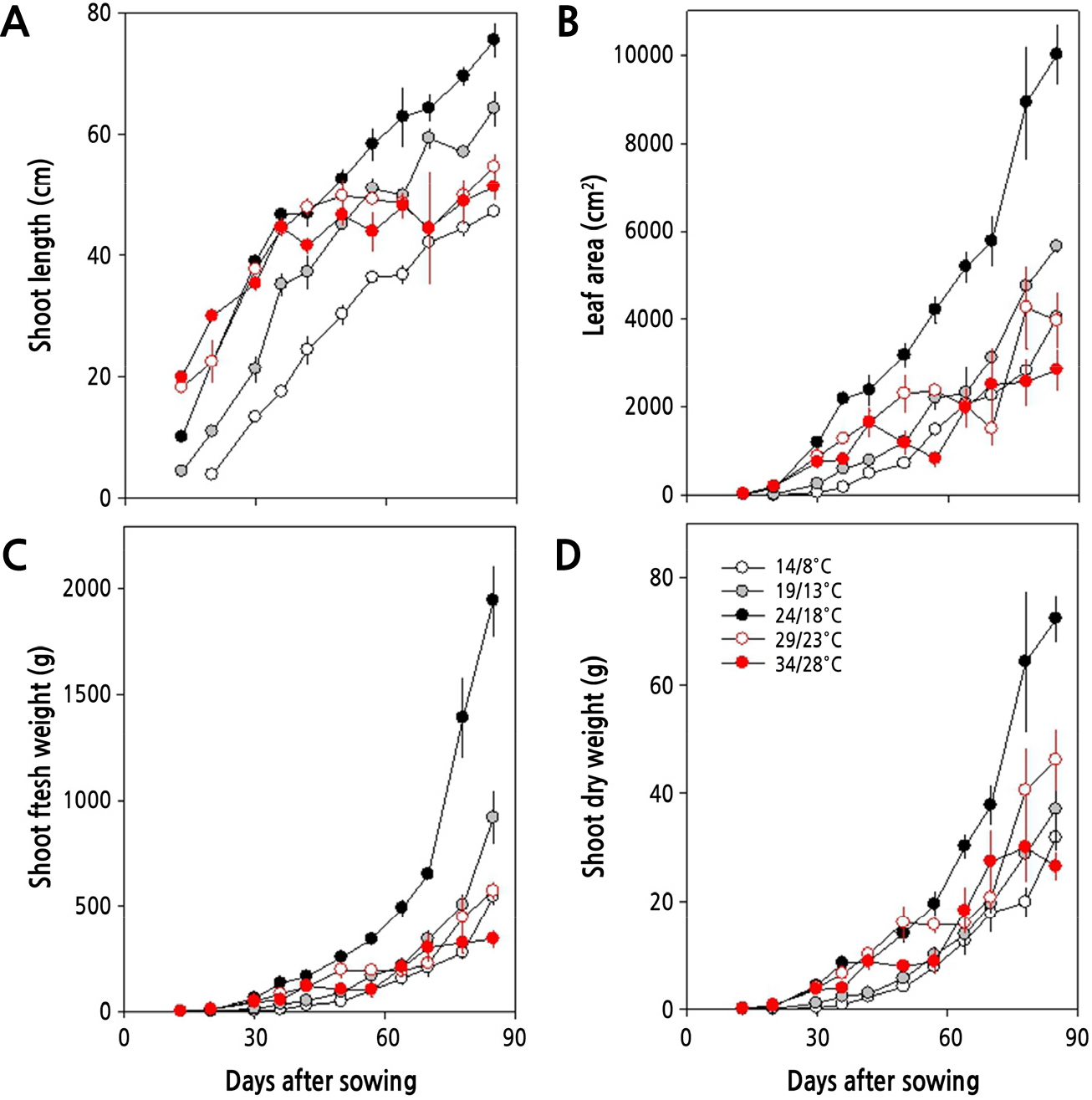
생육 초기(15–30일)에는 온도가 높을수록 초장이 길고 엽면적도 증가하며, 지상부의 바이오매스도 또한 더 무거운 양상을 보였다. 그러나, 생육 중기(30–60일) 이후에 이르러서는 주야간 24/18°C 이하에서 재배하였을 때 생육이 꾸준하게 이루어지는데, 19/13°C 이하의 온도에서는 24/18°C에 비하여 생장이 다소 느렸다. 그러나 29/23°C 이상의 온도에서는 지상부 생장이 점차 둔화되어 초장, 엽면적, 생체중이 감소하였다. 생육 후기(60–85일)에는 24/18°C에서 지상부 생육이 양호하였으며, 초장, 엽면적, 바이오매스 모두에서 월등히 높았다(Fig. 3).
재배온도별 무 지하부의 생육특성
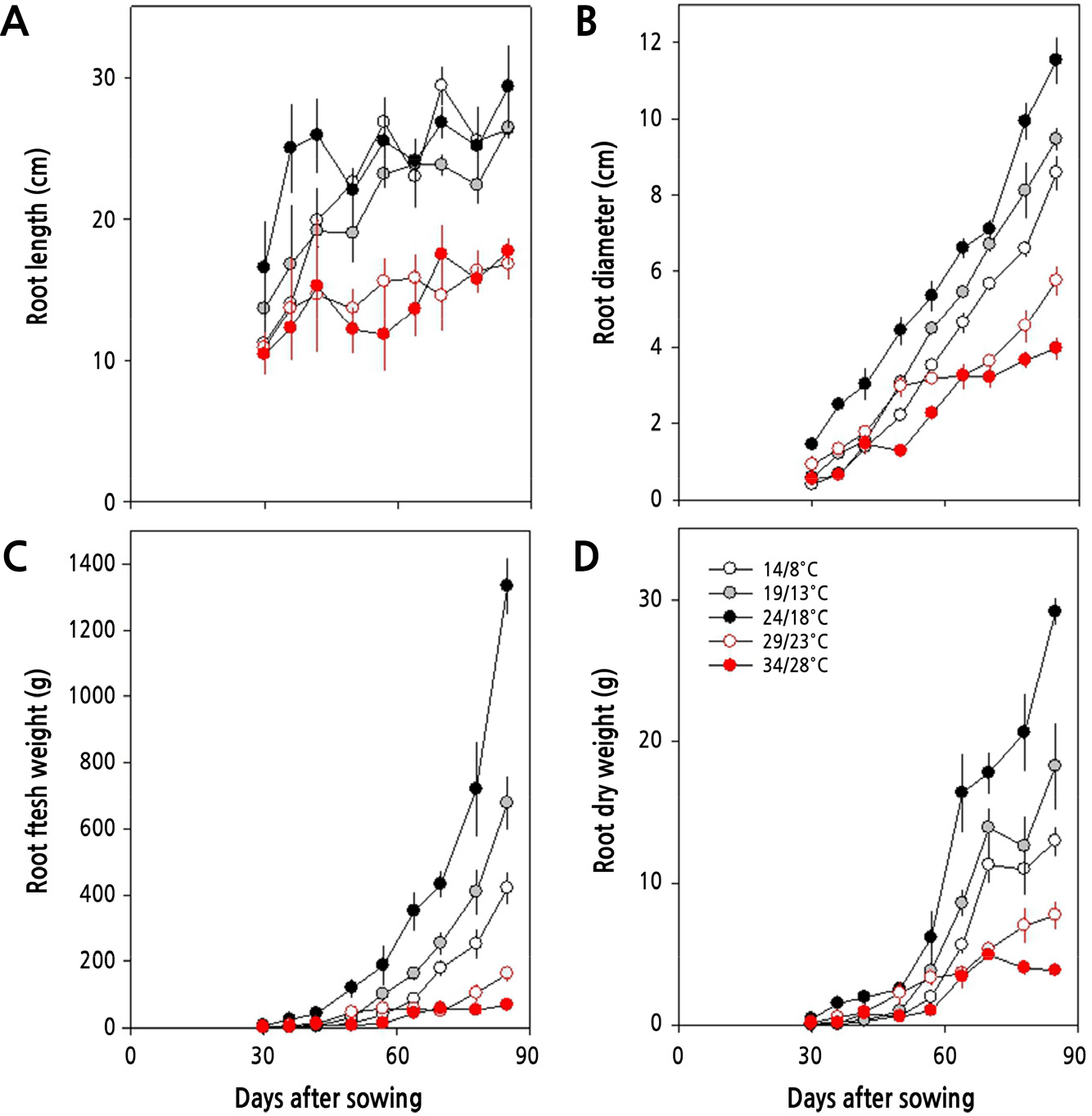
파종 30일 후 지하부의 생장은 주야간 24/18°C에서 가장 활발하였으며, 그 이상의 온도에서는 생장이 상당히 더디게 이루어졌으며, 그 이하의 온도에서는 생육 속도는 느리지만 수확기까지 지속적으로 증가하는 양상을 보였다(Fig. 4). 지하부의 길이는 초기에는 24/18°C에서 높았으나 이후에는 14/8°C, 19/13°C에서와 비슷하였으며, 지하부의 굵기와 바이오매스 모두에서 24/18°C에서 월등히 높았다. 생육 초기인 파종 후 35일에는 24/18°C와 29/23°C에서 무 지하부의 길이와 굵기가 컸으나, 생육 중기인 파종 후 60일에 이르러서는 19/13°C와 24/18°C에서 더 컸다(Fig. 5). 그리고 29/23°C 이상의 온도에서는 수확기에 지하부가 휘어지는 증상을 보이는 등 기형의 무가 형성되었다.
재배온도별 무의 내부 갈변양상
무 지하부의 내부 갈변은 주야간 29/23°C 이상의 온도에서 발생하였으며, 그 이하의 온도에서는 발생하지 않았다(Table 4). 29/23°C에서는 수확한 무의 60%가 내부에 미세하게 갈변이 나타났으며, 34/28°C에서는 90%가 갈변하였으며 갈변의 정도도 더 두드러지게 나타났다. 특히 34/28°C에서는 파종 후 47일부터 일부 개체에서 내부에 미세하게 갈변되기 시작하였으며, 77일에 갈변 발생이 많아져 수확기인 파종 후 91일에는 대부분의 무가 내부에 갈변이 이루어졌다. 또한 29/23°C 이상의 온도에서 재배된 일부 개체에서는 뿌리의 외부 표면에도 상단 부분에서 균열되고 연한 흑갈색으로 변하기도 하였다(Data not shown). 생육 후기 34/28°C인 고온에서 뿌리 비대와 더불어 내부 갈변 발생량은 많아지고 갈색심부증상도 심해지는 경향을 보였다.
Table 4.
The occurrence of internal browning in root of radish (Raphanus sativus L. var. hortensis Backer cv. Youngdong) grown for 85 days in different day/night temperatures. Internal browning is classified into five types according to the degree of severity
| Temperature (°C) | Roots with internal browning (%) | ||||
| None | Slight | Little | Moderate | Severe | |
| 14/8°C | 100 | 0 | 0 | 0 | 0 |
| 19/13°C | 100 | 0 | 0 | 0 | 0 |
| 24/18°C | 100 | 0 | 0 | 0 | 0 |
| 29/23°C | 40 | 40 | 20 | 0 | 0 |
| 34/28°C | 10 | 30 | 40 | 20 | 0 |
고 찰
온도는 식물의 생장과 발달에 있어 매우 중요한 환경인자로, 생육 적온을 벗어난 고온이나 저온은 작물의 생산성과도 직결된다. 고온에 노출된 작물은 광합성량의 감소와 호흡량의 증가 등으로 인해 생산량 감소, 품질 저하 등이 초래될 수 있다.
본 연구에서 무의 생장단계를 지상부와 지하부로 구분하여 생물계절 생육단계를 살펴본 바, Fig. 1에서와 같이 주야간 24/18°C 이상의 온도에서는 잎의 발달이 파종 후 30일 이내에 BBCH 19 단계에 이르게 되지만 19/13°C와 14/8°C에서는 각각 43일과 47일로 늦게 나타나 낮은 온도에서는 생장 속도가 늦음을 알 수 있다. 그리고 뿌리의 발달은 24/18°C 이하의 온도에서 더 길고 굵은 무를 생산할 수 있었다. Fig. 3과 4에서 살펴본 바와 같이 파종 30일 후 지상부와 지하부의 생장은 주야간 24/18°C에서 가장 길고 무거웠으며, 초장 또한 길고 엽면적도 넓었다. 더군다나 Fig. 2에서처럼 광계II의 최대 광화학적 효율(Fv/Fm)이 24/18°C에서 높고, Table 3에서 살펴본 바와 같이 광계II의 활성 상태의 반응중심의 밀도(RC/CSm)가 다소 감소하지만 엽면적당 흡수되는 빛에너지(ABS/CSm)와 광계II의 반응중심에 포획되는 에너지(TRo/CSm), 전자전달로 전해지는 에너지(ETo/CSm)가 모두 크게 증가하고 있어 광계II 활성이 높음을 알 수 있다.
그러나, 24/18°C 이상의 온도에서는 생육 초기에 지상부 길이가 24/18°C와 유사하나 후기에는 온도가 높아질수록 지하부의 길이와 굵기, 그리고 엽면적이 24/18°C에서 보다 작았다. 그리고 29/23°C의 온도에서는 생육 초·중기까지 비대근의 신장이 활발하나 생육 후기에 지하부의 비대가 억제되고, 34/28°C에서는 억제 정도가 더 심각하였다. 또한, 24/18°C 이상의 온도에서는 온도가 높아질수록 엽면적도 감소할 뿐만 아니라 지하부의 길이와 굵기가 점차 줄어들었다. 더군다나 생육 중기(30–60일)와 후기(60–85일)에 이르러서 29/23°C와 34/28°C에서 점차 지상부 생장이 둔화되어 초장, 엽면적, 생체중이 크게 감소하고(Fig. 3), 무 지하부의 길이, 굵기, 바이오매스 모두에서 크게 감소하여, 고온이 무 생장에 비우호적으로 작용하고 있음을 알 수 있다(Fig. 4). 고온이 무의 생장에 비우호적으로 작용한다는 사실은 광계II의 최대 광화학적 효율(Fv/Fm)이 주야간 29/23°C 이상의 온도에서 감소하는 것으로 알 수 있다(Fig. 2). 더욱이, Table 3에서 살펴본 바와 같이 광계II의 활성 상태의 반응중심의 밀도(RC/CSm)가 크게 감소하고, 엽면적당 흡수되는 빛에너지(ABS/CSm)와 광계II의 반응중심에 포획되는 에너지(TRo/CSm), 전자전달로 전해지는 에너지(ETo/CSm)가 모두 크게 감소하고 있어 광계II 활성이 낮음을 알 수 있다. 이러한 결과는 수수(Sorghum bicolor (L.) Moench)나 배추, 한지형 마늘의 재배에 있어서도 생육 적온을 벗어난 고온에 의해 나타나는 것으로 보고된 바 있어(Yan et al., 2012; Oh et al., 2014, Oh et al., 2015a), 무 재배에 있어서도 24/18°C 이상의 온도에서 불활성 상태의 반응중심이 증가하거나 광계II의 반응중심이 손상되고 궁극적으로 무의 품질에 영향을 미치고 있음을 알 수 있다(Fig. 5). 한지형 마늘의 인경과 아마릴리스속 식물인 Hippeastrum sp.의 구근에서도 고온에 의해 품질이 저하되는 것으로 보고된 바 있다(Oh et al., 2019; Inkham et al., 2019).
한편, 무 지하부의 내부 갈변은 파종 시기, 품종, 비료나 재배 온도 등을 포함한 여러 요인에 따라 차이가 있다(Kawashiro and Takeda, 1988; Fukuoka and Kano, 1990; Kawai et al., 1992; Kawai et al., 1995). 특히, 생육 후반에 토양 온도가 높아졌을 때 내부 갈변이 심한 것으로 보고되고 있는데, 본 연구에서 29/23°C 이상의 온도에서만 내부 갈변이 발생하였으며, 그 이하의 온도에서는 발생하지 않았다.
따라서 주야간 24/18°C에서 가장 무거우면서 굵고 길게 뻗은 품질이 양호한 무를 생산할 수 있을 뿐 아니라 지하부의 내부 갈변도 발생하지 않아서, 상품성 있는 크기의 비대근 무를 생산하기 위한 재배 적온은 주야간 24/18°C로 보인다. 그러나, 이보다 낮은 온도에서는 생육 초기에 보온해주거나 생육 후기에 질소비료를 추비하거나, 수확시기를 좀 더 늦추는 등의 세심한 관리가 필요할 것으로 보인다. 그러나, 엽채를 위해서 어린 무를 조기에 수확하는 것을 목적으로 할 때에는 종자의 발아속도, 발아율, 유묘 길이, 생장지수, 잎과 뿌리 생장 등을 감안하였을 때 29/23°C에서 재배하는 것이 바람직하다고 볼 수 있다. 하지만, 29/23°C에서 비대근 무를 생산하고자 할 때에는 관개량 조절, 조기재배 등을 고려할 필요가 있으며, 갈색심부증상과 같은 병이 발생하지 않도록 붕소를 처리하거나 고온에서도 잘 견디는 품종을 선택하는 등의 대책이 필요한 것으로 보인다.