서 언
스탠다드 절화 국화의 초장과 생체중은 시장가격을 결정하는 중요한 요소이다(Kim et al., 2010; MAFRA, 2019). 절화 국화의 생장량은 재배조건에 따라 달라지며 특히 재배시기에 따라 영양생장량을 증가하기 위한 장일처리 기간, 단일처리 시 일중 평균 광량 및 야파처리 유무, 일중 평균온도와 주간과 야간의 온도 편차, 왜화제 처리와 빈도에 따라 영향을 받게 된다(Mastalerz, 1977; Karlsson and Heins, 1994; Carvalho et al., 2002). 재배기간 중 다양한 환경요인에 따라 작물은 다이나믹한 생육을 나타내고, 국화의 줄기 신장은 온도, 광도, 광질, 일장, 상대습도, CO2 농도, 재식밀도와 같은 요인에 의해 영향을 받는다(Carvalho and Heuvelink, 2001; Carvalho et al., 2002). 기상환경에 따른 국화의 생육반응을 이해하는 것은 재배관리에 있어서 매우 중요한 요소이며, 초장의 동적생장을 정량화하고 해석 하기 위해서는 묘사적 모델인 생장함수를 이용한 생장해석이 필요하다. 묘사적 모델은 작물의 생장을 해석할 수 있는 유용한 도구로서 생육 측정값들의 정량적인 요약이 가능하며(Marcelis et al., 1998), 측정값을 기반으로(Penning de Vries et al., 1989; Lee, 2002) 시계열에 따른 식물체 혹은 기관의 생장데이터에 대해 생물학적 의미를 가지고 있는 파라미터를 추정할 수 있다(Thornley and France, 2007; Wardhani and Kusumastuti, 2014). 파라미터는 다이나믹한 식물의 생육 및 수량에 대한 생물학적 반응을 나타낼 수 있어(Venus and Causton, 1979; Goudriaan and Monteith, 1990), 온실 작물의 생장 및 발육을 예측하여 생산자의 의사결정 방향을 제시하는 도구로 사용할 수 있다(Jame and Cutforth, 1996; Cha et al., 2014; Lee et al., 2019). 시그모이드 생장모델 중 Gompertz 모델은 이중지수로 배열된 세개의 파라미터를 가지고 있으며(Richards, 1959; Hunt, 1982; Thornley, 1982; Draper and Smith, 1998), 국화, 검은콩, 녹두, 알팔파, 옥수수, 숙마, 팥(Lee and Chung, 2003; Wardhani and Kusumastuti, 2014; Bem et al., 2017; Cao et al., 2019)과 같은 다양한 작물의 초장의 신장량을 묘사하는데 사용되었으며, 작물의 다이내믹한 생육을 묘사할 수 있고, 실험자료들을 요약할 수 있는 모델로 알려져있다.
스탠다드 절화국화 ‘백마’는 생태적 분류로 만생 하추국에 속하며(Shin et al., 2005), 재배과정은 영양생장을 위한 장일처리기간, 생식생장을 위한 단일처리기간으로 구분된다. 장일처리기간과 단일처리기간을 나누는 기준은 광주기이며, 광주기는 국화의 영양생장과 생식생장을 조절할 수 있는 주요 환경요인이다(Khodakovskaya et al., 2009). 스탠다드 절화 국화를 생산하기 위해 재배환경에 따른 생육조절을 통해 초장의 생장량을 제어할 수 있어야 하나, 시계열에 따른 스탠다드 절화국화의 다이내믹한 생장변화특성, 시설재배환경에 대한 기상정보와 같은 재배기술에 대한 구체적인 연구는 미흡한 실정이다. 따라서, 본 연구는 Gompertz 생장모델을 이용한 스탠다드 절화 국화의 다이내믹 초장의 생장 패턴을 분석하여 스탠다드 절화 국화 생장조절기술 및 생육모델에 활용 할 수 있는 기초자료로 활용하고자 수행하였다.
재료 및 방법
실험 재료
스탠다드 절화 국화(Dendranthema grandiflorum) ‘백마’ 삽목묘를 농가에서 구매하여 전남대학교 농업생명과학대학 식물공장(51.48m2) 내 펄라이트가 충진된 세개의 블록(블록당 60cm × 600cm)에 표준양액 2.5dS·m-1 을 포습하여 재식밀도 64.6주/m2으로 정식하였다. 처리구의 배치는 3블록으로 나눠 각 블록에 5개의 처리구를 난괴법으로 60주씩 3반복 배치하였다.
재배 환경 및 일장처리
‘백마’는 순환식 수경재배 시스템을 이용하여 급액을 EC 2.5dS·m-1, pH 5.5–6.0으로 관리하였고, 재배기간 중 식물공장 내부온도는 냉방기 및 시스템 에어컨(LTNW602SP, LG, Korea)을 이용하여 일평균온도 25°C로 설정하였다. 광원은 형광등(30W, Osram, Germany)을 사용하여, 식물체 정단부에 조사되는 광합성 유효 광량자속 밀도(photosynthetic photon flux density, PPFD)를 평균 147.6 ± 14.8µmol·m-2·s-1로 관리하였다. 정식 후 23일 동안 모든 처리구의 일장은 16시간으로 하였고, 각 처리구에 따라 실험종료일까지 8, 10, 12, 14, 16시간(8H, 10H, 12H, 14H, 16H) 동안 광조사하였다. 정식 후 24일 이후 처리구의 일장이 길어질수록 일 적산광량은 증가하였고, 단위시간 당 0.11Mj·m-2 적산광량이 증가하였다. 일 평균온도는 25.0 ± 1.0°C – 25.3 ± 1.8°C로 처리구간의 큰 차이를 보이지 않았고, 주야간온도편차 또한 낮았으며, 각 처리구의 온도환경은 유사하게 관리하였다(Table 1).
Table 1.
Averaged daily photosynthetically active radiation (PAR) integral of before (BT) and after (AT) photoperiod treatments by fluorescent lamps and day, night and daily temperature during the standard cut chrysanthemum ‘Baekma’ cultivation period
|
Photoperiod treatmentz |
BT PAR integral (MJ·m-2) |
AT PAR integral (MJ·m-2) |
Day temperature (°C) |
Night temperature (°C) |
Daily temperature (°C) |
| 8H | 1.77 | 0.88 | 26.1 ± 0.4 | 24.4 ± 0.4 | 25.0 ± 1.2 |
| 10H | 1.77 | 1.11 | 26.3 ± 0.8 | 24.6 ± 0.3 | 25.3 ± 1.4 |
| 12H | 1.77 | 1.33 | 26.7 ± 1.2 | 24.4 ± 1.2 | 25.5 ± 1.8 |
| 14H | 1.77 | 1.55 | 25.5 ± 1.3 | 24.4 ± 1.3 | 25.1 ± 1.6 |
| 16H | 1.77 | 1.77 | 25.8 ± 1.5 | 24.4 ± 1.4 | 25.3 ± 1.8 |
생육 조사 및 통계분석
정식일부터 최종조사일까지 각 블록 처리구의 5주 샘플을 대상으로 2-4주 간격으로 초장을 조사하였다. 최종조사는 설상화의 바깥 꽃잎이 수평적으로 위치할 때를 기준으로 하였고, 개화하지 않은 처리구는 12H 이하 처리구 중 가장 늦게 개화한 처리구와 동일하게 실험을 종료하였다.
처리구별 측정된 ‘백마’의 시계열에 따른 초장은 비선형 회귀식 Gompertz 생장모델(Gompertz, 1825)을 이용하여 모델 함수의 매개변수를 SPSS 통계 프로그램(PASW18, IBM, USA)의 비선형회귀분석으로 추정하였다.
yasm(cm)는 점근선 곡선의 x가 무한일때의 최대값이며, k(d-1)는 곡선의 형태를 결정하는 상대 생장율, tinf(d)는 최대생장율에 도달하는 일수, y0(cm)는 x가 -∞일 때 y값을 나타냈다. x(d)는 정식 후 일수이다.
시계열에 따른 줄기의 절대 신장율(absoluted stem elongation rate, cm·d-1)는 Eq. 1의 도함수를 이용하여 계산하였다(Eq. 2).
초장은 처리에 따라 개화일이 상이하여, 초장을 발육단계에 따른 Gompertz 생장모델의 매개변수를 추정하기 위해 독립변수를 국화의 발육 단계(development stage, DVS)를 장일처리 동안은 0에서 1.0, 단일처리기간 시작일을 1.0 각 처리구의 실험 종료일은 2.0로 변환하여 회귀모델의 독립변수로 사용하였다. 종속변수 초장은 최대 길이대비 각 측정값을 나눈 비를 0에서 1.0로 변환하였다(Karlsson and Heins, 1994; Lee, 2002; Seo et al., 2016). 14H과 16H 처리구는 재배기간동안 장일처리가 지속되었으므로, DVS 0에서 1.0 사이 값으로 변환하여 DVS에 대한 변화된 Gompertz 생장모델(Eq. 3)의 매개변수를 추정하였다.
변환된 파라미터의 단위은 측정값을 상대값으로 변환되었기 때문에 각 파라미터의 단위는 상쇄 되었으며, yasm.DVS 는 점근선 곡선의 발육단계가 무한일때의 최대값이며, kDVS는 곡선의 형태를 결정하는 상대 생장율, tinf.DVS는 최대생장율에 도달하는 발육단계, y0.DVS는 DVS가 -∞일 때 yDVS값을 나타냈다.
결과 및 고찰
Table 2는 일장처리에 따른 스탠다드 국화 ‘백마’의 최종 생육량에 대해 나타냈다. 일장처리 후 평균 출뢰소요일은 단일조건인 8H 처리구에서 59일로 가장 지연되었고, 14H와 16H 장일 처리구에서는 출뢰하지 않았다. 8H 처리구의 출뢰지연은, 일장처리 후 일적산광량(daily light integral, DLI)이 0.88MJ·m-2·d-1로, 일적산광량 1.0-1.5MJ·m-2·d-1에서는 국화의 화아분화 를 위한 소요시간에 광량의 영향은 거의 없지만, 더 낮은 광수준에서 화아분화가 지연된다는 결과와 유사했다(Langton, 1992). 평균 개화소요일은 8H, 10H, 12H 처리구 간에 유의적인 차이는 없었다. 14H와 16H 처리구에서 출뢰되지 않았고 지속적인 생장이 이뤄졌으며 장일은 화아분화억제 효과가 뛰어났고(Kwon et al., 2012), 16시간 이상의 광주기에서는 개화가 되지 않는다는 결과와 유사하였다(Oda et al., 2010). 일장 처리에 따른 최종 초장과 마디 수는 단일 및 중일조건인 8H, 10H, 12H 처리구에서는 유의적인 차이를 보이지 않았고, 12H-16H 처리구까지의 초장과 마디수의 변화는 단위일장 당 각각 14cm, 11마디 증가하였다(Table 2). Carvalho et al.(2003)에 따르면 장일처리기간의 초장 신장량은 절간장의 신장보다는 절간수의 증가에 의해 증가한다고 하였고, 광주기의 증가는 절간수를 증가시켜 국화의 초장을 신장시킨다고 하였다(Cathey, 1974). 처리구의 평균절간장은 1.2-1.4cm로 일장처리에 따른 차이를 보이지 않았고, 따라서 장일조건인 14H와 16H 처리구에서 지속적인 마디 출현에 의해 초장과 마디 수가 신장 및 증가한 것으로 Carvalho et al.(2003)과 Cathey(1974)의 결과와 동일하였다. 식물체의 생체중은 단일처리구인 8H와 10H간의 유의적인 차이가 보이지 않았고, 일장의 증가에 따른 10H에서 16H 처리구까지의 식물체 생체중은 선형적인 증가를 나타냈다(y = 9.87x–57.47, R2 = 0.961, P = 0.02).
Table 2.
Final characteristics of budding and flowering days after treatment, plant height, plant fresh weight, and number of intrernodes of standard cut chrysanthemum ‘Baekma’
| Photoperiod treatmentz | Days to buddingy | Days to floweringx | Plant height (cm) | Plant fresh weight (g) | Number of internodes |
| 8H | 59wav | 92 a | 56.0 a | 42.22 a | 46 a |
| 10H | 49 b | 83 a | 57.1 a | 44.89 a | 45 a |
| 12H | 50 b | 100 a | 59.5 a | 58.29 b | 40 a |
| 14H | - | - | 90.5 b | 74.75 c | 69 b |
| 16H | - | - | 117.2 c | 105.17 d | 83 c |
Fig. 1A는 ‘백마’의 초장신장량을 Gompertz 생장모델의 파라미터 최대줄기신장량(yams), 상대줄기신장율(k), 최대줄기신장율에 도달하는 일수(tinf)를 이용하여 97%이상 유의적으로 묘사할 수 있었다(Fig. 1A and Table 3). 점근선의 최대값인 yams의 12H 이하의 단일 조건에서는 각 처리구에 따라 유의적 차이가 없었으며, 최대 생장율에 도달하는 정식 후 일수에 정식 후 28일로 유의적인 차이가 없었다. 반면 Gompertz 의 생장율을 결정하는 k의 단일기간 동안의 일장이 길수록 급격한 생장율은 보였다. 장일 처리구인 14H와 16H 처리구에서 초장은 지속적으로 증가하였으며, 12시간 이상의 일장에서 yasm의 변화는 장일처리 1시간 당 23cm의 초장이 신장량을 보였다. 장일처리구의 tinf는 일장이 12H에서 16H 까지 증가할수록 최대 생장율에 도달하는 정식 후 일수는 선형적으로 증가하였다(y = 11.65-111.17*, R2 = 0.999, P = 0.02). Gompertz 생장량의 변화율에 관여하는 k 값이 14H와 16H 장일처리구에서 12H 처리구 보다 73%, 65% 낮았다(Table 3). 일장에 따른 최대 줄기신장율(MGR)은 처리구 중 12H 처리구에서 1.15 cm·d-1로 가장 높았으며, 장일처리인 14H와 16H 처리구에 비해 각각 64%와 29% 높았다(Fig. 1B and Table 3). 장일조건인 14H와 16H 처리구가 12H 처리구보다 낮은 MGR을 나타낸 것은 영양생장이 지속되고 마디 출현이 지속됨에 따라 최대 줄기신장율 및 상대신장율 또한 감소하였다. 단일처리구인 8H에서 12H 까지의 절대 생장율은 k 값이 증가할수록 높은 생장율을 나타냈으며, 장일처리구인 14H와 16H 처리구 에서는 생장율의 증가는 느슨하였다. 8H, 10H, 12H 처리구에서의 최대 절대 신장율에 도달하였을 때 각 처리구의 초장은 yams의 51.6%, 52.8%, 52.9%였지만 14H과 16H의 장일 처리구에서는 yams값이 45.2%, 42.1%로 나타났다. 초장의 신장율은 광환경 중 일장 및 광량의 영향을 받았고, Shipley(2002)결과와 유사하였다. 따라서 장일조건인 14H, 16H 처리구와 단일조건인 8H-12H 처리구의 정식 후 일수에 따른 ‘백마’의 초장 신장패턴은 단일처리기간에서는 한계일장을 최대로 유지하는 것이 줄기신장율과 신장량에 높게 유지할 수 있었으며, 한계일장을 넘는 경우 초장의 신장량은 최대 신장율은 낮지만 마디의 출연이 지속되고(Table 2), tinf가 지연됨에 따라 초장의 신장량이 길어진 것으로 판단된다.
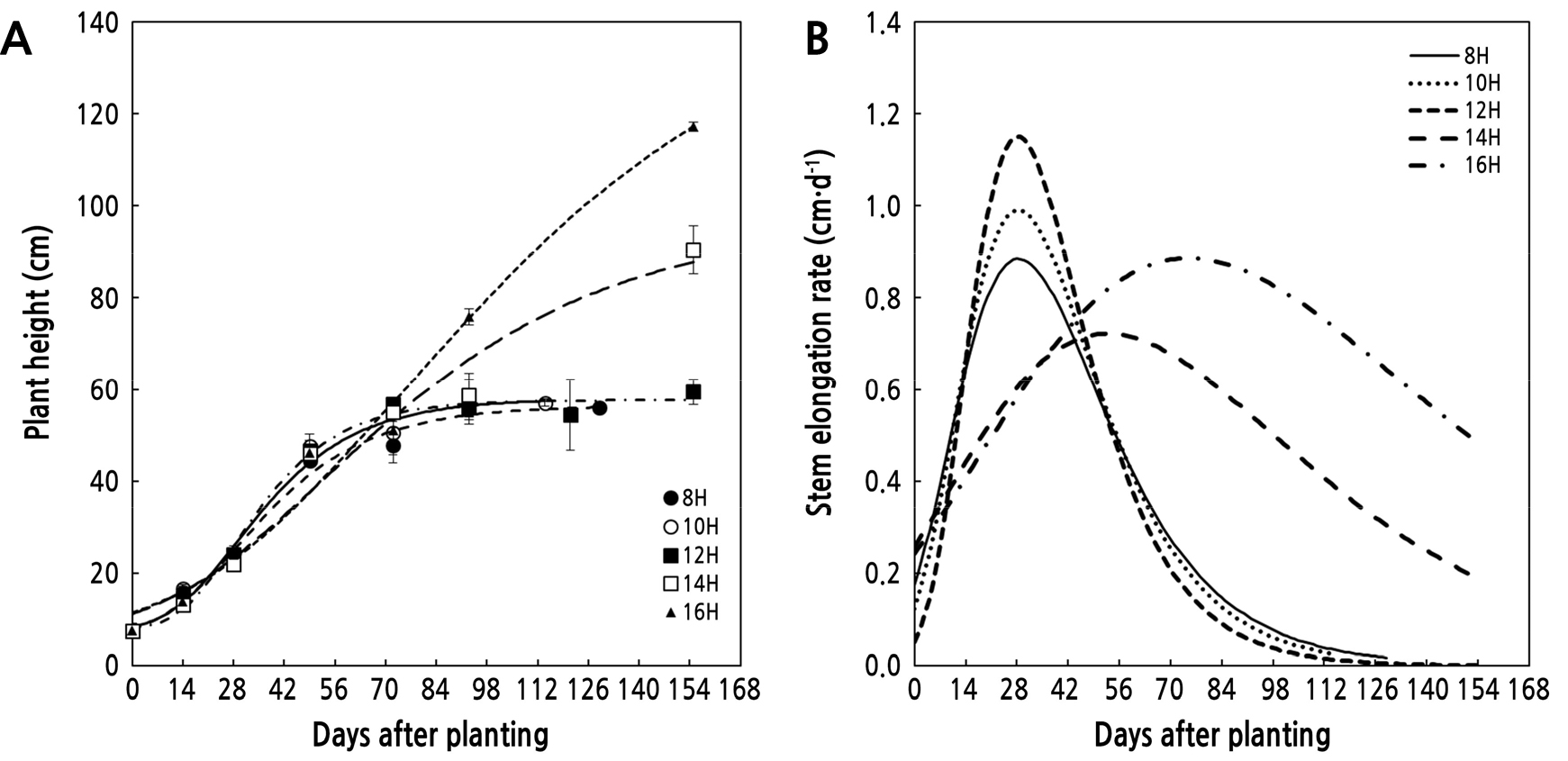
Fig. 1.
Effect of day length on plant height (A) and stem elongation rate (B) of standard cut-chrysanthemum ‘Baekma’ grown hydroponically under artificial lighting by fluorescent lamps. Day length imposed for 8, 10, 12, 14, and 16 hours by fluorescent lamps after 16 hours long-day treatment for 23 days after planting. Solid lines were fitted measurement data by Gompertz growth function. Vertical bars bigger than symbols indicate the standard errors (SE) of the mean of three independent blocks (n = 15).
Table 3.
Estimated parmameters of Gompertz growth model fitted the dynamics of measured plant height as function of days after planting (Eq. 1) and maximum absolute stem elongation (MGR) of standard cut-chrysanthemum ‘Baekma’ grown at different photoperiod treatments
|
Photoperiod treatmentz | Parametersy | R2 | MGR (cm·d-1) | |||
| yams (cm) | k (d-1) | tinf (d) | y0 (cm) | |||
| 8H | 49.12 ± 9.29x | 0.049 ± 0.036 | 28.41 ± 7.26 | 7.30 ± 0.46 | 0.985 | 0.89 |
| 10H | 49.90 ± 13.18 | 0.054 ± 0.099 | 28.35 ± 8.75 | 8.00 ± 0.44 | 0.982 | 0.99 |
| 12H | 49.66 ± 1.59 | 0.063 ± 0.243 | 28.23 ± 2.29 | 8.00 ± 0.39 | 0.991 | 1.15 |
| 14H | 89.29 ± 20.76 | 0.022 ± 0.017 | 52.78 ± 13.21 | 7.50 ± 0.18 | 0.969 | 0.72 |
| 16H | 141.75 ± 47.01 | 0.017 ± 0.016 | 74.81 ± 22.16 | 7.50 ± 0.16 | 0.986 | 0.89 |
일장처리수준에 따라 정식 후 일수에 따른 평균출뢰소요일, 평균개화소요일 그리고 최종초장은 처리구에 따른 유의적인 차이는 발육량에 따라 상이하였기 때문에 독립변수와 종속변수를 상대적값으로 변환시켜 초장의 신장과정을 비교하기 위해 생육단계에 따른 상대초장의 신장과정은 Fig. 2A에 나타냈다. 일장처리에 따른 ‘백마’의 상대초장은 Gompertz 생장모델의 파라미터, 최대상대줄기신장량 yasm.DVS, 상대줄기상대신장율 kDVS, 최대상대줄기신장율에 도달하는 DVS(tinf.DVS)를 이용하여 99%이상 유의적으로 묘사하였다(Fig. 2A and Table 4). yams.DVS는 8H-12H 단일처리구에서 0.819-0.833로 큰 차이를 보이지 않았고, 14H와 16H 처리구는 1을 나타내 12H 처리에 비해 22% 높게 추정되었다. 14H와 16H 처리구의 y0.DVS는 -0.001과 -0.014로 8H-12H 처리구보다 0에 가까웠으므로 yams.DVS가 높게 추정되었다. kDVS은 14H와 16H 처리구에서 12H 처리구에 비해 곡선의 변화가 급격하였으며 tinf.DVS는 12H 이하의 단일 처리구에서는 1.14-1.224 DVS로 단일처리 이후의 최대 상대 생장율을 나타냈다. 14H와 16H의 장일조건에서는 장일처리기간의 전체 발육단계의 47.8%와 58% DVS에서 최대 상대생장율지수를 나타냈다(Table 4). 최대 상대 생장율지수에 도달시 12H 이하의 단일처리구에서는 상대 초장의 길이는 전체 길이의 68%, 14H과 16H 처리구에서는 총 각각 62%와 63%에 도달하였다.
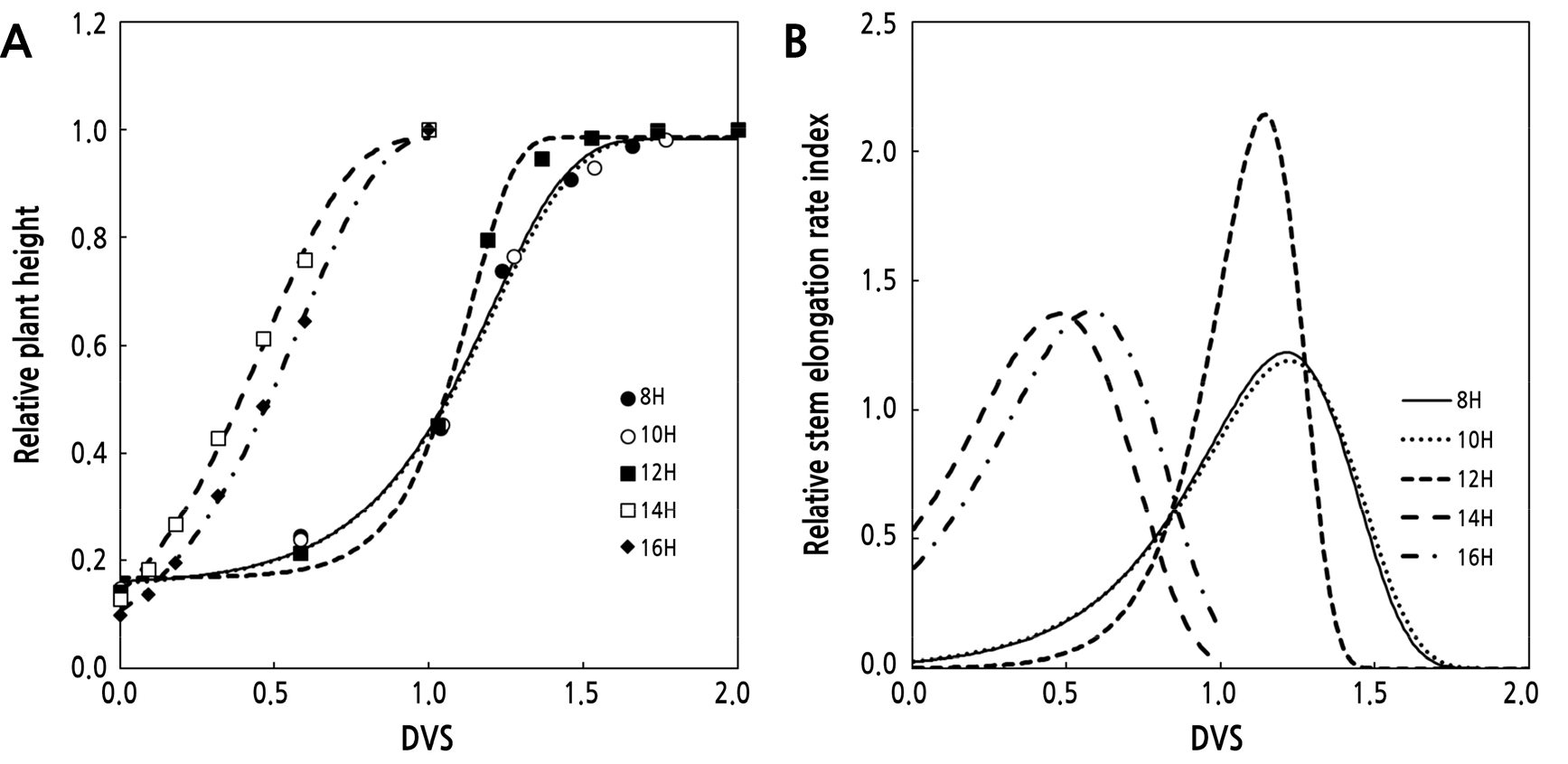
Fig. 2.
Effect of day length on relative plant height (A) and relative absolute stem elongation rate (B) of standard cut-chrysanthemum grown hydroponically under artificial lighting by fluorescent lamps. Day length imposed by lighting for 8, 10, 12, 14, and 16 hours after 16 hours long-day treatment for 23 days after planting. Axis scaling based on developmental stage [DVS; planting day set to 0.0 to to 1.0 for long day period and set from 1.0 to 2.0 for short day period and relative plant height (maximum shoot length set at 1.0). Solid lines were fitted measurement data by Gompertz growth function (A).
Table 4.
Estimated parmameters of Gompertz growth model fitted a dynamics of calculated relative plant height as a function of developmental stage and maximum relative stem elongation (MGRDVS) of standard cut-chrysanthemum ‘Baekma’ grown at different photoperiod treatments
|
Photoperiod treatmentz | Parametersy | R2 | MGRDVS | |||
| yasm.DVS | kDVS | tinf.DVS (DVS) | y0.DVS | |||
| 8H | 0.829 ± 0.081x | -4.008 ± 1.044 | 1.213 ± 0.066 | 0.154 ± 0.071 | 0.995 | 1.222 |
| 10H | 0.833 ± 0.071 | -3.883 ± 0.778 | 1.224 ± 0.071 | 0.151 ± 0.057 | 0.997 | 1.190 |
| 12H | 0.819 ± 0.065 | -7.112 ± 1.466 | 1.143 ± 0.042 | 0.167 ± 0.054 | 0.996 | 2.142 |
| 14H | 1.000 ± 0.092 | -3.730 ± 0.524 | 0.478 ± 0.054 | -0.014 ± 0.042 | 0.997 | 1.372 |
| 16H | 1.000 ± 0.108 | -3.757 ± 0.392 | 0.580 ± 0.055 | -0.001 ± 0.017 | 0.999 | 1.381 |
최대 상대 초장신장율 지수(MGRDVS)는 8H와 10H 처리구에서 각각 1.22와 1.19로 낮았고, 12H 처리구는 10H 처리구 대비 1.8배 높았고, 장일조건인 14H, 16H 처리구에서는 각각 1.37과 1.38로 높게 나타났다(Fig. 2B). 발육단계에 따른 상대초장의 초장신장패턴을 근거로 장일처리기간에는 14시간 이상의 일장을 유지하고, 단일처리 기간동안 12시간의 일장을 유지하는 것이 줄기신장율을 최대로 높게 유지할 수 있는 것으로 판단되었다. 스탠다드 절화국화 ‘백마’의 14시간 이상의 장일조건과 12시간 이하의 단일조건의 초장의 동적생육은 상이하였으며, 이는 광주기 조건에 따라 국화의 발육기간 지연유무, 화아분화유무에 따라 달라진것이다. ‘백마’는 하추국으로 일장에 의해 화아분화를 조절할 수 있는 국화이며(Shin et al., 2005), 정식 후 장일처리기간을 통해 충분한 초장 및 엽수를 확보한 뒤 단일처리를 통해 화아분화를 유도해야 하고, 국화는 단일처리 이후 화아분화 전까지는 초장의 신장이 지속적으로 이루어진다. 그러므로, 장일처리기간은 높은 상대초장신장율을 나타낸 14시간 이상의 일장을 통해 국화의 영양생장을 확보해야하며, 개화한 처리구 중 최종신장량의 차이가 보이지 않았고, 12H 처리구가 국화의 재배기간을 단축할 수 있어, ‘백마’의 단일처리시간은 12시간이 가장 적합한 것으로 판단된다.
따라서, 본 실험에서 시그모이드 함수인 Gompertz 생장모델의 최대생장량, 상대생장율과 최대줄기 신장율에 도달하는 일수의 파라미터를 이용하여 일장처리에 따른 스탠다드 국화 ‘백마’의 초장신장패턴을 묘사할 수 있었고, 각 처리구의 생장 특성을 비교할 수 있었다. 본 실험은 환경요인 중 광주기에 의한 초장의 생육패턴을 분석하였다. 반면, 작물의 생육은 다양한 환경요인 조합에 의해 영향을 받으므로 절화국화의 초장의 생육모델의 고도화는 일장과 온도조건의 조합에 따른 생육 반응연구가 추가적으로 필요할 것으로 사료된다.


