서 언
재료 및 방법
Stemphylium vesicarium 균주
배양 온도에 따른 Stemphylium vesicarium 균주의 포자 발아율
배양 온도에 따른 Stemphylium vesicarium 균주의 균사 생장
식물체 준비
접종원 준비
병원균 접종 및 발병
병 조사
결과 및 고찰
배양 온도에 따른 Stemphylium vesicarium 균주의 포자 발아율
배양 온도에 따른 Stemphylium vesicarium 균주의 균사 생장
품종에 따른 마늘의 잎마름병 발생
생육 시기에 따른 마늘의 잎마름병 발생
접종원 농도에 따른 마늘의 잎마름병 발생
발병 환경에 따른 마늘의 잎마름병 발생
포자현탁액에 첨가하는 탄소원 종류에 따른 마늘의 잎마름병 발생
서 언
마늘(Allium sativum L.)은 파를 비롯한 양파, 삼채, 부추 및 달래 등과 함께 백합과(Liliaceae), 파 속(Allium spp.)에 속하는 식물이다(Shin et al., 2004). 우리나라에서 마늘의 재배면적은 21,999ha이며, 생산량은 308,532톤을 차지한다(KOSTAT, 2021). 김치 문화가 발달한 우리나라에서는 마늘을 주된 양념 채소로 많이 이용하고 있으며(Kim et al., 2015), 항암, 혈중 지질 함량 감소, 항바이러스, 항혈전 등의 활성을 나타내는 기능성 식품소재이기도 하다(Kyung, 2006). 마늘은 영양가도 매우 높으며, 신선한 마늘에서는 단백질이 풍부하다. 그리고 껍질을 깐 마늘과 말린 마늘 가루는 칼륨, 칼슘, 마그네슘, 탄수화물 등의 영양소를 함유하며, 비타민 C 함량이 매우 높다(Nair et al., 2013).
마늘에 발생하는 병해는 여러 가지가 보고되어 있는데, 그 중 잎마름병, 녹병 및 흑색썩음균핵병은 마늘에 가장 심각한 피해를 일으키는 병해이다(Cho and Yu, 1998; Ryu et al., 2015; Hay et al., 2019). 마늘 잎마름병은 Stemphylium vesicarium에 의해 발생하는데, S. vesicarium은 마늘(A. sativum) 외에도 양파(Allium cepa), leek(Allium ampeloprasum), 파(Allium fistulosum), asparagus(Asparagus officinalis), European pear(Pyrus communis) 등 다양한 기주식물에서 병을 일으킨다(Hassan et al., 2020). 마늘 잎마름병은 마늘을 재배하는 대부분의 지역에서 발생하고 있으며, 어떤 포장에서는 마늘 잎마름병으로 인해 마늘 생산량이 약 70% 정도 감소하였다(Zheng et al., 2010). 우리나라에서는 1998년에 마늘 잎마름병이 심하게 발생하였으며, 어떤 지역에서는 약 90%의 지상부 손실이 있었다(Cho and Yu, 1998). 우리나라에서 마늘 잎마름병(leaf blight)은 전국적으로 재배 기간에 발생하고 있으며, 5월 초순부터 발생하여 수확기인 6월 중하순경 가장 심하게 발생한다. 또한, 5월에서 6월 사이의 마늘 생육 시기 중에 강우량이 많을 때 피해가 심각하다(Ryu et al., 2015). 강우량은 자낭포자와 분생포자의 대기중 농도와 직접적인 관련이 있으며, 대기중의 분생포자는 12–21°C 온도에서 쉽게 감염할 수 있다(Prados-Ligero et al., 1998; Prados-Ligero et al., 2003).
기주식물과 인공배지에서 형성된 분생포자와 자낭포자는 양파와 마늘 두 기주에서 동시에 병원성을 나타내었다(Rao and Pavgi, 1975). 마늘의 잎마름병 병징은 Alternaria porri에 의한 검은무늬병의 보랏빛 병반이 나타나는 것과 비슷하며(Cho and Yu, 1998), 잎마름병 병반은 두 가지 유형으로 나타난다. 하나는 작고 흰 병반을 보이고, 다른 하나는 수침상의 진행형 보랏빛 병반으로, 둘은 같은 잎에 함께 존재하기도 한다. 잎마름병은 잎을 따라 진행되어 괴사하는 병반이 나타나고, 병이 더 심해지면 괴사 병반이 지상부 전체로 확산되어 결국 마르게 된다(Mishra et al., 2014).
마늘 잎마름병을 방제하기 위해서는 저항성 품종을 재배하거나, 재식 밀도를 감소시키고 배수 시설을 하는 방법과 과도한 질소 비료 사용을 피하고, 살균제를 살포하는 방법 등을 사용 할 수 있다(Mishra et al., 2014; Gálvez et al., 2016). 살균제의 사용은 신속성과 효율성이 보장되지만, 지속적인 화학 농약의 사용은 환경을 악화시킬 뿐 아니라, 약제에 저항하는 병원균이 발생하는 문제를 야기시킬 수 있다. 그리고 식용하는 작물에 잔류 농약이 있어 소비 및 수출에 있어서 바람직하지 않다(Mishra and Singh, 2019). 또한, 화학적 방제는 비용이 많이 소요되므로, 오늘날 친환경적 재배를 위해서는 대안으로 저항성 품종을 활용하는 방법을 가장 선호한다(Yerasu et al., 2019; Islam et al., 2020a). 저항성 품종의 재배는 식물 병을 관리하는데 가장 안전하고 효율적인 방법이지만, 아직까지 이러한 저항성 품종의 육종 소재는 거의 알려지지 않았다(Mishra and Singh, 2019; Hassan et al., 2020; Islam et al., 2020b). 그리고 마늘의 잎마름병에 대한 저항성을 효율적으로 대량 검정할 수 있는 방법에 대한 보고도 거의 없다. 따라서, 잎마름병균에 저항성인 육종 소재 발굴과 잎마름병 저항성 품종 개발을 위한 효율적인 마늘 잎마름병 저항성 검정 체계의 확립이 필요하다.
본 연구에서는 마늘의 잎마름병 저항성 검정 방법을 확립하기 위하여, 마늘의 품종, 마늘의 생육 시기, 접종원 농도, 포자현탁액에 첨가하는 탄소원의 종류 및 접종 후 발병 환경에 따른 잎마름병 발생을 조사하였다.
재료 및 방법
Stemphylium vesicarium 균주
마늘 잎마름병원균인 S. vesicarium 균주는 농촌진흥청 농업유전자원센터(KACC, Rural Development Administration, Jeonju, Korea)로부터 KACC 44528와 KACC 44530 균주를 분양 받아 실험에 사용하였다.
배양 온도에 따른 Stemphylium vesicarium 균주의 포자 발아율
S. vesicarium 균주(KACC 44528, KACC 44530)의 포자 발아를 위한 최적 온도를 조사하기 위하여, 직경 8.5cm Petri dish에 준비한 rice bran agar[rice bran 32g, glucose(Junsei Chemical Co., Ltd.) 10g, agar(Junsei Chemical Co., Ltd.) 12g, distilled water 1L] 배지에 S. vesicarium 균주의 균사 조각을 3개씩 접종하고 25°C에서 11일 동안 암 상태에서 배양하였다. 그리고 clean bench 안에서 멸균된 붓으로 긁어주어 공중 균사를 제거한 후에 25°C 항온항습실(상대습도 80%)에서 Petri dish 뚜껑을 덮은 상태로 하루에 12시간씩 광(55µmol·m-2·s-1)을 조사하면서 48시간 동안 배양하여 포자 형성을 유도하였다.
포자가 형성된 배지 위에 멸균한 1/2 농도의 potato dextrose broth(PDB; Becton, Dickinson and Co.) 용액을 붓고 멸균한 붓과 가제를 사용하여 포자를 수확한 후에 포자 현탁액의 포자 농도를 1.0 × 104 spores/mL로 조정하였다. 직경 8.5cm Petri dish의 water agar[agar(Becton, Dickinson and Co.) 17g, distilled water 1L] 배지에 준비한 포자 현탁액 100µL 씩을 올려놓고 골고루 도말하여 접종하였다. 그리고 이들을 5가지 온도(10°C, 15°C, 20°C, 25°C, 30°C)에서 6시간 동안 배양한 후에, 발아관의 길이가 분생포자 길이의 절반 이상 자란 것을 포자가 발아한 것으로 간주하여 포자의 발아율(%)을 측정하였다. 모든 실험은 plate 당 100개의 포자를 관찰하였으며, 처리 당 3반복으로 2회 실시하였다.
배양 온도에 따른 Stemphylium vesicarium 균주의 균사 생장
S. vesicarium 균주(KACC 44528, KACC 44530)의 균사 생장을 위한 최적 온도를 조사하기 위하여, 직경 8.5cm Petri dish에 준비한 potato dextrose agar(PDA; Becton, Dickinson and Co.) 배지의 중앙에 각 균주의 균사 조각(직경 5mm)을 1개씩 올려놓고, 5가지 온도(10°C, 15°C, 20°C, 25°C, 30°C)에서 배양하였다. 접종하고 9일 동안 배양한 후에 버니어 캘리퍼스(Mitutoyo, Co. Ltd)를 이용하여 균총의 길이를 측정하고, 접종한 균사 조각의 길이(5mm)를 제외하여 균사 생장 길이를 계산하였다. 각 처리구 당 3반복씩 실험하였고, 실험은 동일한 방법으로 2회 실시하였다.
식물체 준비
대부분의 실험에서 마늘은 난지형으로 ‘대서’와 ‘남도’ 품종 그리고 한지형 마늘인 ‘의성’을 사용하였고, 원예용 상토(원예용 2호; Punong, Gyeongju, Korea)를 플라스틱 포트(직경 5.5cm, 토양 90mL)에 넣고 마늘 쪽을 파종하였다. 파종한 포트는 온실(25 ± 5°C)에서 수분을 공급하면서 재배하였으며, 마늘의 생장에 맞추어 새로운 포트(직경 6.8cm, 토양 160mL)로 이식하여 재배한 4엽기 식물체를 실험에 사용하였다.
마늘 품종에 따른 잎마름병 발생 실험은 ‘대서’와 ‘남도’ 품종은 국립원예특작과학원 파속채소연구소로부터 분양을 받았으며, ‘의성’ 품종은 시중에서 구입하여 실험에 사용하였다. 그리고 마늘의 생육 시기에 따른 잎마름병 발생 실험은 동일한 방법으로 파종하고 재배하여 준비한 2엽기, 3엽기, 4엽기 및 5엽기 식물체를 실험에 사용하였다. 이 때 재배에 소요된 기간은 품종에 따라 달랐는데, ‘대서’는 2엽기 마늘은 15일, 3엽기는 24일, 4엽기는 29일, 5엽기는 43일 내외 재배하였으며, ‘남도’는 2엽기 마늘은 21일, 3엽기는 33일, 4엽기는 40일, 5엽기는 57일 내외 재배하였다. 그리고 ‘의성마늘’은 2엽기는 28일, 3엽기는 40일, 4엽기는 54일, 5엽기는 70일 내외 재배하였다.
접종원 준비
PDA 배지에 S. vesicarium 균주(KACC 44528, KACC 44530)를 접종하고, 25°C에서 7일간 배양한 균총으로부터 균사 조각을 떼어내어 직경 8.5cm Petri dish의 rice bran agar 배지에 3조각씩 올려놓고 25°C에서 11일 동안 배양하였다. 배양한 S. vesicarium 균주의 균총을 멸균한 붓으로 긁어주고, Petri dish 뚜껑을 열어놓고 25°C 항온항습실(상대습도 80%)에서 하루에 12시간씩 광(55µmol·m-2·s-1)을 조사하면서 48시간 동안 배양하여 포자 형성을 유도하였다. 여기에 1/2 농도의 PDB 용액을 넣고 붓으로 긁어주어 포자를 수확한 뒤 4겹 가제로 걸러 병원균의 균사체를 제거하여 포자 현탁액을 준비하였다. 그리고 광학현미경(BX53F; Olympus, Tokyo, Japan)하에서 hemocytometer(Paul Marienfeld GmbH & Co.KG, Lauda-Konighofen, Germany)를 이용하여 mL 당 포자수를 조사하고 멸균수로 희석하여 접종원 농도를 3.0 × 105 spores/mL로 조정한 후에 실험에 사용하였다.
S. vesicarium 각 균주(KACC 44528, KACC 44530)의 발병 환경에 따른 잎마름병 발생 실험은 포자 현탁액을 2종류(50% PDB, Tween 20 250µg/mL)의 용액으로 위와 같은 방법으로 준비하였다. 그리고 S. vesicarium 균주들의 접종원 농도에 따른 잎마름병 발생 실험을 위해서는 각 균주의 포자 현탁액의 포자 농도를 1.0 × 104, 3.0 × 104, 1.0 × 105, 3.0 × 105, 1.0 × 106 spores/mL가 되도록 준비하였다.
병원균 접종 및 발병
마늘 식물체에 준비한 S. vesicarium 각 균주(KACC 44528, KACC 44530)의 포자 현탁액을 접종하기 직전에 탈색된, 비흡수성 재질의 솜으로 마늘의 잎을 문지른 후(Shishkoff and Lorbeer, 1989), 스프레이를 사용하여 포자 현탁액이 흘러내리기 직전까지 분무 접종하였다. 병원균을 접종한 마늘 유묘는 20°C 습실상에서 48시간 습실 처리한 후에 식물체를 항온항습실(25°C, 상대습도 80%)로 이동하여 하루에 12시간씩 광(55µmol·m-2·s-1)을 조사하면서 재배하였다.
접종 후 발병 환경에 따른 마늘의 잎마름병 발생 실험을 위해서는 접종한 식물체를 20°C 혹은 25°C 습실상에서 48시간 습실 처리한 후에 20°C 혹은 25°C의 항온항습실(상대습도 80%)로 이동하여 하루에 12시간씩 광(55µmol·m-2·s-1)을 조사하면서 재배하였다.
병 조사
마늘의 생육 시기별 잎마름병 발생 실험을 제외한 모든 실험은 잎마름병균 접종 7일 후에, 접종한 1, 2, 3엽을 대상으로 마늘 잎에 발생한 잎마름병의 병반면적율(%) 즉, 잎 전체 면적 중 잎마름병이 발생한 잎의 면적의 백분율을 달관조사하고 평균값을 계산하였다. 병반면적율(%)은, 그리고 마늘 식물체의 생육 시기 별 잎마름병 발생은 2엽기 마늘 식물체는 1엽을, 3엽기 식물체는 1엽과 2엽을, 4엽기 식물체는 1엽부터 3엽까지를 그리고 5엽기 식물체는 1엽부터 4엽까지 잎에 발생한 병반면적율을 조사하고 평균값을 계산하였다.
모든 실험은 5반복씩 2회 수행하였으며, 처리 평균간 비교를 위하여 Duncan’s multiple range test(p < 0.05)를 실시하였다.
결과 및 고찰
배양 온도에 따른 Stemphylium vesicarium 균주의 포자 발아율
S. vesicarium 균주의 포자 발아를 위한 최적 온도를 조사하기 위하여 KACC 44528와 KACC 44530 균주를 사용하여 10°C, 15°C, 20°C, 25°C, 30°C에서 6시간 배양하고 포자 발아율을 조사한 결과, 두 균주 모두 온도에 따른 포자 발아율은 거의 유사한 경향을 나타내었다(Fig. 1). 20°C에서 두 균주 모두 실험한 온도 중 가장 높은 포자 발아율을 보였는데, KACC 44528의 포자 발아율은 53%이었고 KACC 44530은 50%이었다(Fig. 1). 그리고 다음은 25°C, 30°C, 15°C, 10°C 순이었다. 20–30°C에서 배양하였을 때에는 두 균주 모두 45% 이상의 포자 발아율을 보였으나, 10–15°C에서는 두 균주 모두 30% 이하의 낮은 포자 발아율을 보일 뿐이었다(Fig. 1). S. vesicarium 2개 균주 모두 20°C에서 포자의 발아율이 가장 높으므로, 이 온도를 S. vesicarium 포자가 발아하는데 최적인 온도로 생각되었다.
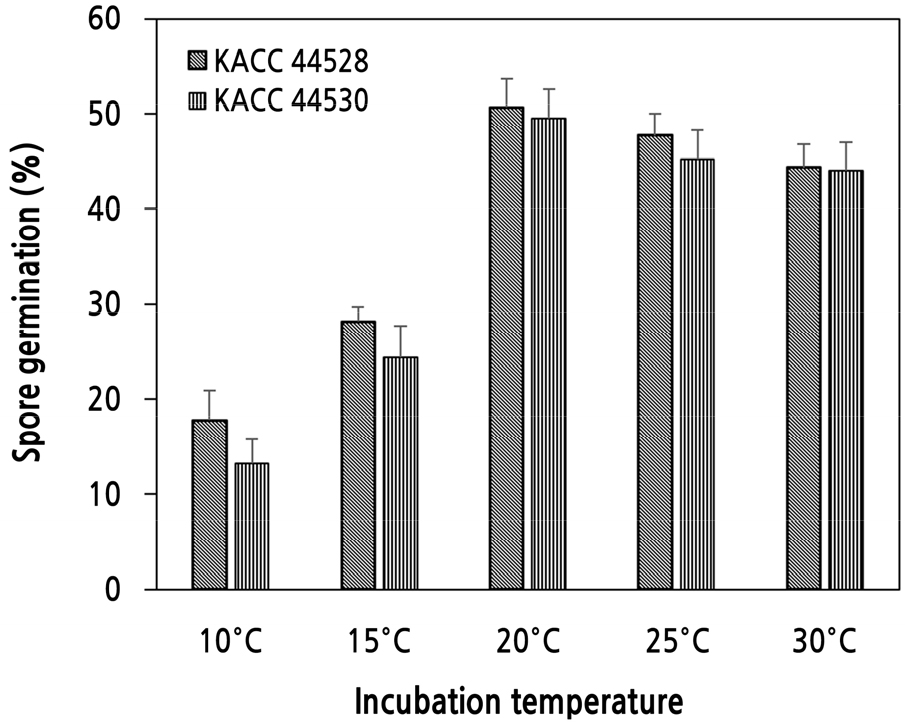
Fig. 1.
Effect of incubation temperature on spore germination of Stemphylium vesicarium KACC 44528 and KACC 44530. A spore suspension (100 µL) of each isolate at a concentration of 1.0 × 104 spores/mL was loaded on water agar and spread. The plate was incubated in darkness at 10°C, 15°C, 20°C, 25°C and 30°C. After 6 hours, the number of germinated spores was counted and percent spore germination was calculated. Each value represents the mean spore germination (%) ± standard deviation of two runs with three replicates each.
Montesinos and Vilardell(1992)는 스페인에서 배에 갈색점무늬병을 일으키는 S. vesicarium 6개 균주의 포자 발아율을 5°C부터 35°C까지 5°C 간격으로 실험한 결과 최적 온도는 20–30°C였으며, 이들 온도 구간에서 발아율에 거의 차이가 없었다고 하였다. 따라서 배에 갈색점무늬병을 일으키는 S. vesicarium 균주와 마늘에 잎마름병을 일으키는 S. vesicarium 균주 간에 포자 발아를 위한 적온은 차이가 없음을 알 수 있었다.
배양 온도에 따른 Stemphylium vesicarium 균주의 균사 생장
S. vesicarium의 균사 생장을 위한 최적 온도를 조사하기 위하여 KACC 44528과 KACC 44530 균주를 접종하고 10°C, 15°C, 20°C, 25°C, 30°C에서 배양한 후 균사 생장을 조사한 결과, 포자 발아와 마찬 가지로 두 균주 모두 배양 온도에 따른 균사 생장은 유사한 경향을 나타냈다(Fig. 2). 실험한 온도 중 20°C에서 균사 생장이 가장 좋았는데, 20°C에서 배양하였을 때 KACC 44528의 균사 생장 길이는 54 mm였으며, KACC 44530은 55 mm이었다(Fig. 2). 그리고 다음은 25°C, 15°C, 10°C, 30°C 순이었다. 20–25°C에서 배양하였을 때에는 S. vesicarium 두 균주 모두 50 mm 이상 생장했으나, 10°C와 30°C에서는 32 mm 이하로 자랐을 뿐이었다.
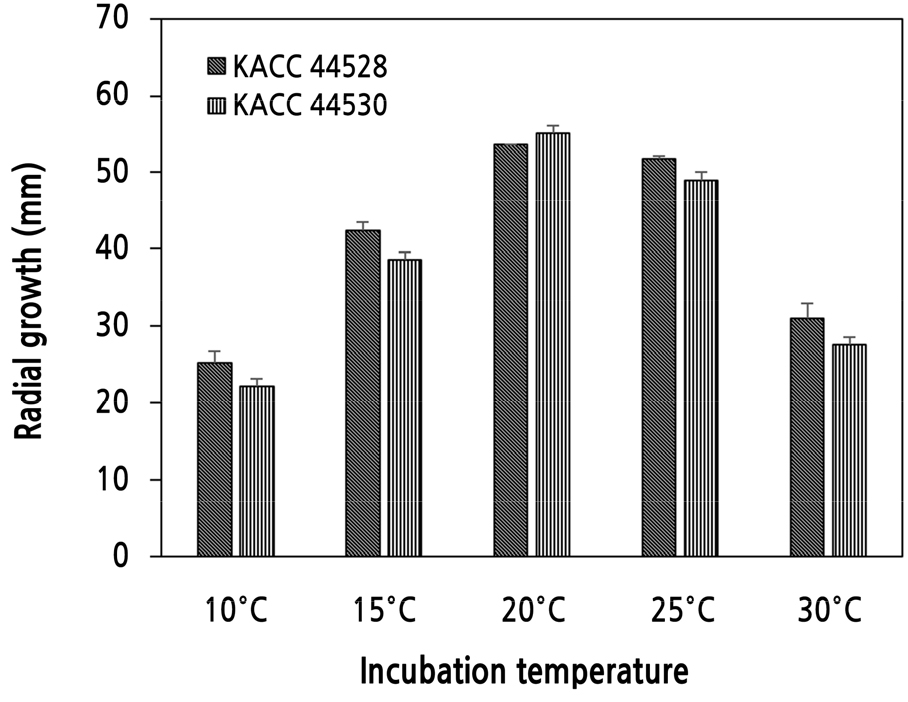
Fig. 2.
Effect of incubation temperature on mycelial growth of Stemphylium vesicarium KACC 44528 and KACC 44530. A mycelial plug (5 mm) of each isolate was inoculated on PDA plate and incubated at 10°C, 15°C, 20°C, 25°C, and 30°C. After 9 days, the diameter of radial growth was measured. Each value represents the mean radial growth ± standard deviation of two runs with three replicates each.
KACC 44528과 KACC 44530 두 균주 모두 포자 발아 실험과 달리 15°C에서 배양했을 때에는 30°C에서 보다 더 많이 생장했다(Figs. 1 and 2). 즉, S. vesicarium의 포자 발아를 위해서는 30°C의 고온이 15°C 저온보다 더 좋고, 균사 생장을 위해서는 15°C의 저온이 30°C의 고온보다 더 적합한 것으로 생각되었다.
이상의 결과로부터 S. vesicarium의 포자 발아와 균사 생장은 20°C에서 가장 좋고 그 다음은 25°C이었다(Figs. 1 and 2). Montesinos and Vilardell(1992)는 스페인에서 배에 갈색점무늬병을 일으키는 S. vesicarium 6개 균주의 균사 생장을 5°C부터 35°C까지 5°C 간격으로 실험한 결과, 균주 간에 거의 차이가 없었으며 5°C와 35°C에서는 균사 생장이 거의 일어나지 않았고, 균사 생장을 위한 최적 온도는 20°C였으며 15–25°C에서 균사가 잘 자랐다고 보고하였는데, 이는 우리의 마늘 잎마름병을 일으키는 S. vesicarium 균주의 결과와 일치하였다.
품종에 따른 마늘의 잎마름병 발생
난지형 마늘인 ‘대서’와 ‘남도’ 그리고 한지형 마늘인 ‘의성’ 품종의 잎마름병 발생 정도를 조사하기 위하여 S. vesicarium KACC 44528과 KACC 44530 균주를 각각 접종하고 잎마름병 발생을 조사한 결과, S. vesicarium 두 균주는 거의 같은 경향을 보였으며, 실험한 품종 중 ‘대서’에서 가장 많은 잎마름병이 발생하였고, 그 다음은 ‘남도’이었으며 ‘의성’에서는 잎마름병이 가장 적게 발생하였다(Fig. 3).
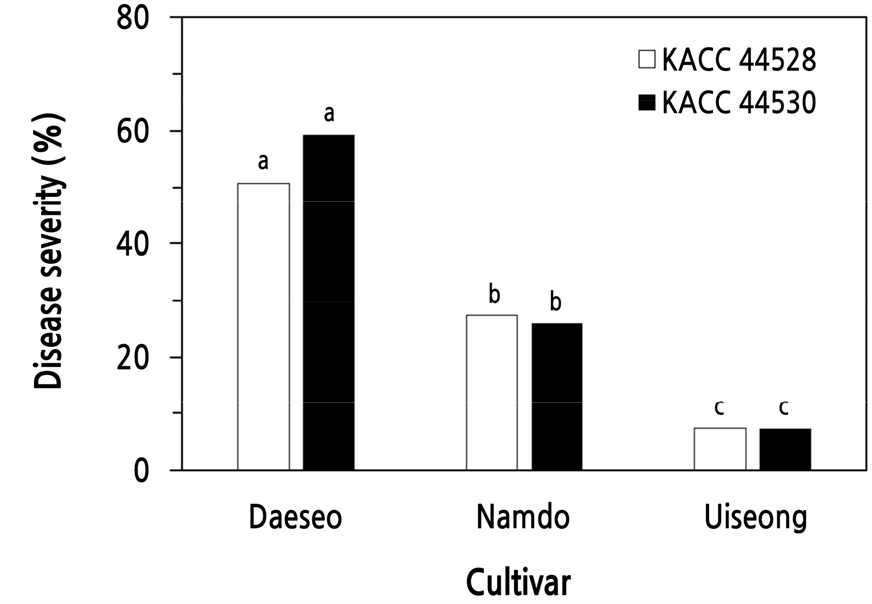
Fig. 3.
Development of leaf blight on three garlic cultivars inoculated with Stemphylium vesicarium KACC 44528 and KACC 44530. Seedlings with four leaves were inoculated with a spore suspension (3.0 × 105 spores/mL) of S. vesicarium by the spray method. The plants were incubated in a humidity chamber at 20°C for 48 hours and then transferred to a growth chamber at 25°C and 80% RH with a 12-h light/dark cycle. The percent disease severity of the plants was measured 7 days after inoculation. Each value represents the mean disease severity of two runs with five replicates each. Values labeled with the same letter within each isolate are not significantly different based on Duncan’s multiple range test at p < 0.05.
KACC 44528 균주를 접종하고 7일 후에 ‘대서’ 품종은 세 품종 중 가장 높은 51%의 병반면적율을 나타냈으며, ‘남도’ 품종은 27%의 병반면적율을 보였다. 하지만 ‘의성’ 품종은 7%의 가장 낮은 병반면적율을 보일 뿐이었다(Fig. 3). 한편, KACC 44530 균주를 접종하였을 때에도 마찬가지로 ‘대서’ 품종은 59%의 가장 높은 병반면적율을 나타냈으며, ‘남도’ 품종은 26%의 병반면적율을 보였다. 그리고 ‘의성’ 품종에서는 가장 낮은 7%의 병반면적율을 나타내었다(Fig. 3).
국내에서 재배되는 마늘은 생태형에 따라 난지형 마늘과 한지형 마늘로 구분한다. 난지형마늘은 무안, 고흥, 남해, 해남 등이 주산지로 77%를 차지하고, 한지형 마늘은 의성, 단양, 서산이 등이 주산지로 23%를 차지한다(Jeong et al., 2009). 난지형 마늘은 한지형 마늘에 비하여 휴면기간이 짧으며, 파종 후에 어느 정도 자란 후 월동하며, 단위면적당 수확량이 많다(Kim et al., 2015). 본 연구에서 난지형 마늘 품종인 ‘대서’와 ‘남도’가 한지형 품종인 ‘의성’ 품종보다 잎마름병 발생이 많았다. 모든 한지형 마늘이 잎마름병에 대하여 더 저항성인지는 더 많은 품종을 확보하여 확인할 필요가 있다. 하지만 우리나라에서 널리 재배하는 ‘대서’와 ‘남도’ 품종이 잎마름병에 대하여 높은 감수성을 나타내므로 이들 품종을 재배하는 농가에서는 잎마름병 방제에 특별히 더 주의를 기울일 필요가 있다고 생각되었다.
생육 시기에 따른 마늘의 잎마름병 발생
마늘의 생장 정도에 따른 잎마름병 발생을 조사하기 위하여 ‘대서’, ‘남도’ 및 ‘의성’ 품종의 2, 3, 4, 5엽기 식물체에 S. vesicarium KACC 44528과 KACC 44530 균주를 각각 접종하고 잎마름병 발생을 조사한 결과, ‘대서’와 ‘남도’ 모두에서 S. vesicarium 균주에 관계없이 5엽기 마늘에서 가장 잎마름병이 많이 발생하였고, 그 다음은 4엽기, 3엽기, 2엽기 순이었으며 가장 어린 식물체인 2엽기에서 잎마름병 발생이 가장 적었다(Fig. 4).
‘대서’ 마늘은 접종 7일 후에 병반면적율(%)을 조사하였을 때, 실험한 마늘의 생육 시기 중 5엽기에서 KACC 44528를 접종하였을 때에는 가장 높은 59%의 병반면적율을 보여 잎마름병이 가장 많이 발생하였고, 그 다음은 4엽기로 49%, 3엽기일 때는 41% 이였다(Fig. 4A). 2엽기 마늘은 10%의 병반면적율을 보여 실험한 4가지 생육 시기 중 잎마름병 발생이 가장 적었다. 그리고 KACC 44530 균주를 접종하였을 때에도 유사한 경향을 나타내었다(Fig. 4B).
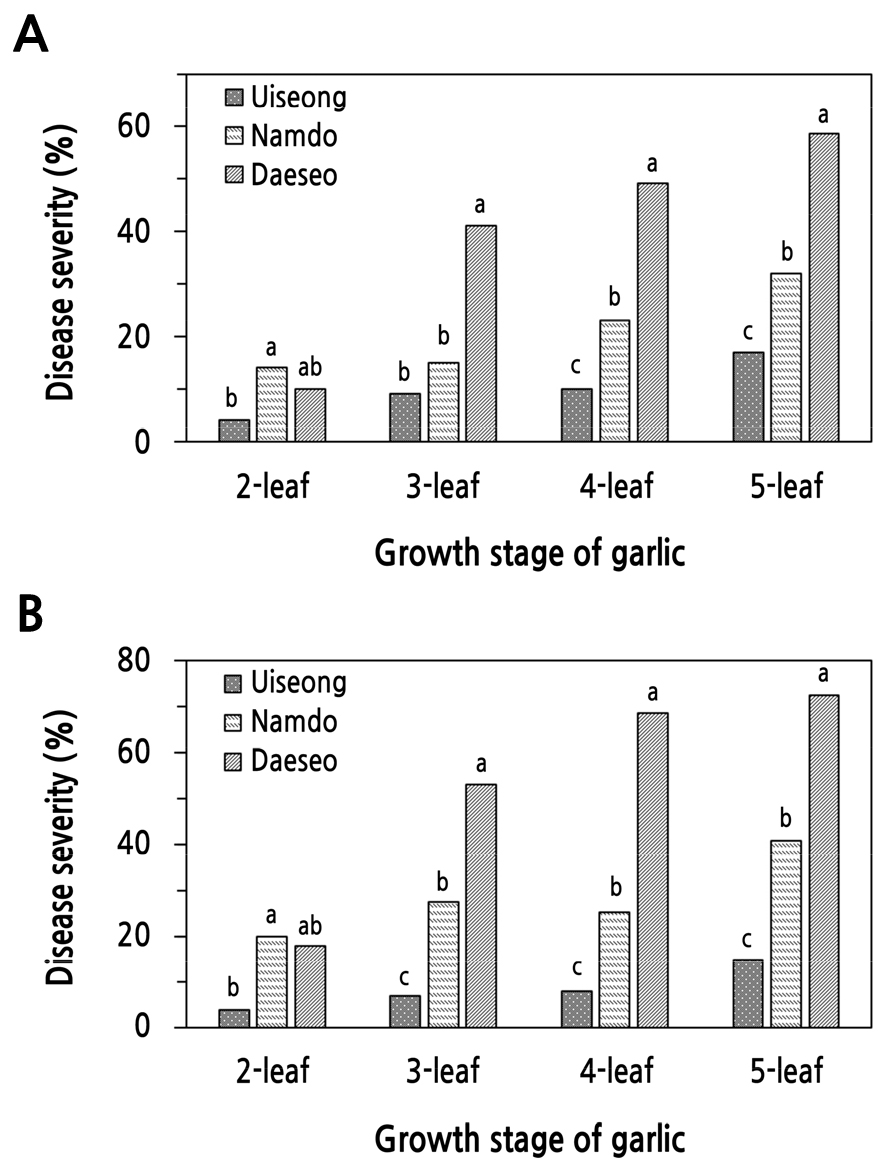
Fig. 4.
Development of leaf blight on garlic cultivars caused by Stemphylium vesicarium KACC 44528 (A) and KACC 44530 (B) according to the plant growth stage. Seedlings of each garlic cultivar at 2-, 3-, 4- and 5-leaf stages were inoculated with a spore suspension (3.0 × 105 spores/mL) of S. vesicarium by the spray method. The plants were incubated in a humidity chamber at 20°C for 48 hours and then transferred to a growth chamber at 25°C and 80% RH with a 12-h light/dark cycle. The percent disease severity of the plants was measured 7 days after inoculation. Each value represents the mean disease severity of two runs with five replicates each. Values labeled with the same letter within each growth stage are not significantly different based on Duncan’s multiple range test at p < 0.05.
‘남도’ 마늘은 실험한 생육 시기 중 두 균주 모두 5엽기일 때 KACC 44528 균주는 32%의 병반면적율을 보여 잎마름병이 가장 많이 발생하였고, 그 다음은 4엽기 마늘로 23%의 병반면적율을 그리고 3엽기 마늘은 15%의 병반면적율을 보였다(Fig. 4A). 실험한 생육 시기 중 2엽기 마늘은 14%의 병반면적율을 보여 실험한 네 가지 생육 시기 중 잎마름병 발생이 가장 적었다. 한편, ‘의성’ 마늘도 생육 시기가 증가함에 따라 증가하였으나, 가장 잎마름병 발생이 많은 5엽기에서도 17% 이하의 병반면적율을 나타낼 뿐이었다. 그리고 ‘남도’와 ‘의성’에 KACC 44530 균주를 접종하였을 때에도 유사한 경향을 나타내었다(Fig. 4B).
이상의 결과로부터 마늘의 생육 시기에 따른 잎마름병 발생은 품종에 관계없이 모두 생육 시기가 증가함에 따라 잎마름병 발생은 증가하였다. 실험한 마늘의 생육 시기 중 5엽기에서 잎마름병이 가장 많이 발생하였다. 하지만 마늘 조각을 파종하여 5엽기로 재배하기 위해서는 ‘대서’ 기준으로 약 43일 소요되어 실험 준비 기간이 매우 길다. 하지만 4엽기 식물체로 재배하기 위해서는 약 29일이 소요되어 실험 기간을 줄일 수 있고, 4엽기와 5엽기에 접종하였을 때 둘 다 세 가지 품종들의 병반멱적율이 통계적으로 유의성 있는 차이를 잘 나타내었다. 따라서 마늘의 잎마름병에 대한 저항성 검정은 4엽기 식물체를 사용하여 실험하는 것이 효과적일 것으로 생각되었다.
S. vesicarium에 의한 배의 갈색점무늬병은 오래된 잎보다 어린 잎이 훨씬 더 감수성이 크다고 보고 하였다(Montesinos et al., 1995a; Llorente et al., 2012). 이와 달리, 본 연구에서는 생육 시기가 더 높은 마늘 식물체에 잎마름병 발생이 많을 뿐만 아니라(Fig. 4), 어린 잎보다 오래된 잎이 더 높은 감수성을 보였다(결과 미제시). 이와 같은 이유로 마늘 식물체에서 잎마름병 발생을 조사할 때 5엽기 식물체의 가장 어린 잎인 5엽에서는 거의 잎마름병이 발생하지 않아 1–4엽까지 병반면적율은 조사하였으며, 마찬가지로 4엽기 식물체의 병반면적율은 1–3엽까지, 3엽기 식물체의 병반면적율은 1–2엽까지 조사하였다. 따라서 S. vesicarium은 기주의 생육 시기에 따른 병 발생은 기주에 따라 다르며, 이와 같은 차이가 나타나는 이유에 대해서는 연구가 더 필요하겠다.
접종원 농도에 따른 마늘의 잎마름병 발생
접종하는 S. vesicarium 포자 농도에 따른 잎마름병 발생을 조사하기 위하여 3개 마늘 품종에 KACC 44528과 KACC 44530 균주들의 포자 농도를 각각 1.0 × 104, 3.0 × 104, 1.0 × 10⁵, 3.0 × 10⁵, 1.0 × 106 spores/mL로 접종하고 잎마름병 발생을 조사한 결과, 실험한 마늘 품종들은 S. vesicarium 두 균주 모두, 접종하는 포자 농도가 증가할수록 잎마름병 발생이 많았다(Fig. 5). 그리고 접종한 S. vesicarium 농도에 따른 잎마름병 발생 정도의 차이는 세 가지 마늘 품종 중 ‘대서’에서 가장 컸으며, ‘남도’는 중간 정도 이었고 ‘의성’은 가장 적은 차이를 나타냈다(Fig. 5).
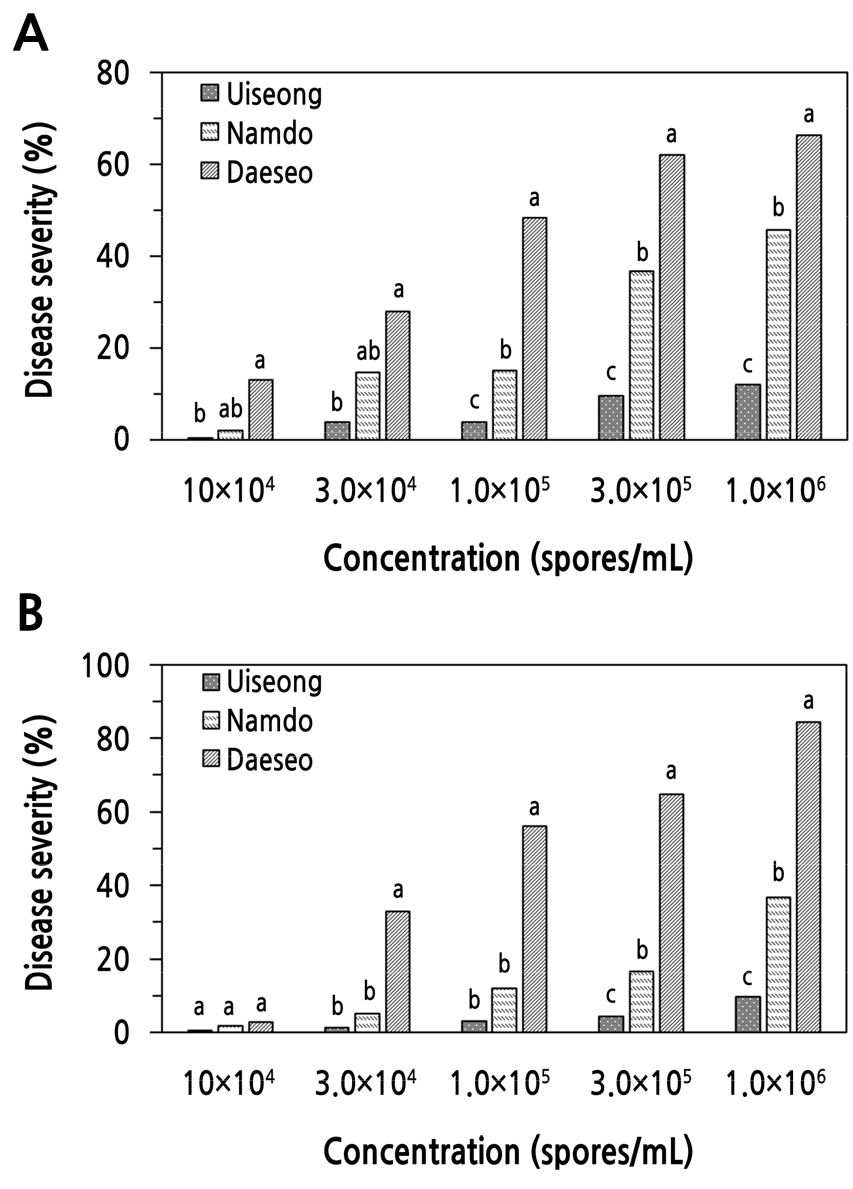
Fig. 5.
Development of leaf blight on garlic cultivars caused by Stemphylium vesicarium KACC 44528 (A) and KACC 44530 (B) according to the concentration of the spore suspension. Seedlings with four leaves were inoculated with a spore suspension of S. vesicarium at a concentration of 1.0 × 104, 3.0 × 104, 1.0 × 105, 3.0 × 105, and 1.0 × 106 spores/mL by the spray method. The plants were incubated in a humidity chamber at 20°C for 48 hours and then transferred to a growth chamber at 25°C and 80% RH with a 12-h light/dark cycle. The percent disease severity of the plants was measured 7 days after inoculation. Each value represents the mean disease severity of two runs with five replicates each. Values labeled with the same letter within each spore concentration are not significantly different based on Duncan’s multiple range test at p < 0.05.
KACC 44528 균주를 접종하고 잎마름병 발생을 조사하였을 때, ‘대서’는 가장 높은 농도인 1.0 × 106 spores/mL 접종구에서 가장 높은 66%의 병반면적율을 보였고, 3.0 × 10⁵ spores/mL 처리구는 62%, 1.0 × 10⁵ spores/mL 처리구에서는 48%, 3.0 × 104 spores/mL 처리구는 28%의 병반면적율을 나타냈다. 그리고 가장 낮은 농도인 1.0 × 104 spores/mL 처리구에서는 13%의 병반면적율을 보일 뿐이었다(Fig. 5A). 또한 ‘남도’도 가장 높은 농도인 1.0 × 106 spores/mL 접종구에서는 가장 높은 46%의 병반면적율을 나타내었고, 3.0 × 10⁵ spores/mL 농도 접종구는 37%, 1.0 × 10⁵ spores/mL와 3.0 × 104 spores/mL 처리구에서는 15%의 병반면적율을 보였다(Fig. 5A). 가장 낮은 포자 농도 처리구인 1.0 × 104 spores/mL에서는 2%의 낮은 병반면적율을 보였다.
한편, ‘의성’ 마늘도 접종 농도가 증가함에 따라 증가하였으나, 가장 높은 접종 농도 처리구에서도 12%의 병반면적율을 나타낼 뿐이었다. 그리고 3개 마늘 품종에 KACC 44530 균주를 접종하였을 때에도 접종 농도가 증가함에 따라 잎마름병 발생이 증가하는 경향을 나타내었다(Fig. 5B). 한편, 실험한 S. vesicarium의 접종 농도 중 1.0 × 106 spores/mL 처리구에서 잎마름병이 가장 많이 발생하였으나, 마늘의 잎마름병에 대한 저항성 대량 검정을 위해서는 3.0 × 105 spores/mL 접종구와 1.0 × 106 spores/mL 처리구의 잎마름병 발생이 큰 차이를 보이지않았고(Fig. 5), 두 접종 농도로 접종하였을 때 모두 세 가지 품종들의 병반면적율이 통계적으로 유의성 있는 차이를 나타내었다. 따라서 잎마름병 대량 검정을 위해서는 S. vesicarium 포자(접종원)를 대량으로 준비해야 하는 점을 고려할 때, S. vesicarium의 접종 농도를 3.0 × 10⁵ spores/mL로 하는 것이 효율적이라고 생각되었다.
식물병원균에 의한 병해의 발생 정도는 감수성 품종에서는 대부분 접종 농도에 비례하여 증가한다. 하지만 저항성 품종에서는 저항성 종류에 따라 두 가지 반응을 나타내는데, 멜론 덩굴쪼김병과 토마토 시들음병 등 질적 저항성의 경우 접종원 농도에 거의 영향을 받지않았다(Park et al., 2012; Lee et al., 2015). 반면에 고추 역병, 고추 풋마름병, 양배추 뿌리혹병 등 양적 저항성의 경우에는 대부분 접종원 농도가 증가함에 따라 저항성 품종에서 병 발생이 증가하였다(Jo et al., 2014; Jo et al., 2016; Hwang et al., 2017; Lee et al., 2018). 본 연구의 ‘의성’ 마늘은 S. vesicarium 접종 농도 농도가 증가함에 따라 증가하여, 양적 저항성으로 생각되었다. 하지만 이는 다양한 연구를 통해 더 확인하는 것이 필요하다.
발병 환경에 따른 마늘의 잎마름병 발생
발병 환경에 따른 마늘의 잎마름병 발생을 조사하기 위하여 세 가지 품종의 마늘 유묘에, 2가지 용액(20% PDB, 250µg·mL-1 Tween 20)으로 제조한 S. vesicarium KACC 44528과 KACC 44530 균주의 포자현탁액을 접종하고 20°C 혹은 25°C에서 48시간 동안 습실처리한 후에 20°C 혹은 25°C 항온항습실(상대습도 80%)에서 재배하여 잎마름병 발생을 조사한 결과, 모든 마늘 품종은 S. vesicarium 균주들의 포자현탁액에 Tween 20을 첨가하였을 때보다 PDB를 첨가하였을 때 잎마름병 발생이 크게 증가하였다(Fig. 6). 따라서 마늘의 잎마름병 발생을 위해서는 멸균한 50% PDB 용액을 사용하여 S. vesicarium 포자현탁액을 준비하는 것이 더 효과적이라고 생각되었다.
그리고 PDB 용액으로 준비한 S. vesicarium KACC 44528과 KACC 44530의 포자 현탁액을 접종하였을 때, ‘대서’와 ‘남도’ 마늘 모두 20°C 습실상에서 습실처리하고 25°C 항온항습실로 이동하여 재배하였을 때 잎마름병이 가장 많이 발생하였으며, 그 다음은 25°C 습실상에서 습실 처리하고 25°C 항온항습실에서 재배하는 것이었다(Fig. 6). 20°C 습실상에서 습실처리하고 20°C 항온항습실에서 재배하였을 때는 잎마름병 발생이 가장 적었다(Fig. 6). 한편, ‘의성’ 마늘에서도 유사한 경향을 나타내었으나 환경 조건에 따른 잎마름병 발생 정도의 차이는 매우 작았다(Fig. 6).
‘대서’ 마늘에 KACC 44528 균주의 PDB로 제조한 포자현탁액을 접종하고 20°C에서 습실 처리하고 25°C 항온항습실에서 재배하였을 때에 가장 높은 59%의 병반면적율을 보였으며, 25°C에서 습실처리하고 25°C 항온항습실에서 재배하였을 때에는 56%의 병반면적율을 그리고 20°C에서 습실처리하고 20°C 항온항습실에서 재배한 경우에는 가장 낮은 33%의 병반면적율을 보였다(Fig. 6A). 한편, ‘남도’ 마늘에서는 20°C에서 습실처리하고 25°C에서 재배하였을 때에 가장 높은 25%의 병반면적율을 보였으며, 25°C에서 습실처리하고 25°C에서 재배하였을 때에는 24%의 병반면적율을, 20°C에서 습실처리하고 20°C에서 재배한 경우에는 가장 낮은 21%의 병반면적율을 보였다(Fig. 6A). 그리고 KACC 44530 균주도 ‘대서’와 ‘남도’ 마늘에서 KACC 44528 균주와 유사한 경향을 보였다(Fig. 6B).
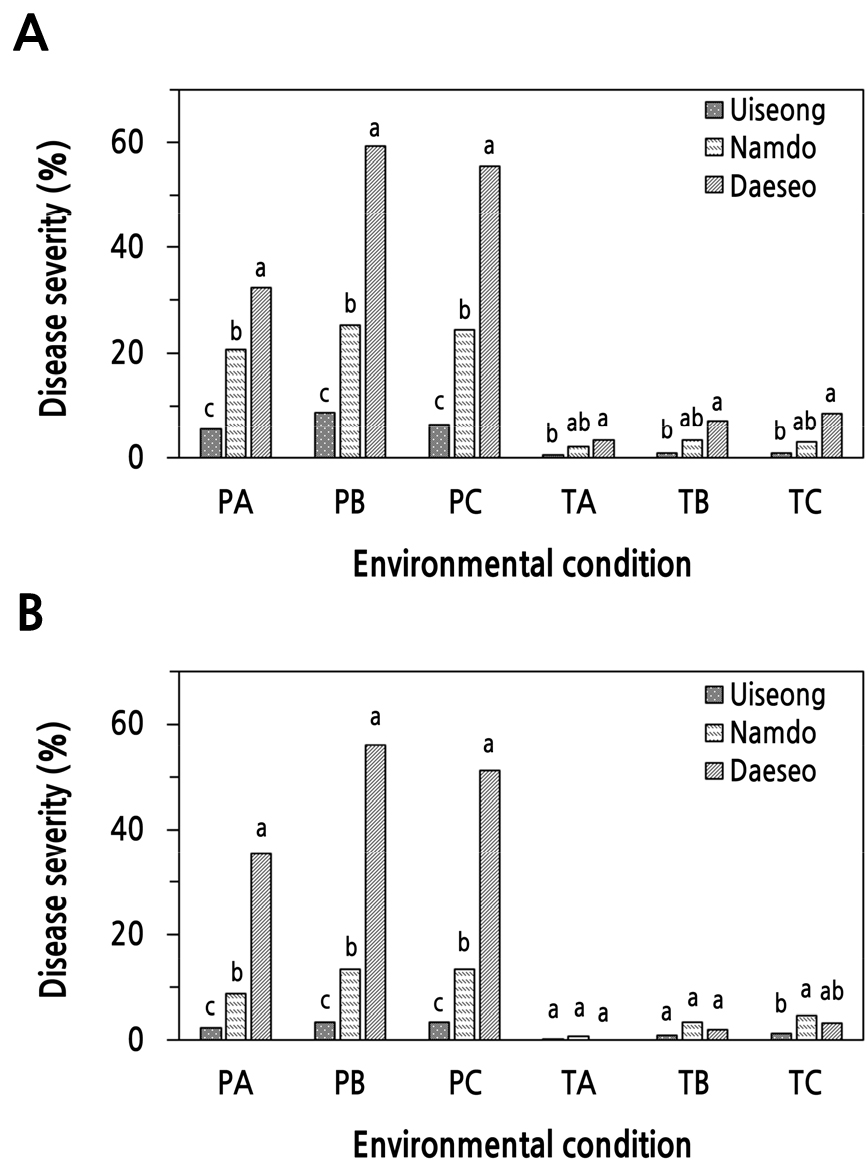
Fig. 6.
Development of leaf blight on garlic cultivars caused by Stemphylium vesicarium KACC 44528 (A) and KACC 44530 (B) according to environmental conditions. Seedlings with four leaves were inoculated with a spore suspension of S. vesicarium at a concentration of 3.0 × 105 spores/mL by the spray method. The spore suspension of the isolates was composed of 1/2 potato dextrose broth (PA, PB, PC) or 250 µg/mL Tween 20 (TA, TB, TC) solutions. The inoculated plants were incubated in a humidity chamber at 20°C (PA, PB, TA, TB) or 25°C (PC, TC) for 48 hours and then transferred to a growth chamber at 20°C (PA, TA) or 25°C (PB, PC, TB, TC) and 80% RH with a 12-h light/dark cycle. The percent disease severity of the plants was measured 7 days after inoculation. Each value represents the mean disease severity of two runs with five replicates each. Values labeled with the same letter within each environmental condition are not significantly different based on Duncan’s multiple range test at p < 0.05. P, potato dextrose broth; T, Tween 20; A, humidity chamber (20°C) and growth chamber (20°C); B, humidity chamber (20°C), growth chamber (25°C); C, humidity chamber (25°C) and growth chamber (25°C).
여러 기주에서 S. vesicarium에 의한 병 발생은 상대습도 및 잎의 수분 지속시간이 결정적이라고 보고되어 있다(Falloon et al., 1987; Shishkoff and Lorbeer, 1989; Montesinos and Vilardell, 1992; Basallote-Ureba et al., 1999; Suheri and Price, 2000; Llorente and Montesinos, 2002). 그리고 Prados-Ligero et al.(2003)은 마늘의 잎마름병 발생에서 강우의 중요성을 보고하며 강우가 없을 때는 상대습도와 밀접한 관련이 있다고 하였다. 또 S. vesicarium이 배의 잎과 열매를 감염할 때 중요한 환경 요인으로 25°C 및 30°C의 온도와 잎의 습도 지속시간을 제시하였다(Montesinos and Vilardell, 1992; Montesinos et al., 1995b). 이와 달리, 본 연구의 마늘의 잎마름병 발생을 위해서는 S. vesicarium의 포자현탁액을 접종하고 20°C 습실상에서 48시간 습실처리하고 25°C 항온항습실(상대습도 80%)로 이동하여 재배하였을 때 잎마름병이 가장 많이 발생하였다. 이는 마늘 잎마름병균의 포자 발아와 균사 생장 적온은 20°C이기 때문에(Figs. 1 and 2), S. vesicarium의 포자가 발아하고 초기 생장이 이루어지는 기간인 접종 후 습실 처리를 20°C에서 하는 것이 잎마름병 발생을 촉진하였을 것으로 생각되었다.
포자현탁액에 첨가하는 탄소원 종류에 따른 마늘의 잎마름병 발생
‘대서’ 마늘 식물체에 S. vesicarium KACC 44530 균주의 포자현탁액에 첨가하는 6가지 탄소원(glucose, fructose, galactose, sucrose, maltose, lactose) 종류에 따른 잎마름병 발생을 50% PDB와 Tween 20(250µg/mL)를 대조구로 하여 실험한 결과, 50% PDB 용액으로 제조한 포자 현탁액 접종구는 가장 높은 74%의 병반면적율을 보였고, 6가지 탄소원을 함유한 포자현탁액을 접종하였을 때에는 탄소원 종류에 따라 10–28%의 병반면적율을 보였다(Fig. 7). 하지만 Tween 20 250µg/mL 용액으로 준비한 포자 현탁액 접종구는 8%의 병반면적율을 나타냈을 뿐이었다.
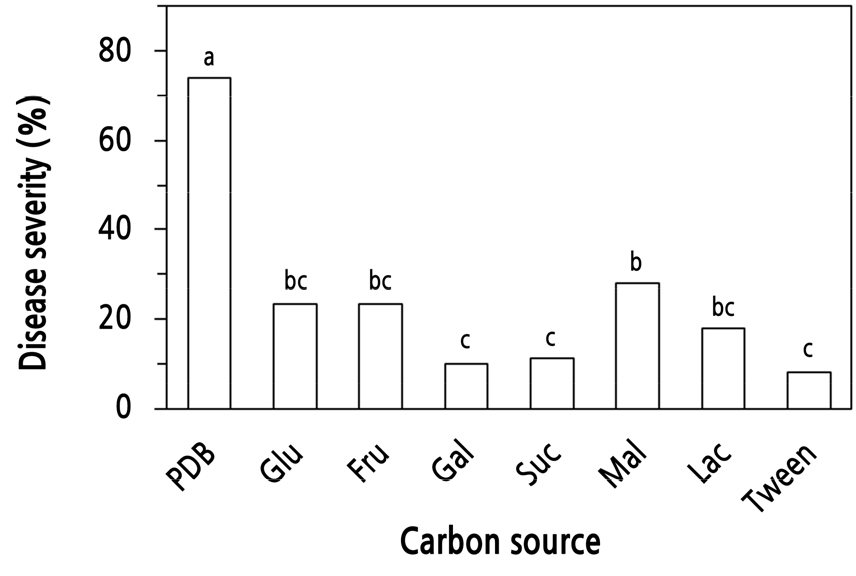
Fig. 7.
Development of leaf blight on garlic cultivar ‘Daeseo’ caused by Stemphylium vesicarium KACC 44530 according to the carbon source contained in the spore suspension. Seedlings with four leaves were inoculated with S. vesicarium by spraying the spore suspension (3.0 × 105 spores/mL) of the fungus made of 1/2 potato dextrose broth (PDB), 1% glucose (Glu), 1% fructose (Fru), 1% galactose (Gal), 1% sucrose (Suc), 1% maltose (Mal), 1% lactose (Lac) and 250 µg/mL Tween 20 (Tween). The plants were incubated in a humidity chamber at 20°C for 48 hours and then transferred to a growth chamber at 25°C and 80% RH with a 12-h light/dark cycle. The percent disease severity of the plants was measured 7 days after inoculation. Each value represents the mean disease severity of two runs with five replicates each. Values labeled with the same letter within each isolate are not significantly different based on Duncan’s multiple range test at p < 0.05.
S. vesicarium의 포자현탁액에 영양분 첨가에 의한 마늘 잎마름병 발생 촉진 효과와 그 기작에 대한 보고는 거의 없었다. 하지만, Botrytis cinerea에 의한 잿빛곰팡이병 발생에서 B. cinerea 포자현탁액에 첨가하는 영양분의 효과에 관해서는 많은 보고가 있었다(Clark and Lorbeer, 1977; Katsumi et al., 1981; Shirane and Watanabe, 1985; Katsumi et al., 1987; Son et al., 2001). Clark and Lorbeer(1977)는 살균수로 수확한 B. cinerea 포자현탁액을 양파 잎에 분무 접종 하였을 때에는 병이 거의 발생하지않았으나, 복합 영양원(50% Czapek-Dox broth, 0.05% yeast extract)을 첨가하였을 때는 병반수가 85개로 병 발생이 크게 증가하였다고 하였다. 그러나 0.5% glucose 만을 첨가하였을 때에는 우리의 결과와 마찬가지로 복합 영양원 첨가에 비하여 병 발생이 감소하여 병반수가 5개 뿐이었다. 또한, Shirane and Watanabe(1985)도 딸기 잎에 살균수로 제조한 B. cinerea 포자현탁액을 접종하였을 때는 잿빛곰팡이병이 전혀 생기지않았으나, 포자 현탁액에 potato sucrose broth를 첨가해주면 잿빛곰팡이병이 많이 발생하였으며, 이것은 살균수에서 B. cinerea 포자가 발아하고 1차 부착기는 형성되었으나 부착기로부터 더 이상의 균사가 자라지 않았고, 영양원이 공급되었을 때에는 2차 부착기가 형성되고 이를 통해 잎과 떡잎 같은 두꺼운 조직을 침입할 수 있어 잿빛곰팡이병이 발생한 것이라고 하였다. 따라서, 마늘의 잎마름병 발생을 위해서도 S. vesicarium의 포자현탁액에 탄소원 1가지를 첨가하는 것보다 탄소원과 질소원이 모두 포함된 복합 영양원인 50% PDB를 첨가하는 것이 효과적이라고 생각되었다.
이상의 결과를 종합하여, 마늘의 잎마름병에 대한 저항성을 대량으로 검정하기 위한 방법으로 원예용 상토에 마늘을 파종하고 4엽기가 되도록 재배하고, 탈색된 비흡수성의 솜으로 마늘 잎을 문질러 준 후에, 50% PDB 용액으로 제조한 S. vesicarium 균주의 포자 현탁액(3.0 × 105 spores/mL)을 분무하여 접종하고, 접종한 식물은 20°C에서 48시간 동안 습실상에서 습실처리하고, 25°C 항온항습실(상대습도 80%)에서 하루에 12시간씩 광을 조사하면서 재배하고, 접종 7일 후에 1–3엽에 발생한 잎마름병의 병반면적율을 조사하는 것을 제안하고자 한다.


