서 언
재료 및 방법
식물재료
과실 품질특성
가용성 당 및 전분 함량
효소 추출 및 활성
총 단백질 정량
결과 및 고찰
과실 생장과 과실 품질의 변화
가용성 당 및 전분 함량의 변화
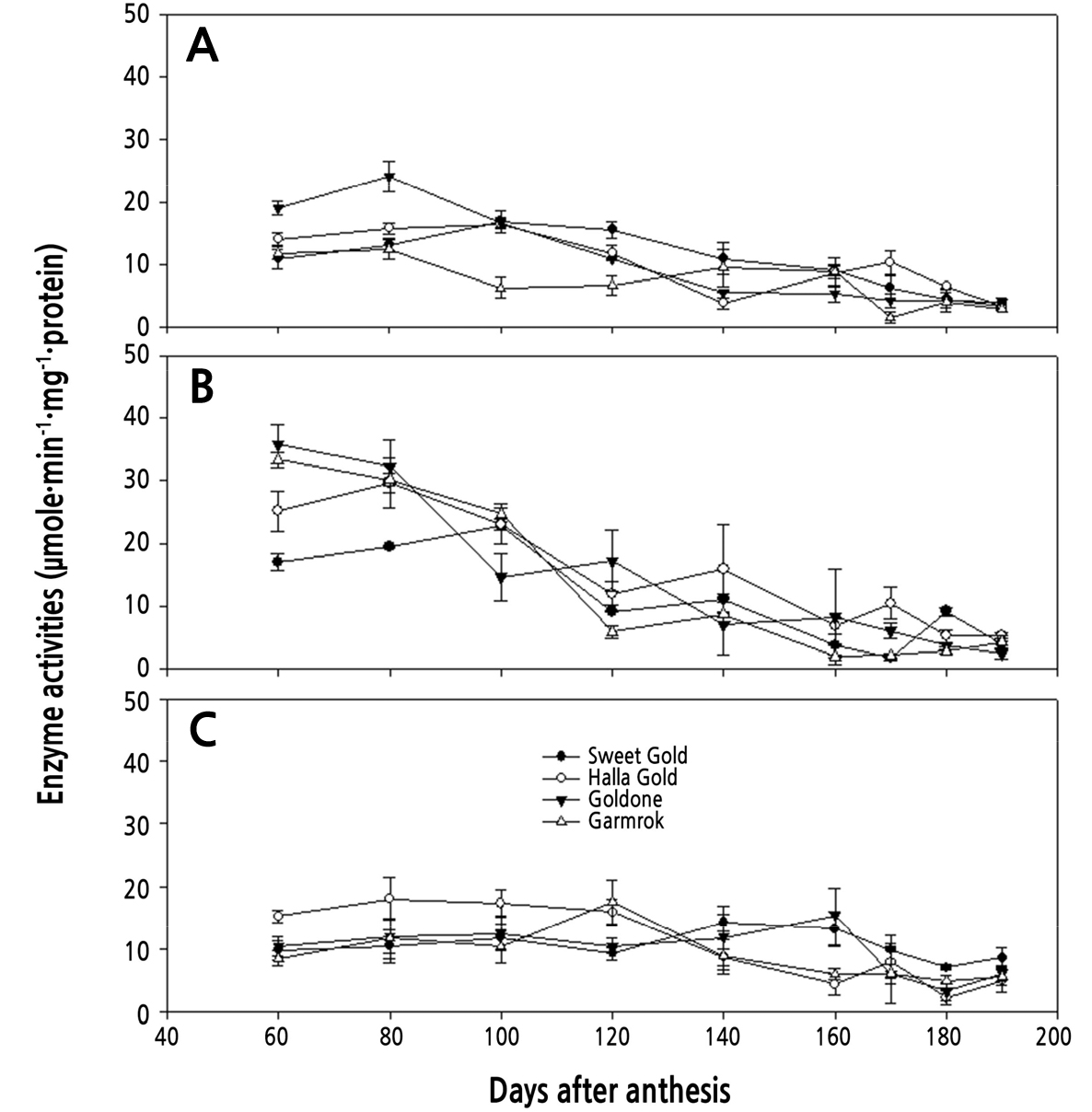
자당 대사 효소 활성의 변화
서 언
참다래(Kiwifruit)는 다래나무과(Actinidiaceae)의 다래나무속(Actinidia)에 속하는 다년생 덩굴성 낙엽과수이다(Huang et al., 2004). 다래나무속(Actinidia)은 50개 이상의 다양한 종을 포함하고 있다(Ferguson, 1999). 참다래는 1920년경에 뉴질랜드에서 다래종자를 중국으로부터 도입하고 우량계통을 선발하여 보급하면서 산업화되었다(Ferguson, 1990). 그 중 그린키위 ‘헤이워드’는 다수성이면서 재배가 용이하고, 특히 품질과 저장력이 우수하여 우리나라에서도 참다래 재배면적의 85%를 차지할 정도로 확대되었다(Park, 2009). 골드키위의 대표적인 품종은 뉴질랜드 기업 Zespri에서 육성한 품종인 ‘Hort16A’인데, 당도가 높고 수량이 많아 상업적으로 가장 많이 재배되는 품종이다(Richardson et al., 2011). 그러나 이들 품종을 재배하려면 Zespri와 계약을 하기 위한 조건이 까다롭고 수취가격의 15%를 지불해야 되기 때문에 농가들에게는 큰 부담이었다. 그러므로 국내에서는 ‘골드원’, ‘제시골드’, ‘스위트골드’, ‘해금’ 등을 육성하여 보급해 오고 있다(Kim et al., 2012; Kwack et al., 2017; Shin et al., 2020).
골드키위의 과중은 만개 70일 전후로 최종 크기의 약 80% 수준에 도달하고, 전분 함량은 만개 후 190일까지 계속 증가한 후 급격히 감소하며, 가용성 당은 만개 후 140일부터 증가가 시작된다(Beever and Hopkirk, 1990; Richardson et al., 2011; Lim et al., 2018). 가용성 당 함량은 수확기 결정 및 후숙 후 과실 품질을 결정하는 핵심 지표로서, 과실의 성숙과 더불어 축적된 전분이 가용성 당으로 전환되어 증가한다(Ryugo, 1988; Beaudry et al., 1989; Beever and Hopkirk, 1990; Miron and Schaffer, 1991; MacRae et al., 1992; Zhou and Paull, 2001; Sitthiwong et al., 2005). 그러나 최근 국내에서 육성되어 보급되고 있는 품종에 대한 과실 생육의 생리·생화학적 특성에 대해서는 알려진 바가 거의 없는 실정이다.
감귤, 사과, 바나나 등의 과실에서 전분의 분해와 더불어 가용성 당의 증가에는 자당 대사에 관여하는 효소의 작용이 중요한 역할을 하는 것으로 알려져 왔다(Lowell et al., 1989; Hubbard et al., 1990; Komatsu et al., 2002; Song et al., 2003; Lee et al., 2003; Geromel et al., 2006). 토마토와 멜론에서는 품종별 생육단계에 따른 당도 및 가용성 당 함량의 차이가 이들 효소 활성과 관계된다고 보고된 바 있다(Islam et al., 1996; Lee et al., 1997). 참다래(‘헤이워드’)에서 acid invertase(AI)는 세포벽에 결합되어 있고 자당 분해에 관여하며 과실의 성숙과 더불어 활성이 감소한다고 보고된 바 있다(MacRae et al., 1992). 또한 ‘헤이워드’에서 sucrose synthase(SS)는 자당 분해에 관여하며 만개 후 20–40일에 높은 활성도를 나타낸다고 보고되었다(Moscatello et al., 2011). 하지만 골드 키위에서의 당 관련 효소활성 및 생화학적 연구는 아직 보고된 바가 없다.
따라서 본 연구는 최근 국내에서 육성되어 보급되고 있는 골드키위 3품종과 그린키위 1품종에 대하여 제주지역에서의 과실 생육 특성과 자당 대사 효소 활성과의 관계를 구명하고자 수행되었다.
재료 및 방법
식물재료
제주특별자치도 제주시 영평동 1228번지에 위치한 농가의 무가온 하우스에서 덕식으로 재배되고 있는 골드키위 계통(A. chinensis var. chinensis) ‘한라골드’(8년생) 및 ‘스위트골드’(5년생)와 애월읍 광령리 918-1번지에 위치한 ‘골드원’(4년생), 그리고 그린키위 계통(A. chinensis var. deliciosa) ‘감록’(3년생)의 품종을 사용하였다. 과실 종경과 횡경은 만개 후 20일부터 160일까지 20일간격으로 조사하였으며 건물중과 과중은 60일부터 조사하였다. 만개 후 160일에서 190일 사이 수확기에는 과실의 품질 변화를 알아보고자 당도, 산도, 경도, 과육 색도 등을 10일 간격으로 분석하였다. 품종당 임의로 3주를 선정하고 매번 조사시기마다 주당 3개의 결과지로부터 10개의 과실을 선정하여 종경 및 횡경을 조사하였다. 건물율 및 과중, 당도, 산도, 경도, 과육 색도는 3개의 결과지로부터 5개의 과실 조사값을 평균하였다. 그리고 가용성 당 및 전분 분석, 효소 활성은 3개의 결과지로부터 1개의 과실을 활용하여 분석하였다. 채취한 과실은 72시간 동안 동결건조 후 분말로 마쇄한 다음 분석 전까지 초저온 냉동고(–70°C)에 보관하였다. 전정, 적화, 수정, 시비, 관수 등의 재배 관리는 표준 재배 관행에 준하여 수행하였다.
과실 품질특성
과실 종경과 횡경은 버니어캘리퍼스를 이용하여 측정하였다. 과중은 전자저울(EL-2000S, Setra Inc., Us)을 이용하여 측정하였다. 건물률은 과실의 적도 부분을 3mm 두께로 절편을 내어 60°C에서 24시간동안 건조한 후 건물중/생체중*100으로 계산하였다(Burden et al., 2016). 과실 당도와 산도는 과즙을 이용하여 디지털당산분석기(GMK-707R, G-won Co., Korea)를 사용하였다. 경도는 과피를 1–2mm 두께로 벗겨 ø5mm plunger가 부착된 5kg 과일 경도계(FHM-5, Takemura Co., Japan)를 사용하여 측정하였다. 과육 색도는 과피를 2–3mm의 두께로 벗긴 후 색차계(CR-400 Chroma Meter, Minolta Co., Japan)를 이용하여 hue 값(ho)을 측정하였다.
가용성 당 및 전분 함량
가용성 당 함량은 Srisook et al.(2015)의 분석방법을 일부 변형하여 수행하였다. 과실 분말 시료 1g를 10mL 80% 에탄올로 30분간 상온에서 섞어준 뒤, 4°C에서 10분간 10,000xg로 원심분리한 후 여과지(Toyo Roshi Kaisha, Ltd., Japan)로 상징액을 여과시켜 가용성 당 분석의 시료로 이용하였다. 침전물은 60°C로 24시간동안 건조시켰으며 이를 전분 분말로 이용하였다. 가용성 당 분석 시료는 농축기(Laborota 4000, Heidolph, Germany)로 농축한 뒤 증류수를 넣어 잘 흔들어준 후 C-18 Sep-Pak cartridge(Waters, USA) 및 0.45µm syringe filter로 여과시켰다. 그리고 Shim-pak GIS NH2 컬럼(250×4mm, 6µm, Shimadzu, Japan)이 장착된 HPLC(LC-20AT, Shimadzu, Japan)로 분석하였다. 이동상은 75%(v/v) acetonitrile/ ddH20을 이용하였고, 0.9mL·min-1의 유속으로 시료의 과당, 포도당, 자당, 미오이노시톨을 refractive index dector(RID-10A, Shimadzu, Japan)로 검출하여 정량하였다. 전분의 추출 및 분석은 Magel and München(1991)의 방법을 일부 변형하여 수행하였다. 전분 분말 0.2g을 18% HCl 4mL로 추출하였으며 Lugol’s solution(0.25g I2, 0.5g KI)을 첨가하여 비색계(UV-1650PC, Shimadzu, Japan)로 함량을 정량하였다.
효소 추출 및 활성
자당 대사 효소의 추출은 Moscatello et al.(2011)의 방법을 일부 변형하여 수행하였다. 과실 분말 시료 2g에 20mL 추출용액 [0.25M Hepes-KOH(pH 7.8), 5mM Mgcl2, 2mM EDTA, 1mM phenylmethylsulfonyl(PMSF), 10mM mercaptoethanol, 10mM ascorbic acid, 2% glycerol, 3% polyvinyl polypyrrolidone(PVPP), 1mM dithiothreitol(DTT)]를 넣어 유봉으로 마쇄한 후 12,000xg에서 4°C로 15분간 원심분리 하였다. 상징액을 Sephadex G-25 PD-10 column(Amersham Bio Sciences Corp., UK)으로 거친 후 가용성 효소 활성 분석을 위한 조효소액으로 구성되었다. 원심분리 침전물은 탈염용액을 이용하여 2–2회 세척한 후 AI 활성 분석용 조효소액으로 구성되었다. SS와 sucrose phosphate synthase(SPS) 활성은 Song et al.(1998)의 방법을 일부 변형하여 측정하였다. SS효소의 반응액은 분해 방향에 대해 20mM Hepes-KOH(pH 7.2), 4mM urdine 5'-diphosphoglucose(UDP), 24mM sucrose 및 조효소액으로, 합성 방향에 대해서는 100mM Hepes-KOH(pH 7.2), 2mM UDP-glucose, 10mM fructose, 5mM Mgcl2 및 조효소액으로 구성되었다. SPS의 반응액은 93mM Hepes-KOH(pH 7.5), 29mM MgCl2, 2mM EDTA, 7.7mM fructose-6-P, 28.2mM gluclose-6-P, 7.1mM UDP-glucose 및 조효소액으로 구성되었다. SS와 SPS의 효소 활성 측정은 27°C에 반응시킨 후 자당의 변화량을 Handel(1968)의 방법에 따라 비색 정량한 후 산출하였다. AI 활성은 20mM citrate buffer(pH 4.8), 40mM sucrose 및 조효소액으로, neutral invertase(NI) 활성은 20mM Hepes-KOH(pH 7.2), 40mM sucrose 및 조효소액으로 각각 조성하여 37°C에서 반응시킨 후 기질로 소모된 자당을 비색 정량한 후 산출하였다.
총 단백질 정량
효소 활성 분석을 위한 총 단백질 정량은 Bradford(1976)의 방법으로 Bio-Rad protein assay kit(Bio-Rad 500-0001, Bio-Rad Laboratories, Inc., CA, USA)을 이용하여 595nm에서 측정하였다.
결과 및 고찰
과실 생장과 과실 품질의 변화
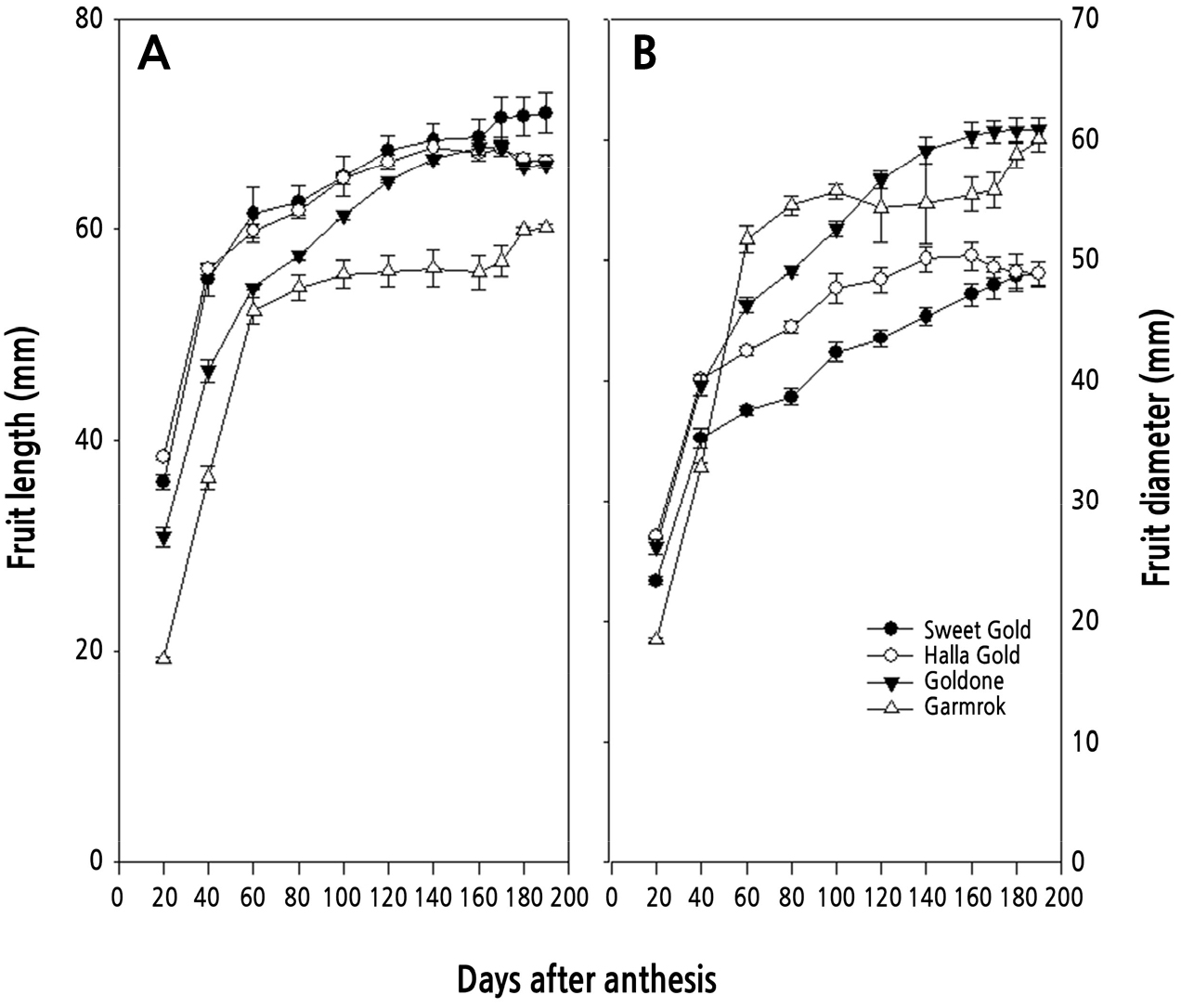
참다래 4품종의 만개 후 20일부터 190일까지 과실의 종경과 횡경 변화를 2017년과 2018년 2년간 조사하여 그 평균값을 Fig. 1에 나타내었다. 과실의 종경과 횡경은 대부분 만개 후 60일까지 급증하고, 이후 완만한 증가 추세를 나타내었으나, 품종 및 과실 형태의 특성에 따라 약간의 차이를 보였다. ‘감록’의 과형은 작은 사과형으로 종경과 횡경의 비대가 만개 60일 이후 거의 진행되지 않다가 170일 이후 다시 증가하였다. ‘스위트골드’의 과형은 도란형으로 종경이 길고 횡경은 작은 특성을 가지고 있는데, 만개 60일 이후 수확기까지 꾸준히 증가하는 양상을 나타내었다. ‘골드원’과 ‘한라골드’에서 과실 종경과 횡경은 만개 후 60일까지 급격히 증가하고 160일까지는 점진적으로 증가하였다.
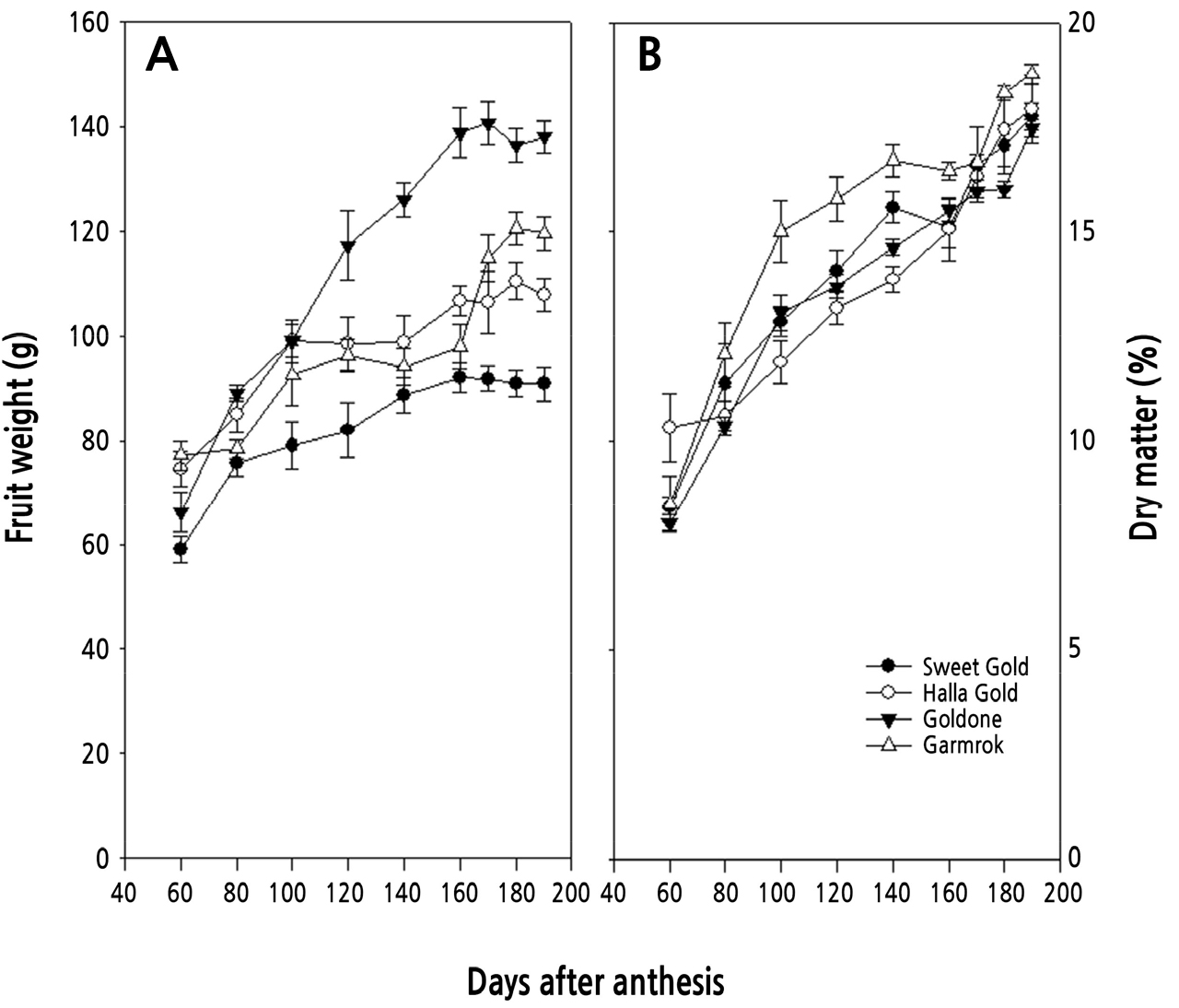
참다래 4품종의 만개 후 60일부터 190일까지 과중과 건물율의 변화를 분석하여 2년치의 평균값을 Fig. 2에 나타내었다. 과중은 대체로 만개 100일까지 급격히 증가하고 이후 완만히 증가하는 경향이었으나, 품종에 따라 약간의 차이를 보였다(Fig. 2A). ‘스위트골드’는 4개 품종 중 과중이 가장 작았고, 단일 S자형 생장 패턴을 보여, 종경과 횡경의 2중 S자형 비대 양상과는 다소 차이가 있었다. ‘골드원’의 경우, 과중이 가장 큰 편으로 만개 후 170일인 수확기 즈음까지 지속적으로 증가하는 경향을 보여, 단일 s자형의 생장 패턴을 나타내었다. ‘한라골드’와 ‘감록’에서는 만개 후 100일까지 과중이 급증하고, 이후 미미하게 증가하다가, ‘한라골드’는 재차 급격한 증가를 보였으나 ‘감록’은 완만한 증가세를 나타내었다. 건물율의 변화는 4개 품종 모두 만개 후 수확기까지 꾸준히 증가하는 경향이었으나, 품종에 따라 약간의 차이가 있었다(Fig. 2B).
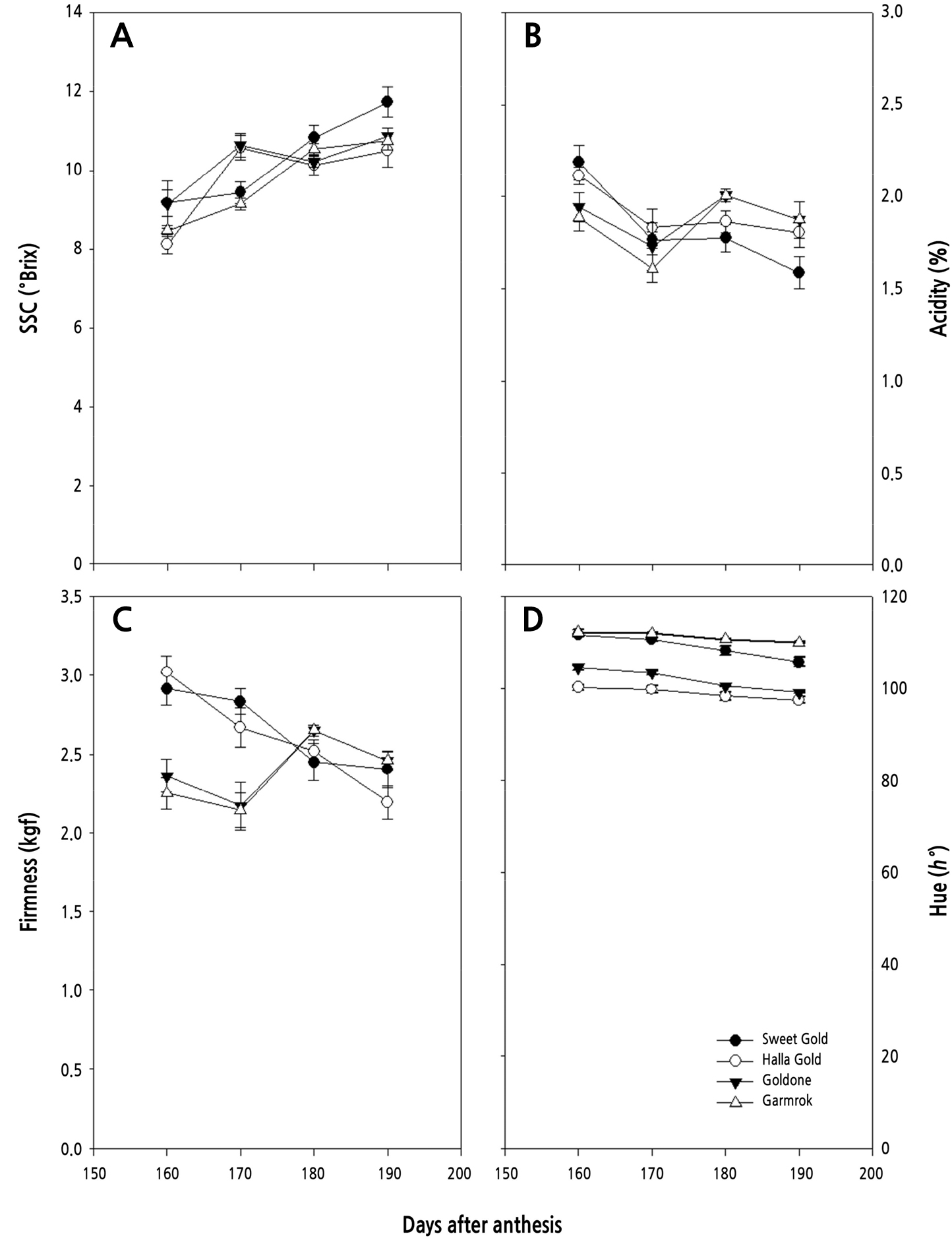
참다래 4개 품종의 만개 후 160일부터 190일까지 과실의 품질변화를 분석하여 Fig. 3에 나타내었다. 당도는 만개 후 160일에 이미 4개 품종 모두 8°Brix 이상을 나타내었으며, 꾸준히 증가하는 경향이었다(Fig. 3A). 산도는 만개 후 160일에 모든 품종에서 2% 내외를 나타내었는데, 이후 ‘스위트골드’와 ‘한라골드’에서는 점진적으로 감소하는 경향이었으나, ‘골드원’과 ‘감록’에서는 감소하지 않고 유지되는 경향을 보여주었다(Fig. 3B). 경도는 ‘스위트골드’와 ‘한라골드’에서는 점진적으로 감소하였고, ‘골드원’과 ‘감록’에서는 유지되는 경향으로 산도의 변화와 유사하게 나타났다(Fig. 3C). 과육색의 지표로 이용되는 hue(ho)값은 골드키위 계통인 ‘스위트골드’가 ‘한라골드’와 ‘골드원’과 달리 그린키위 계통인 ‘감록’과 유사하게 높게 나타났으며, 수확기에 다가올수록 감소가 미미한 ‘감록’과 달리 점차 감소하는 경향을 보였다(Fig. 3D).
참다래의 과실 비대는 일반적으로 2중 S자형 생장곡선으로 나타낸다고 알려져 있으나, 품종과 재배지역에 따라 단일 S자형 또는 3중 S자형을 나타내기도 한다(Hopping, 1976; Beever and Hopkirk, 1990). 본 연구에서도 이와 유사하게 과실의 종경과 횡경에서는 ‘스위트골드’와 ‘감록’은 2중 S자형을, ‘한라골드’와 ‘골드원’은 단일 S자형을 나타내었고, 과중에서는 ‘스위트골드’와 ‘골드원’은 단일 S자형을, ‘한라골드’와 ‘감록’은 2중 S자형의 생장 패턴을 나타내었다. 참다래의 과실 비대 양상에 있어서도 만개 후 60–80일까지 급등하다가 완만해진다는 보고와 유사하였다(Pratt and Reid, 1974; Beever and Hopkirk, 1990; Richardson et al., 2011; Lim et al., 2018). 건물율은 수분을 뺀 상태의 과실 내 전분, 가용성 당 및 단백질 등을 포함하는 과실 구성물의 정도를 나타내며 후숙 후 당도를 예측하는 지표로 이용되고 있다(Burdon et al., 2004). 본 연구에 이용된 품종 중에서는 ‘감록’이 건물율이 가장 높아, 당도가 높은 품종으로 판단되었으며, 그 다음으로 ‘스위트골드’와 ‘한라골드’가 비슷하게 나타났고, ‘골드원’은 다소 낮은 경향을 보여, 재배 시에 여름 전정 등 건물율을 높이기 위한 세심한 품질 관리가 필요한 품종으로 판단되었다. 당도는 수확시기를 판단하는 중요한 지표로 이용되고 있는데, 골드키위의 경우 8.0°Brix 내외, 그린의 경우 6.2 °Brix 내외로 알려져 있다(Beever and Hopkirt, 1990; Richardson et al., 2011; Burdon et al., 2016; Lim et al., 2018; Shin et al., 2019). 본 연구에 이용된 4개 품종 모두 만개 후 160일에 이미 8.0°Brix를 나타내어, 수확기 최소 당도의 기준을 충족하고 있었다. 과육색의 지표인 hue angle(ho)은 골드키위에서 중요한 수확기 지표인데(Mirco, 2008; Richardson et al., 2011; Lim et al., 2018), ‘한라골드’와 ‘골드원’은 만개 후 160일에 105를 나타내었으나, ‘스위트골드’는 160일에 110을 나타내었고, 190일에 105를 나타내었다. 건물율, 당도 및 과육색을 고려할 때, ‘한라골드’, ‘골드원’ 및 ‘감록’은 만개 후 160일 내외이면 적숙기에 이를 수 있는데 반해, ‘스위트골드’는 180일 내외에서 적숙기를 가질 것으로 판단된다. 과육색을 증진할 수 있는 재배기술 개발이 필요한 품종으로 보여졌다. 골드키위의 과육색은 녹색을 띄는 엽록소의 함량이 그린키위에 비해 현저히 낮고 카로티노이드의 하나인 xanthophyll의 축적 정도에 따라 색도가 변한다고 보고되었는데(Tony and Gary, 2002), 이에 대해서는 추가적인 연구가 필요한 것으로 생각된다.
가용성 당 및 전분 함량의 변화
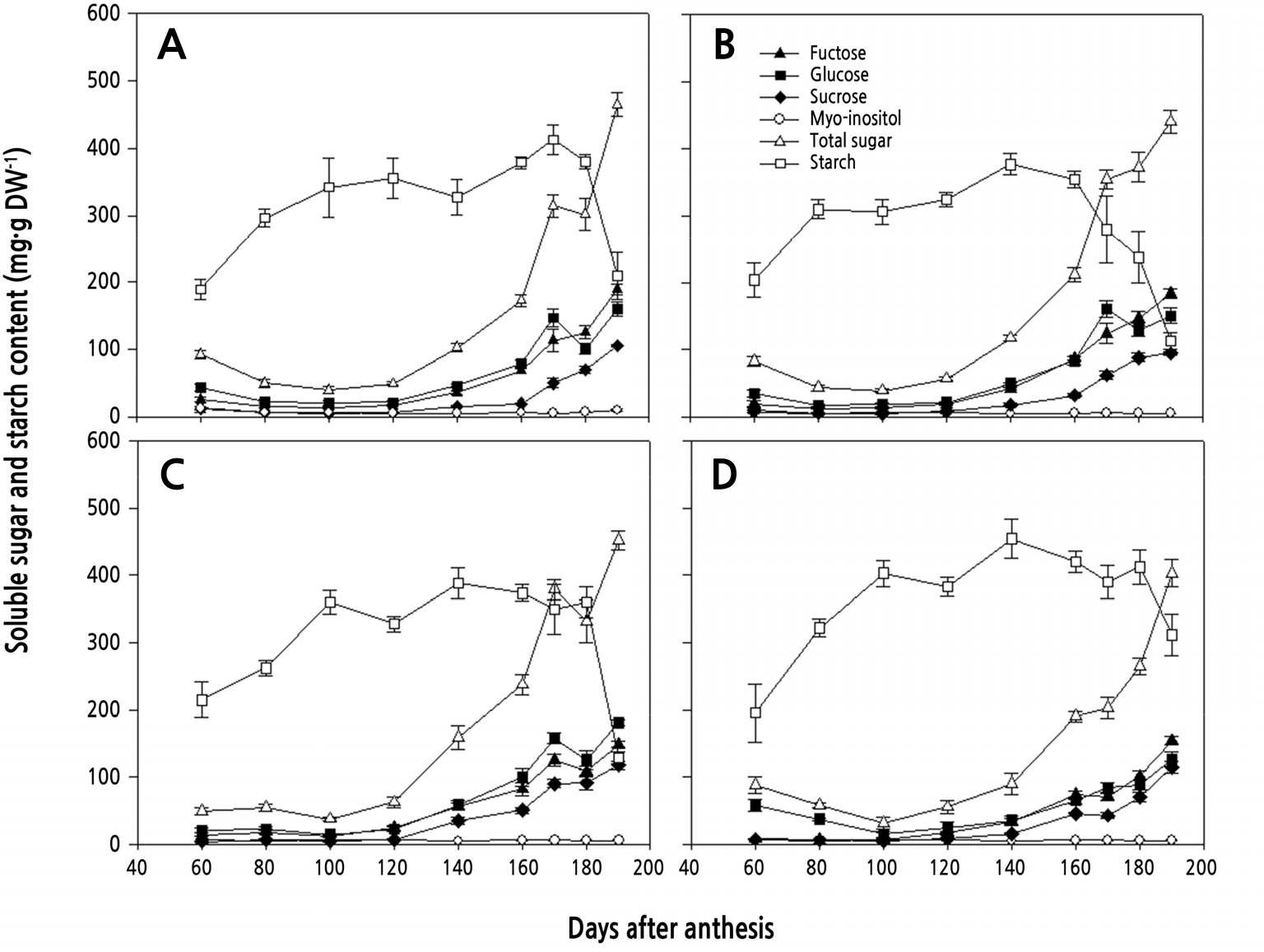
참다래 4개 품종의 전분 및 가용성 당 함량의 변화를 Fig. 4에 나타내었다. 전분의 축적은 대부분 만개 후 100일까지 급증하고, 이후 서서히 증가하다가 180일 전후에 급격히 감소하는 것으로 나타났다. 다만, ‘한라골드’의 경우에는 다른 품종들과 달리 만개 후 160일경부터 급격한 전분 감소가 진행되는 것으로 나타났다. 가용성 당 함량에 있어서는 과실 비대기까지는 미미한 수준으로 유지되다가, 만개 120일 이후부터 점차 증가하는 경향을 보였다. 포도당과 과당이 비슷한 수준으로 가장 높게 나타났고, 자당이 뒤를 이었으며, 미오-이노시톨의 함량은 전 생육기 동안 미미한 수준을 유지하는 경향이었다. 전분의 물질대사는 복잡하고 다양한 과정을 통하여 전분의 축적과 분해가 이루어진다(Wegrzyn and MacRae, 1995). 골드키위 품종인 ‘Gold3’에서는 약 만개 후 55일부터 90일까지 전분이 급격히 축적되고, 만개 후 190일까지는 지속적으로 증가한 다음, 이후 급격히 감소하였는데(Richardson et al., 2011), 본 연구 결과와 유사하였다. 전분의 분해는 계절적인 차이로 인한 일교차에 영향을 받는다고 보고된 바 있는데(Richardson et al., 2004; Snelgar et al., 2005), 이로 인해 제주도와 뉴질랜드 지역 간 전분 분해 시기에 차이를 보이는 것으로 생각된다. 또한 과실 내에서 충분한 세포분열 과정이 끝나지 않으면 전분의 축적이 일어나지 않는다는 보고가 있는데(Richardson et al., 2004), 이에 대해서는 추가적인 연구가 필요한 것으로 생각된다.
자당 대사 효소 활성의 변화
참다래 4개 품종의 과실에서 SS, AI 및 NI의 자당분해 활성을 분석하여 Fig. 5에 나타내었다. SS의 자당분해 활성은 대체로 4품종 모두 만개 후 100일까지 약간 높은 활성을 보이다가 140일까지 점차 감소한 후, 수확기까지 매우 낮은 수준에 머물렀다. AI의 경우 SS와 유사하게 만개 후 100일까지는 높은 활성을 보였지만, 이후 점차 급감하였고 160일경부터는 미미한 수준에 머물렀다. NI의 활성은 4품종 모두 만개 후 140–160일까지 일정하게 유지되다가, 이후 급감하여 매우 낮은 수준을 나타냈다. MacRae et al.(1992)에 따르면 ‘헤이워드’ 품종에서 과실의 성숙과 더불어 AI의 활성은 감소하고, Moscatello et al.(2011)는 만개 후 20–40일에 SS의 자당분해 활성이 높게 나타난다고 보고하였는데, 본 연구 결과와 유사하였다. 잎에서 과실로 전류된 자당은 이들 자당분해 효소에 의해 분해되어 세포분열 및 과실비대에 이용될 것이며(Song et al., 2003; Fei et al., 2020), 이후에는 전분의 축적과 관계될 수 있을 것이다. 이는 과실의 종경과 횡경이 만개 후 60일까지(Fig. 1), 그리고 과중 및 전분의 축적이 100일까지 급격히 증가하는 것(Figs. 2A and 4)과 관계되는 것으로 추정된다. ‘골드원’에서 SS와 AI의 활성이 과실의 생육초기 가장 높은 편이었고, ‘스위트골드’에서 AI의 활성이 가장 낮았는데, 초기 과실 비대의 양상과 직접적으로 관계되는지는 보다 상세한 연구가 필요하다고 생각된다. 또한 ‘한라골드’의 경우 SS와 AI의 활성이 만개 후 170일에 가장 높게 나타났는데(Fig. 5), 다른 품종에 비해 전분의 조기 분해가 나타난 현상(Fig. 4B)과 관계되는지에 대한 연구가 필요하다고 판단된다. NI는 애기장대에서 당 대사조절의 항상성을 제어하고 자당을 분해하는 역할을 하며 SS보다 더 많은 관여를 한다고 보고된 바 있다(Barratt et al., 2009). 또한 ‘헤이워드’에서는 유과기에 NI의 활성이 증가될수록 포도당의 농도가 증가된다고 보고되었다(Nardozza et al., 2013). 그러나 본 연구에서는 모든 품종에서 만개 후 160일까지 일정하게 활성을 유지하였기 때문에, NI의 포도당과의 관계나 자당분해 역할에 있어서의 중요도를 평가할 수는 없었으며, 추가적인 연구가 필요할 것으로 생각된다.
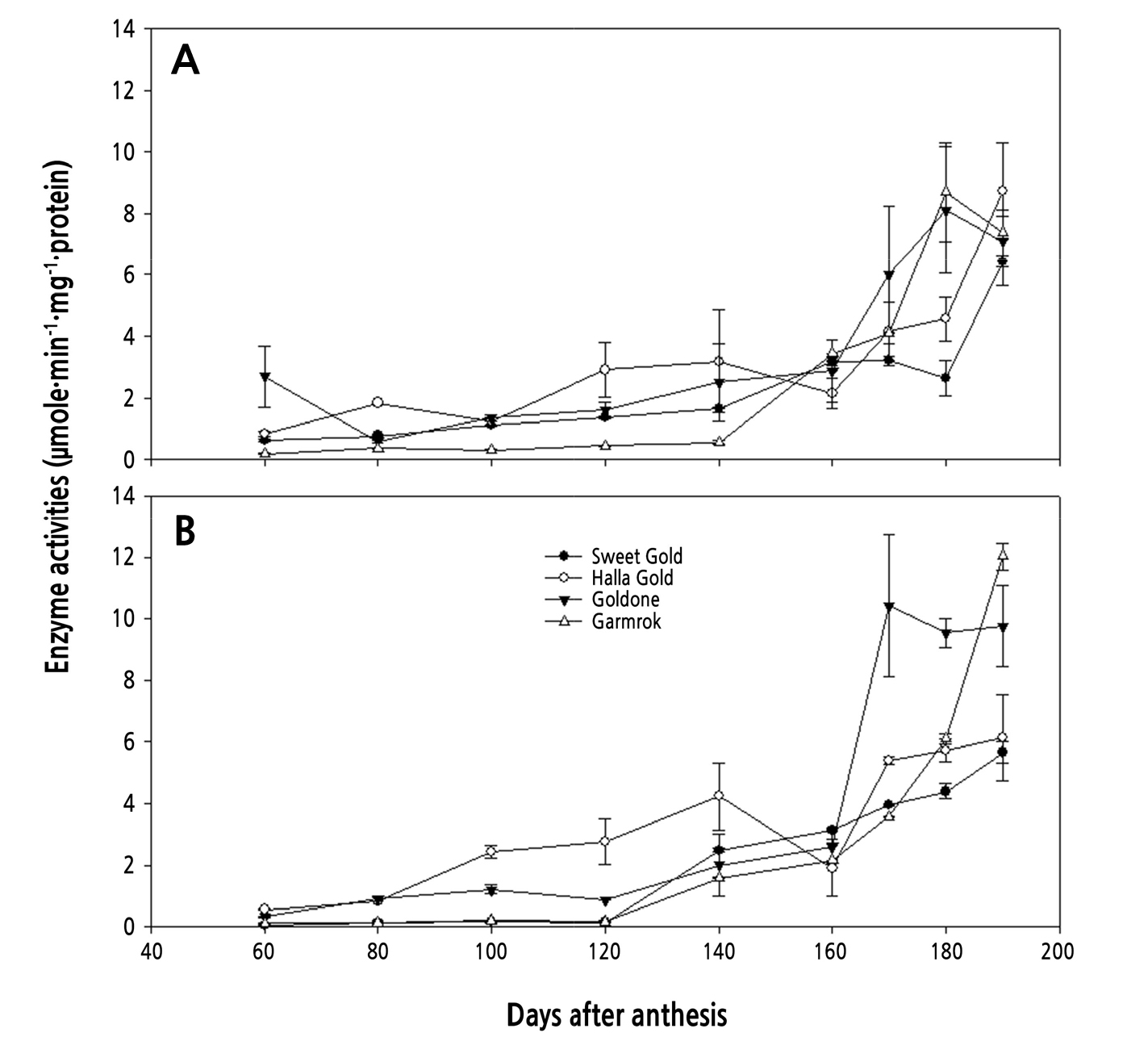
과실의 생육기 동안 SPS와 SS의 자당 합성 활성을 Fig. 6에 나타내었다. SPS의 활성은 대체로 만개 후 140일부터, SS의 활성은 120일부터 점차 증가하였는데, 그 경향은 품종에 따라 약간의 차이를 나타냈다. 이들 효소 활성의 변화 양상은 자당 및 가용성 당 함량의 증가 양상(Fig. 4)과 거의 일치하는 경향을 보였다. 그러나 참다래 과실의 자당 및 가용성 당의 증가는 후숙 기간에 급증하게 진행되므로(MacRae et al., 1992; Mitalo et al., 2019), 수확기까지의 자당 합성 효소의 활성을 가지고 품종에 따른 자당, 가용성 당 함량 및 당도의 변화를 해석하기에는 한계가 있는 것으로 판단된다. 그러므로 이에 대해서는 후숙 기간을 포함한 추가적인 연구가 진행되어야 할 것으로 생각된다.