서 언
현대인들의 실내 활동이 늘어나면서 반려식물에 대한 관심과 실내 녹화 사례가 증가하고 있다(Jang et al., 2016; Han et al., 2021). 실내 식물 도입은 사람들의 스트레스를 완화하고 정서 안정에 긍정적이며(Lee et al., 2019a), 식물의 미세먼지 제거나 온・습도 조절 기능으로 벽면녹화와 같은 큰 규모의 실내 녹화를 통해 실내 환경을 개선할 수 있다(Bang et al., 2013; Kwon and Park, 2017). 외부 환경과 비교해서 일상 생활 속 실내 광 수준은 식물 대부분의 광 요구량보다는 현저히 낮기 때문에(Choi, 2005) 내음성이 강한 식물이 선호되어 열대 및 아열대 원산의 관엽 식물들이 실내 녹화 소재의 대부분을 차지하고 있다(Kim et al., 2013).
최근 실내외 녹화 및 정원 조성이 증가하면서 국산 및 자생 식물에 대한 관심과 수요가 증가하고 있으며(Shin et al., 2011), 실내 녹화 소재에 대한 탐색과 발굴도 필요한 시점이다. 자생식물의 실내 도입 소재로 이끼류(Gong et al., 2018), 상록 양치류(Choi, 2007)가 연구되었으며, 마삭줄, 팔손이 등 실내 도입 가능 수종에 대한 실내 공기 정화 효과도 보고되었다(Ko et al., 2007; Kim et al., 2010).
좀비비추(Hosta minor, Korean hosta)는 한국 특산 고유종으로 강원, 경북, 경남, 전남 등 전국에 걸쳐 널리 분포하며 비비추(H. longipes)와 비슷하지만 전체적으로 식물체가 작고 예저의 잎을 가지고 있다(Lee, 2006). 잎은 뿌리에서 총생하며 넓은 난형이고 길이 10cm 정도로서 밑부분이 얕은 심장저이며 갑자기 잎자루로 흐른다. 꽃은 6–7월에 연한 자주색으로 피며, 화경은 약 30cm로 세로줄이 있고 꽃들이 한쪽으로 치우쳐서 총상화서를 이룬다. 잎과 꽃이 식용 가능한 다년생 숙근 초화로 녹색 잎과 연보라색 총상화서는 관상 가치가 뛰어나서 정원 식물로의 이용성이 높게 평가되고 있다(Jo and Kim, 2017; Lee, 2018). 한편 비비추속 식물들과 마찬가지로 내음성이 우수하고 초형 특성을 고려할 때 실내 녹화용 소재로도 개발 가치가 높을 것으로 생각되지만, 현재까지 실내 도입 사례나 실내 낮은 광도에 대한 생장 특성 정보는 전무한 실정이다. 따라서 특산식물인 좀비비추를 대상으로 실내 식물 활용성을 평가하고자 실내 저광 조건에서 생장 및 광 생리적 특성을 조사함으로써 비비추속 자생식물들의 실내 도입을 위한 기초자료로 활용하고자 본 연구를 실시하였다.
재료 및 방법
식물 재료
좀비비추는 2020년 12월 국립수목원으로부터 영양체로 분양을 받아 서울시립대학교 환경원예학과 실험온실에서 증식하였고, 건전하고 초형 크기와 엽수가 일정한 개체를 선발하여 식물재료로 이용하였다. 2021년 7월 12일 선발된 개체들을 플라스틱 화분(7.5 × 7.5 × 7.0cm)에 원예용 상토(Baroker, Seoul Bio, Korea) 50L와 과립형 양분(Osmocote, EVERRIS, Netherlands) 454g을 혼합한 배지를 이용하여 식재하고 2주간 온실에서 활착 시켰다. 실내 도입 시 적응 기간을 확인하기 위해 별도의 순화과정을 거치지 않았다. 초기 생장 자료를 얻기 위해 처리 전 엽수, 엽크기(엽장 × 엽폭), SPAD값(SPAD-502Plus, KONICA MINOLTA, Japan), 엽면적(LI-3100C, LI-COR, USA), 지상부 건물중을 조사하였다. 이를 초기값(initial value, 0주차)으로 활용하였다(n = 10).
광도 처리
실험은 2021년 7월 26일부터 10월 27일까지 3개월(13주)간 진행되었다. 서울시립대학교 환경화훼연구실 실내실험실에서 상용제품인 실내 재배 키트(Sun Garden, SENS MAM, Korea)를 이용하였다(백색 LED 광원). 처리 광도는 기 보고된 비비추(H. longipes)의 광보상점(Zhang et al., 2004)과 식물이 도입되는 사무실이나 아파트 거실의 광도 수준을 고려하여 10µmol·m-2·s-1(L10), 30µmol·m-2·s-1(L30), 50µmol·m-2·s-1(L50) 3수준으로 설정하였다. 처리 광도는 재배 키트에 설치되어 있는 dimming controller를 이용하여 화분 10cm 높이를 기준으로 설정하였다(휴대용 광도계, LI-250A, LI-COR, USA). 일일 광주기는 16시간으로 고정하였다. 실험 기간 중 실내 온도와 상대습도는 22 ± 5°C, 43 ± 10%로 조절하였고, 겉흙이 마르는 정도에 따라 주 1–2회 수준으로 포트당 150mL씩 관수하였다. 좀비비추의 생장 및 광생리적 특성 변화를 비교하기 위해 초기 생장을 함께 조사한 식물 10개체를 실험기간 동안 온실환경에서 별도로 관리하였다.
생장 조사
처리 2주차부터 일주일 간격으로 분얼수, 엽수, 엽크기(엽장 × 엽폭), SPAD값을 조사하였다. 주당 엽면적(LI-3100C, LI-COR, USA)과 지상부 건물중(70°C, 72시간 건조)은 1개월 간격으로 4, 9, 13주차 때 측정하였다. 처리기간 동안 일일생장량(mg/day)과 광이용효율(g/mol)은 초기값(0주차)과 13주차 엽건물중을 이용해서 다음 식으로 계산하였다.
∙ 일일생장량(mg/day) = [(13주차 엽건물중) ― (0주차 엽건물중)] / 처리기간(일)
∙ 광이용효율(g/mol) = [(13주차 엽건물중) ― (0주차 엽건물중)] / 총누적광량
광합성 및 엽록소형광 분석
순광합성량 측정은 1개월 간격으로 4, 9, 13주차에 실시하였다. 개체별 가장 큰 잎을 대상으로 광합성측정기(LI-6800, LI-COR, USA)를 이용하여 측정한 다음, 초기값(initial value, 0주차)과 비교하였다. 광합성 포화곡선 측정은 13주차에 실시하였으며, 광도(photosynthetic photon flux density, PPFD)를 0, 50, 100, 200, 400, 600, 800, 1,000, 1,200, 1,500µmol·m-2·s-1 10 수준으로 설정하고 오후 1시부터 3시간 동안 측정하였다(n = 3). 광합성측정기의 챔버 내부조건은 온도 23°C, 상대습도 50%, CO2 농도 400ppm, 공기유속 400µmol·s-1로 동일하게 설정하였다.
엽록소형광 측정은 순광합성량 측정과 동일하게 1개월 간격으로 4, 9, 13주차에 실시하였다. 광합성측정기(LI-6800, LI-COR, USA)의 엽록소형광 측정 기능을 이용하여 측정하였다. 개체별로 가장 큰 잎을 대상으로 20분간 암적응 후 최소형광값(F0), 최대형광값(Fm), 변동형광값(Fv), 최대 광화학적효율(Fv/Fm) 등의 기본 형광변수를 측정하였다(Choi et al., 2022a). OJIP 곡선은 동일한 기기를 사용하여 13주차에 측정하였다(n = 3). 한편 저광 환경에 따른 스트레스 정도를 알아보고자 13주차에 형광이미지분석기(FluorCam 800MF, PSI, Czech)을 이용해 quenching kinetics analysis 방법으로 non-photochemical quenching(NPQ)와 photochemical quenching(qP)를 측정하였다(Yoo et al., 2012)(n = 10).
통계분석
실험은 완전임의배치 10개체 반복으로 설계하였다. 통계분석 프로그램인 SAS 9.4 (SAS Institute, Cray, NC, USA)를 이용하여 ANOVA 분석(analysis of variance)과 DMRT (Duncan’s multiple range test)를 분석하였으며 유의 확률은 5% 수준으로 설정하였다.
결과 및 고찰
생장 반응
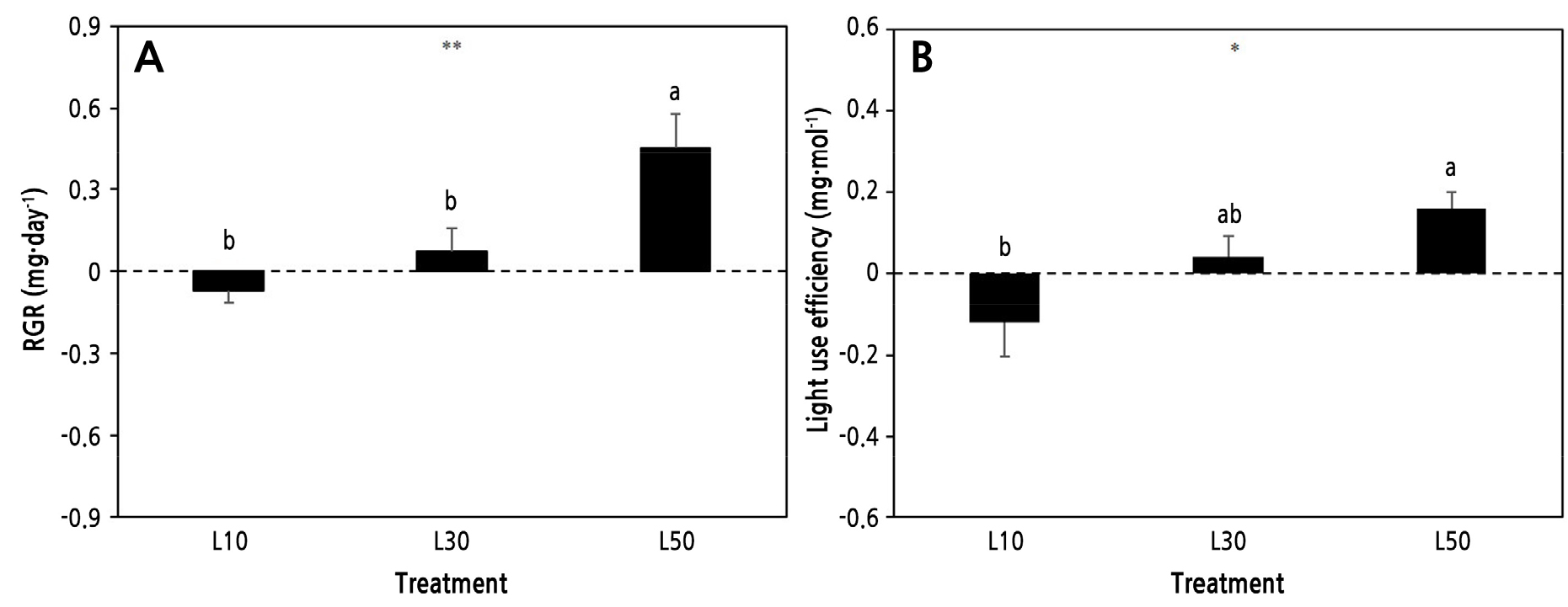
상대적으로 저광 수준인 L10에서는 생장이 부진하고 잎의 황화 현상도 많았다(Fig. 1). 초기값(0주차)과 비교할 때 처리 기간 내내 거의 생장하지 않고 오히려 감소하여 생장지표인 엽수와 엽크기는 초기값 대비 각각 48%, 22.5% 감소하였다(Fig. 2B and 2C). 반면 L30에서는 초기값과 비교해서 엽수와 엽크기가 38.6%, 11.6%, L50에서는 200%, 60% 증가하였다. 이것은 기존 비비추(H. longipes) 차광 실험에서 잎의 생장반응과 유사한 결과이다(Kim and Lee, 2009). 양적 생장지표인 분얼 역시 L10에서는 거의 없었으나, L30과 L50에서는 주당 1.5개, 2.3개로 나타났다(Fig. 2A). 저광 조건에서 총생엽을 가진 식물은 일반적으로 엽병 길이를 늘리거나 엽면적을 넓혀 광 수확량을 늘리는데(Oh and Kim, 2010), 본 실험에서도 4주차 이후부터 유사한 경향을 보였다. SPAD값의 경우 4주차까지는 처리 수준간 차이가 없이 일정하게 유지되다가 이후 L0에서 상대적으로 높게 유지된 반면, L50에서는 오히려 초기값보다 25% 감소하였다(Fig. 2D). 이것은 상대적으로 낮은 광도에서 새로운 잎이 발달하지 않으면서 기존 잎이 광수확 효율을 증진시키기 위해 엽록소 함량을 늘리고 배치에 변화를 준 결과로 이해된다. 주차별 생장지표들의 변화 양상을 살펴볼 때, 본 실험에서 좀비비추는 실내 도입에 따른 약 4주간의 저광 적응 기간이 소요된 것으로 판단된다. 전체 처리 기간 동안 엽건물중과 엽면적은 유의적 차이를 보이며 광도가 낮을수록 감소하였다(Fig. 3). 엽건물중으로 계산한 일일생장량(mg/day)은 L10, L30, L50에서 각각 –0.07, 0.07, 0.4, 처리기간 중 광이용효율(mg/mol)은 –0.12, 0.04, 0.16으로 광도가 높을수록 증가하였다(Fig. 4). 영양생장 기간 중 상대적으로 광이 높을수록 동화산물 축적을 촉진하여 지상부와 지하부 생장을 증가시키는 결과와 유사하다(Park et al., 2021; Zhou et al., 2022). 한편 L10에서는 모두 음의 값을 보여 실질적인 생장이 이뤄지지 않았으며 오히려 초기생장보다 감소했음을 알 수 있고, L30에서는 다소 증가하는 경향을 보여 좀비비추의 생장 한계 광도를 10–30µmol·m-2·s-1 범위로 추정할 수 있다.
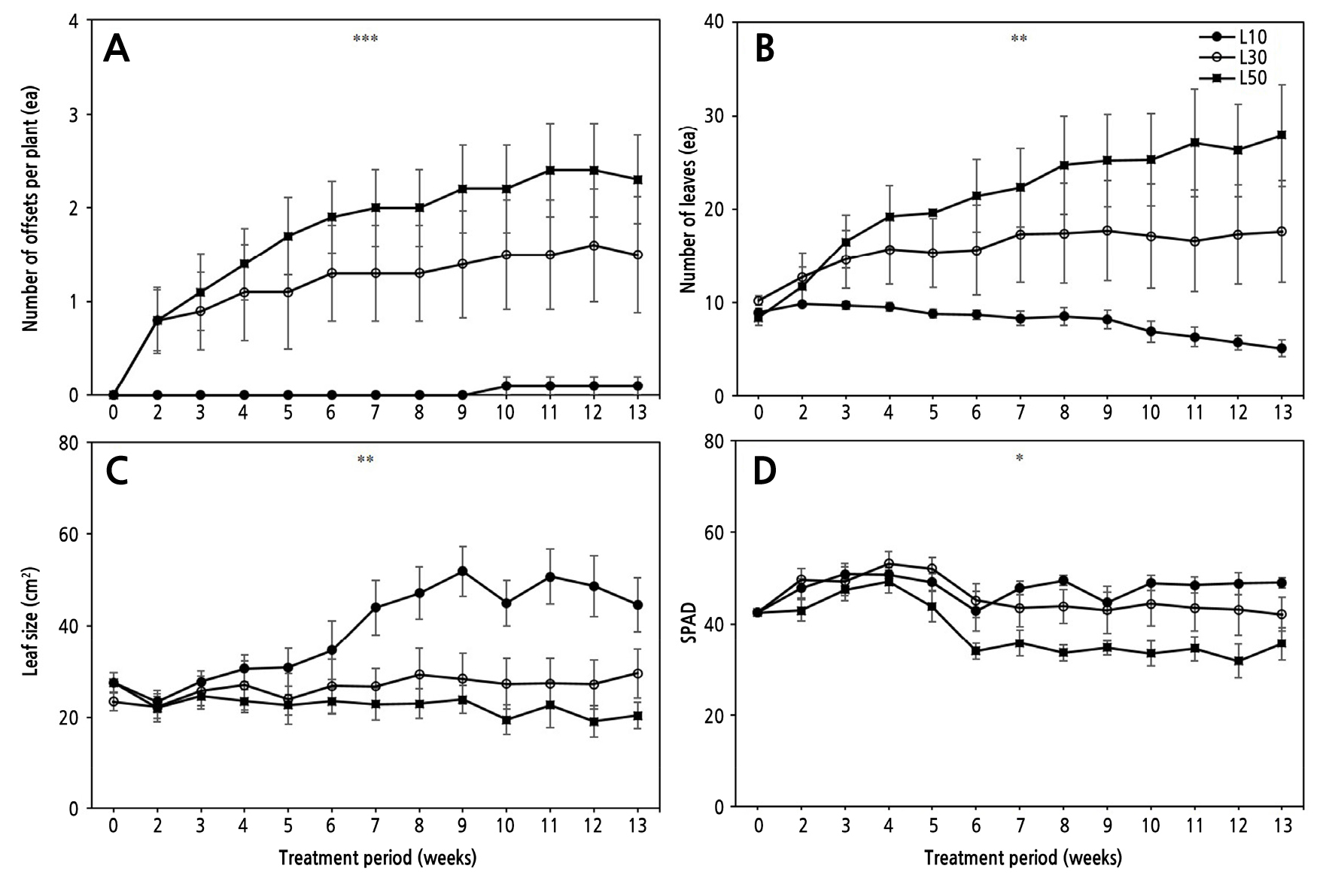
Fig. 2.
Changes in growth indicators of Hosta minor grown under different indoor light intensities during the treatment period. A: number of offsets per plant; B: number of leaves; C: leaf size (length x width); D: SPAD value in leaves. L10: 10 µmol·m-2·s-1; L30: 30 µmol·m-2·s-1; and L50: 50 µmol·m-2·s-1. Vertical bars mean standard error (n = 10). *, **, and *** indicate significant at p < 0.05, 0.01, and 0.001, respectively, by ANOVA.
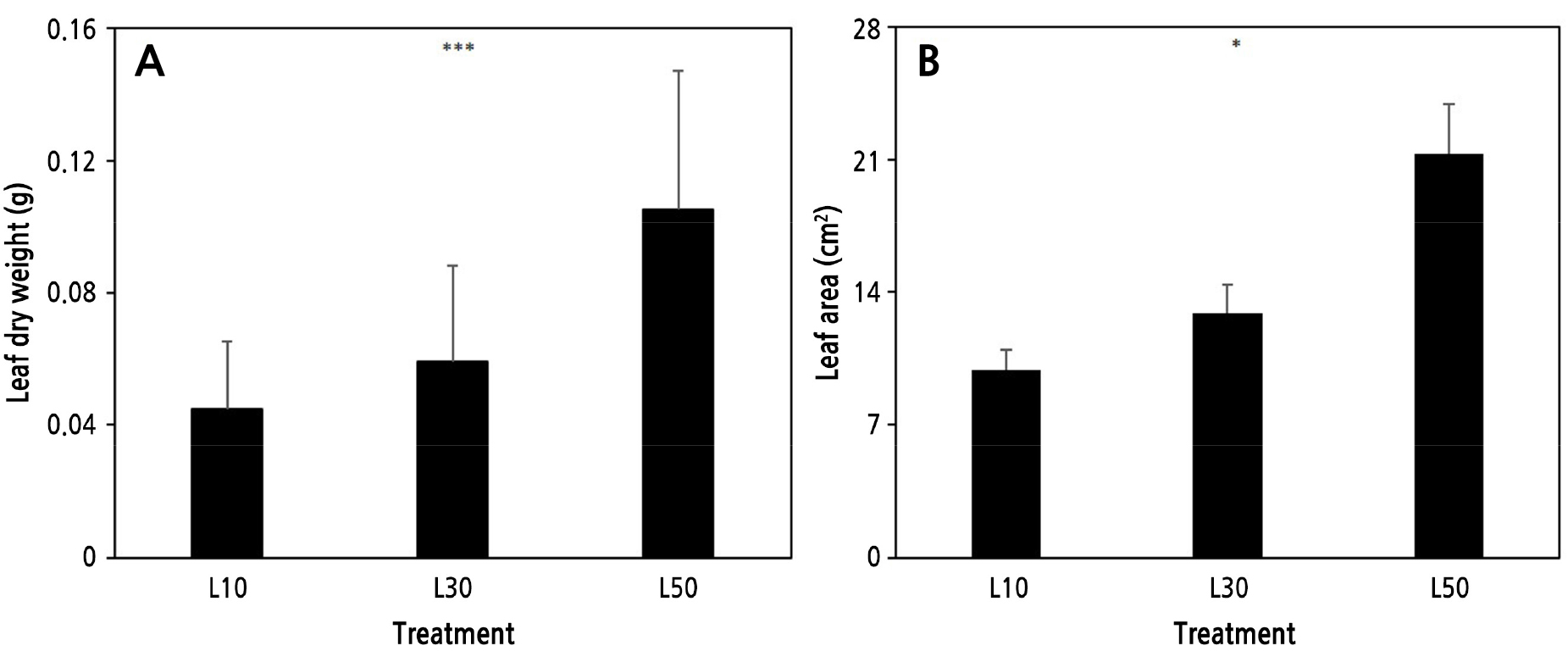
Fig. 3.
Comparison of leaf dry weight (A) and leaf area (B) per plant in Hosta minor grown under different indoor light intensities for 13 weeks. L10: 10 µmol·m-2·s-1; L30: 30 µmol·m-2·s-1; and L50: 50 µmol·m-2·s-1. Vertical bars mean standard error (n = 10). * and *** indicate significant at p < 0.05 and 0.001, respectively, by ANOVA.
광생리적 특성
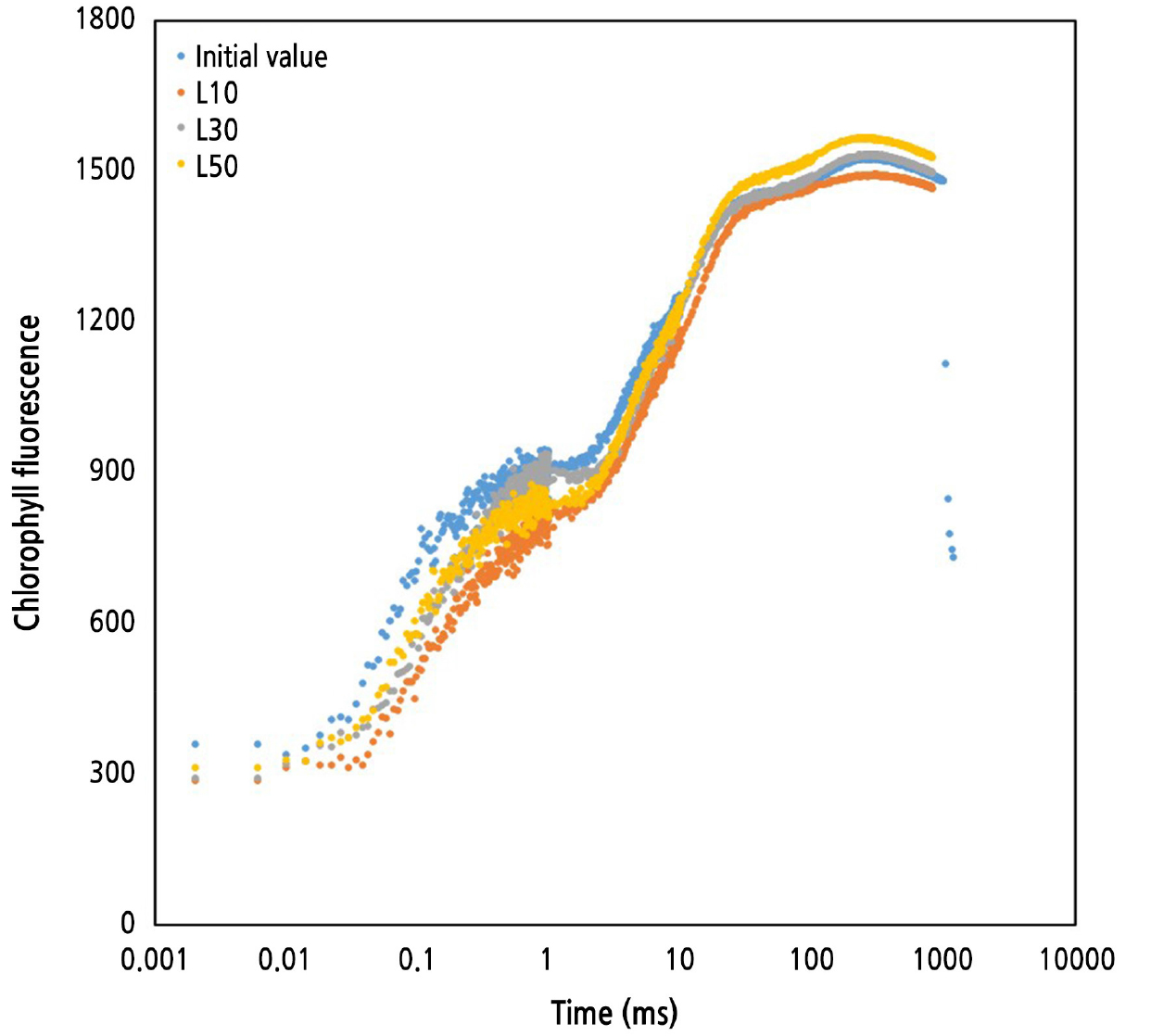
초기값(0주차)과 4주차, 9주차, 13주차 순광합성량과 엽록소형광 매개 변수(F0, Fm, Fv)를 측정하여 최대 광화학적 효율(Fv/Fm)과 OJIP 곡선을 도출하였다. 순광합성량은 엽수, 엽면적, 분얼수 등 생장 반응과 유사한 경향을 보였으나, L10, L30, L50에서 모두 측정 시기에 따라 증감 양상이 유사하였고 이 때 유의적인 차이를 보였다(Fig. 5). 특히 4주차 순광합성량은 초기값(0주차)에 비해 오히려 감소하였으나 9주차에는 현저하게 증가하여 처리간 유의한 차이를 보였다. 13주차에는 L10을 제외하고는 다시 감소하였으며 이는 잎의 노화와 일시적으로 낮아진 실내 기온의 영향으로 추측된다. L10에서 오히려 순광합성량이 증가한 것은 활성산소종의 생성 여부와 관련 있을 것으로 생각된다. 일반적으로 저온 조건에서는 활성산소종이 증가하여 광계가 손상되기 때문에 순광합성량이 저하되지만(Lee et al., 2014), 20µmol·m-2·s-1 이하 조건에서는 식물체의 낮은 광수용량으로 인해 전자전달계를 통한 형광 유도 및 활성산소종 발생이 거의 불가능하기 때문이다(Wen et al., 2005; Torres et al., 2021). 따라서 L10에서 일시적인 저온 스트레스가 발생했음에도 광보상점(9µmol·m-2·s-1, Fig. 8)의 낮은 광도로 인해서 활성산소종에 의한 광계 손상 피해가 없었을 것으로 생각된다.
일반적으로 F0와 Fv/Fm은 광계Ⅱ의 활성을 나타내고 환경 스트레스에 대한 식물의 반응 지표로 이용된다(Sung et al., 2010). F0는 식물체 내 들뜬 광에너지가 광계Ⅱ 반응중심으로 이동하기 전 엽록소로부터 방출되는 형광을 의미하고, Fv/Fm은 광계Ⅱ의 광화학 효율성을 나타내기 때문에(Chung et al., 2004) 식물의 광계Ⅱ가 손상되면 일반적으로 F0는 증가하고 Fv/Fm은 감소한다(Lee et al., 2019b). F0와 Fm은 엽록소 함량에 비례하는 특성을 가지며 건전한 식물 잎에서 나타나는 Fv/Fm은 0.78–0.83 범위로 알려져 있다(Lee et al., 2020; Choi et al., 2022b). 본 실험에서 13주차에 발생한 저온 스트레스는 순광합성량을 감소시켰지만, L10, L30, L50 모두 Fv/Fm은 건전 범위로 나타났다(Table 1). 이것은 실내 저광 및 저온 스트레스가 광계Ⅱ 시스템에 직접적인 손상을 야기하지는 않았으며, 특히 모든 처리구의 OJIP 곡선 패턴이 유사하고 별도의 변형이 없었기 때문에(Fig. 6) L10, L30, L50 모두 광계Ⅱ의 광화학적 반응 효율 차이는 거의 없었던 것으로 판단된다.
Table 1.
Chlorophyll fluorescence in Hosta minor grown under different indoor light intensities for 13 weeks. L10: 10 µmol·m-2·s-1; L30: 30 µmol·m-2·s-1; and L50: 50 µmol·m-2·s-1
| Light intensity | Growth period (weeks) | F0 | Fm | Fv | Fv/Fm |
|
Control (greenhouse) | 4 | 266.28 cdz | 1521.47 b | 1255.19 ab | 0.82 abc |
| 9 | 242.31 e | 1434.66 bcd | 1192.35 bc | 0.83 a | |
| 13 | 252.50 de | 1465.53 bc | 1213.03 bc | 0.83 ab | |
| L10 | 4 | 245.64 cde | 1378.28 def | 1132.64 def | 0.82 d |
| 9 | 246.79 de | 1379.88 c-f | 1133.09 c-f | 0.82 a-d | |
| 13 | 255.82 de | 1423.68 cd | 1167.86 cd | 0.82 a-d | |
| L30 | 4 | 256.45 de | 1445.82 f | 1189.36 f | 0.82 d |
| 9 | 260.30 cde | 1416.50 cde | 1156.20 cde | 0.82 bcd | |
| 13 | 317.65 a | 1519.22 b | 1201.57 bc | 0.79 e | |
| L50 | 4 | 292.39 c | 1454.00 bcd | 1161.61 cd | 0.80 d |
| 9 | 250.33 de | 1335.10 ef | 1084.77 ef | 0.81 cd | |
| 13 | 297.29 b | 1603.21 a | 1305.92 a | 0.81 bcd | |
| Significance | Light intensity (A) | *** | ** | *** | *** |
| Growth period (B) | *** | *** | *** | * | |
| A × B | *** | *** | *** | ** |
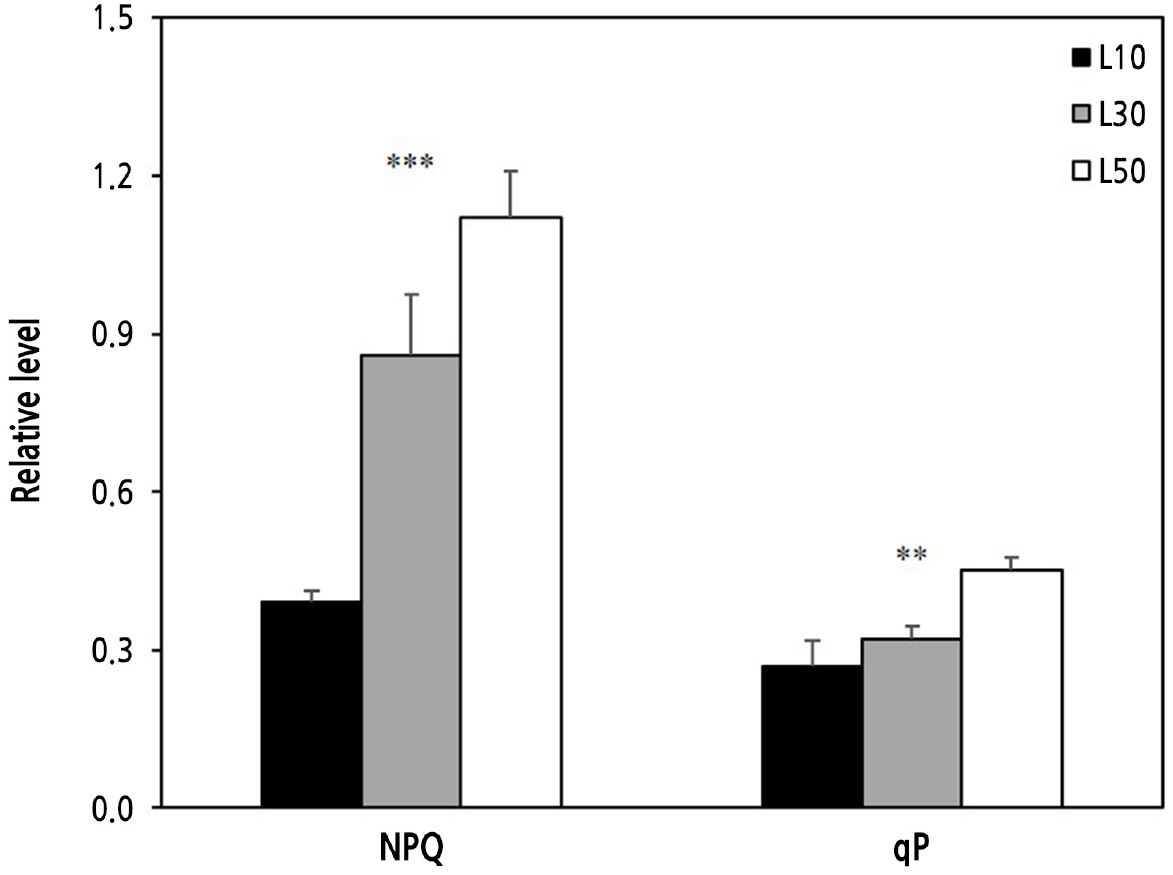
비광화학적 형광소멸 NPQ는 포화상태의 빛 에너지를 열에너지로 방출하여 식물체 내 광 피해 감소를 유도하게 된다(Murchie and Lawson, 2013). 본 실험에서 L10, L30, L50 모두 NPQ가 대체로 낮았지만(0.39–1.12), 광도가 증가할수록 유의적으로 상승했다(Fig. 7). 이것은 좀비비추의 저광 적응과 관련되며, 정상적인 비광화학적 형광소멸 반응을 보였다고 볼 수 있으며, 광도 증가에 따른 NPQ 상승은 정상 범위 내로 판단된다. 전자 전달에 사용되는 에너지인 광화학적 형광소멸 qP는 NPQ와 마찬가지로 정상 수준에서 광도가 높을수록 증가하였다. 따라서 Fig. 4B에서와 같이 L50에서 광이용효율이 가장 양호했던 것은 L50에서 엽록소 함량(SPAD)이 가장 낮았지만(Figs. 2D and 4B) qP는 오히려 가장 높았기 때문으로 해석된다(Fig. 7).
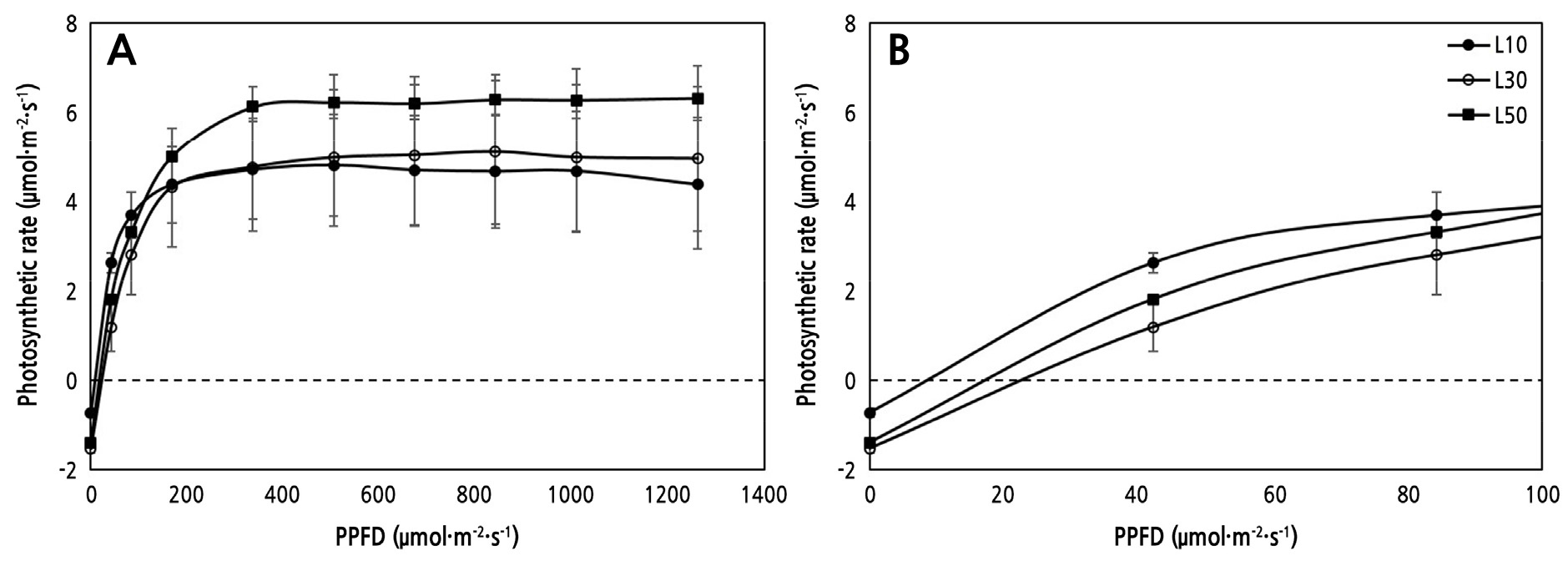
좀비비추의 광보상점은 L10, L30, L50에서 각각 9, 24, 18µmol·m-2·s-1로 광도가 낮을수록 낮아지는 경향을 나타냈고 평균 17 ± 6.16µmol·m-2·s-1로 확인되었다(Fig. 8). 광포화점 역시 각각 200, 300, 350µmol·m-2·s-1로 광도가 높아질수록 증가하였다. 광도가 낮은 환경에서 일반적으로 식물의 광보상점과 광포화점이 낮아지는데, L10의 광도가 광보상점 9µmol·m-2·s-1과 거의 유사하여 L10에서는 실질적인 동화산물 축적이 이뤄지지 않았고 이것이 Fig. 4에서 L10의 일일생장량과 광이용효율이 음의 값을 나타내는 결과를 가져온 것으로 생각된다. 페튜니아(Petunia ‘Pretty Flora’)가 저광에서 광합성 감소에 따른 생체량과 탄수화물 함량이 감소한 결과로 확인할 수 있다(Kwack and Lee, 1999). 따라서 L10에서의 좀비비추와 같이 상대적으로 내음성이 강한 식물도 한계 광도 이하에서는 생장 불량이 불가피한 것으로 나타났다(Lu et al., 2003). 본 실험에서 L10은 광계Ⅱ 손상을 가져오지는 않지만 광보상점 이하 수준으로 생장이 정상적으로 진행되지 않은 것으로 볼 때 10µmol·m-2·s-1의 광량은 좀비비추 생장에 abiotic 스트레스 수준으로 보인다. 결론적으로 좀비비추의 생장 반응과 광 생리적 특성을 고려할 때, 실내 도입 한계 광량은 10–30µmol·m-2·s-1 범위로 판단되며 10µmol·m-2·s-1 이하는 좀비비추 생장에 부적합한 광량으로 생각된다. 한편 좀비비추의 경우 광도 50µmol·m-2·s-1 이하인 실내 환경에 도입할 경우 4주 정도의 적응 기간이 요구되는 것으로 확인되었다.