서 언
재료 및 방법
식물 재료
형태적 특성
종자 발아 특성식물 재료
재식밀도와 수확시기에 따른 작물 특성
플라보노이드 분석
통계처리
결과 및 고찰
형태적 특성
종자 발아 특성
재식밀도별 생육 특성
수확시기별 생육 특성
플라보노이드 함량
서 언
황해쑥(Artemisia argyi H.Lév. & Vaniot)은 국화과(Compositae)에 속하는 다년초로 쑥, 산쑥과 함께 한약재 애엽(艾葉)의 기원식물로 규정하고 있다(Ministry of Food and Drug Safety, 2013). 쑥류는 떡, 국, 음료 등 식품의 부재료로 주로 이용되어 왔으며, 남해군에서는 황해쑥의 품종을 개발하여 지역 특화작목으로 고소득을 올려 주변지역 재배가 점차 확대되고 있는 실정이다.
오래전 한방에서는 황해쑥의 약성은 따뜻하여 기혈을 다스리고 한습(寒濕)을 몰아내며 온경(溫經), 지혈(止血), 안태(安胎) 등의 효능이 있는 것으로 알려져 왔으며, 복부의 병증에 의한 통증(痛症), 설사전근(泄瀉轉筋), 만성하리(慢性下痢), 토혈(吐血), 비출혈(鼻出血), 하혈(下血), 월경불순(月經不順) 등에 이용되어 왔다(Jung and Sin, 1990). 최근에는 분획 및 정제물의 세포소멸, 세포독성에 대한 안전성이 보고된 바 있으며(Jung et al., 2000; Jung and Park, 2002), 간기능 지표효소의 활성 감소를 통한 간보호 효과(Choi et al., 2005), 대식세포의 활성 산소종 감소를 통한 류머티스성 관절염 증상 완화, 염증매개 단백질 생성억제(Park, 2009), 추출물의 살충효과(Zhang et al., 2012) 등의 효능이 과학적으로 입증되었다.
황해쑥의 잎에서 분리된 정유성분 중 플라보노이드는 항산화 작용이 뛰어난 것으로 알려져 있으며, 항암, 항염증 등 다양한 생리활성 기능을 가지고 있다(Kim et al., 2012). 그 중 대표적인 플라보노이드는 apigenin, eupafolin, eupatilin, jaceosidin 등으로 알려져 있으며(Bang et al., 2005; Ryu, 2008a), 특히 eupatilin은 위궤양에 대한 강한 억제작용 및 암세포의 성장 억제 효과로 인하여 천연물 신약개발의 주요 원료로 이용되고 있다(Jang et al., 2003; Kim et al., 2004; Lee et al., 2005; Min et al., 2009; Oh et al., 1997; Ryu et al., 2005; Yoon et al., 2011).
그러나 황해쑥을 포함한 쑥속 식물들은 환경에 따라 형태적 변이가 다양하여 종을 동정하고 분류하는 데 많은 어려움을 가지고 있다. 이러한 문제로 인해 다양한 약리작용과 우수한 생리활성 성분을 함유한 유망자원임에도 재현성 있는 기초적인 연구가 제한되어 왔다. 한편 쑥속 식물을 작물화하기 위한 기초적 연구는 쑥의 지역별, 재배방법별 생육 특성과 주요 약리 성분(Ryu and Hwang, 1996), 쑥속 수집 자원의 생육특성 모형(You et al., 2005), 개똥쑥의 작물학적 특성(Lee et al., 2010), 개똥쑥의 수확시기에 따른 artemisinin 함량 변이(Lee et al., 2013), 산쑥의 재배특성과 플라보노이드 함량(Kim et al., 2013) 등에 관한 연구가 보고된 바 있지만, 황해쑥에 대한 식물학적 또는 작물학적 연구는 부족한 실정이다.
따라서 본 연구는 천연 유용 약리성분을 함유하여 활용가치가 높은 황해쑥의 외부형태, 종자발아 특성과 재식밀도에 따른 수확량을 파악하고, eupatilin, jaceosidin, apigenin의 플라보노이드 함량을 생육 시기별로 분석함으로서, 신소득 약용자원 발굴을 위한 식물학적 및 작물학적 기초 특성 정보를 제공하고자 수행되었다.
재료 및 방법
식물 재료
본 연구에 이용된 황해쑥(Artemisia argyi H. Lév. & Vaniot)은 2007년에 인천광역시 강화군에서 수집하였다. 수집된 자원은 국립원예특작과학원 인삼특작부 유전자원 보존포장에서 포복경 번식방법으로 증식하여 연구시료로 사용하였다. 정확한 식물동정을 위하여 수집된 자원의 일부를 석엽표본으로 제작하여 한국약용자원표본관(Korea Medicinal Resources Herbarium)에 확증표본으로 보관하였다(Voucher number: MPS0003331)(Fig. 1A).
형태적 특성
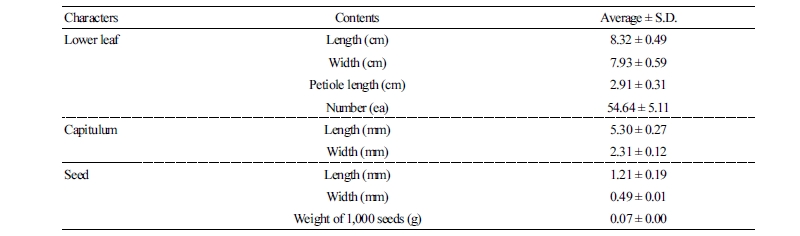
외부 형태적 특성 조사는 황해쑥 개체 10주씩 3반복으로 조사하였으며, 잎의 형태적 특성은 개체당 엽수, 엽장, 엽폭 및 엽병장을 버니어캘리퍼스(Mitutoyo, Absolute 500, Kawasaki, Japan)를 이용하여 측정하였다. 화기의 크기는 8월 상순에 길이와 폭을 측정하였다. 종자특성은 무작위로 20립씩 3반복으로 선정하여 실체현미경(Olympus SZ61, Olympus Co., Tokyo, Japan)으로 형태, 크기와 색 등의 형질을 측정하였다. 천립중은 각각의 종자 1,000립의 무게를 10반복으로 측정한 평균값을 적용하였다.
종자 발아 특성식물 재료
발아시험에 필요한 종자는 전년도 10-11월에 채종하여 상온에 보관한 종자를 현미경을 이용하여 병해충에 오염되지 않고 균일한 크기와 색택이 고른 것을 선별하여 사용하였다. 선별된 종자는 페트리접시에 여과지(Whatman Qualitative Filter Papers)를 깔고 증류수로 적셔준 후 치상하였으며, 각각 15°C, 20°C, 25°C와 30°C로 설정하여 광/암 조건이 16/8시간으로 유지되는 항온배양기(Multi-Room Incubator, Wisecube, Wonju, Korea)에서 발아를 유도하였다. 발아는 정상적인 유아와 유근이 1mm 이상 종피를 뚫고 나온 것을 발아된 것으로 간주하여 발아율(germination rate, GR), 평균발아소요일수(mean germination time, MGT)와 최종 발아율에 대한 50% 발아에 소요되는 일수(T50)를 다음 식에 의하여 산출하였다(Scott et al., 1984; Coolbear et al., 1984).
MGT = Σ(TiNi) / N
Ti: 파종 후 경과일수, Ni: i일에 발아된 종자의 수, N: 총발아수
T50 = Ti + [(N+1) / 2 - Ni] / (Nj - Ni) × (Tj - Ti)
(단, Ni < (N+1) / 2 < Nj)
N: 최종 발아 조사기간까지 발아된 전체 종자수, Ni: N에 대한 50% 직전까지 발아된 종자 수의 합계, Nj: N에 대한 50% 직후에 발아된 종자수의 합계, Ti: Ni 시점까지 소요된 발아기간, Tj: Nj 시점까지 소요된 발아기간
재식밀도와 수확시기에 따른 작물 특성
채종된 종자를 2009년 3월 상순 육묘상에 파종하여 유리온실에서 유묘의 생육을 유도한 후, 5월 10일에 국립원예특작과학원 인삼특작부 시험포장에 정식하였다. 시험포장은 2,000kg/10a퇴비를 전량 기비로 시용한 다음 두둑을 형성하고 검정비닐로 피복하였다. 재식밀도에 따른 생육특성 조사를 위하여 90cm 두둑에 조간을 30cm로 고정한 후, 주간을 10, 20, 30cm 간격으로 식재하였다. 생육특성 조사는 생육이 정지되는 시점인 9월에 전초를 수확하여 실시하였다. 수확시기에 따른 생육특성 조사는 조간 30cm와 주간 10cm 간격으로 정식 후, 7월부터 10월까지 매월 10일에 전초를 수확하여 실시하였다. 시험구는 난괴법으로 3반복을 배치하였으며, 표본은 블록표본 추출법으로 수행하였다. 생육특성은 초장, 직경, 건중량, 근장, 근경 및 수량성을 조사하였다. 수량성 조사는 처리구와 반복별로 1m2를 수확하여 10a당 수량으로 환산하였다.
플라보노이드 분석
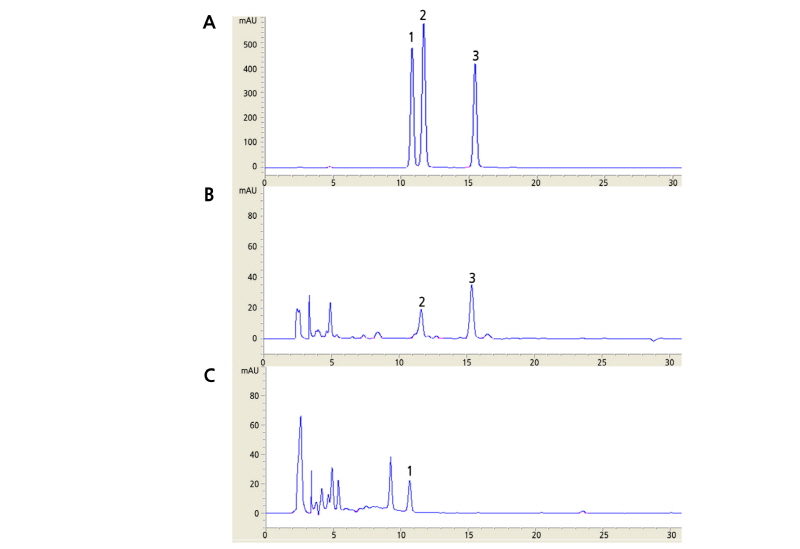
수확시기에 따른 성분 함량의 차이를 알아보기 위하여 2009년 6월부터 10월까지 1개월 간격으로 총 5회 수확하였다. 지하부(지하줄기 및 뿌리) 줄기와 잎으로 구분하여 건조 및 분쇄를 거친 시료 10g을 methanol(MeOH)로 추출하였다. 얻어진 추출물(10mg)에 1mL MeOH를 추가하여 5분간 초음파 추출 후, 원심분리(3,000rpm, 4°C, 5minutes)를 통하여 얻어진 상징액을 여과하여 분석에 사용하였다. 플라보노이드 분석은 u-Bondapak TM C18(10µm, 3.9×300mm, Waters, MA, USA)을 장착한 Agilent 1100 series HPLC system(Agilent Technologies, CA, USA)를 사용하였다. 검출 파장은 354nm, 유량은 1mL·min-1, 칼럼 오븐 온도는 30°C로 설정하였다. 시료는 자동시료주입기를 사용하여 20µL 주입하였다. 이동상은 용매 A[Water:H2PO4 = 99.6:0.4, (v/v)]와 용매 B(acetonitrile)를 사용하였다. 용매 구배조건은 B를 30%로 시작하여 30분까지 70%로 증가시켰고, 40분까지 70%에서 100%로 증가시켰으며, 50분까지 100%에서 30%로 감소 후 5분간 유지하였다. 표준품인 apigenin(Sigma-Aldrich, St. Louis, MO, USA), eupatilin과 jaceosidin(Chengdu Biopurify Phytochemicals Ltd., Sichuan, China)은 MeOH로 희석하여 50, 100, 200, 250과 500µg·mL-1의 표준용액을 조제하고 검량선을 작성하였다(Fig. 2). 각 시료에서 분석된 HPLC peak 면적을 검량선 회귀 방정식에 대입하여 각 성분의 양(µg·mL-1)을 환산하였으며, 수율을 계산하여 정량화(mg/100g of methanolic extracts)하였다.
통계처리
통계처리는 SAS 프로그램(SAS 9.3, SAS Institute Inc., Cary, NC, USA)을 이용하여 난괴법 실험에 대한 분산분석을 수행하였다. 처리 간 유의성 분석은 Duncan`s multiple range test(DMRT, p < 0.05)을 실시하였다.
결과 및 고찰
형태적 특성
황해쑥의 전초, 잎, 줄기, 지하부, 화서 및 종자의 형태적 특성을 관찰하였다(Fig. 1A-G).
잎(leaf)은 근생엽과 경생엽으로 구분되며, 근생엽은 난형으로 5개의 열편으로 갈라져 있고 생육이 진행되면 낙엽하여 생육 후기에는 엽흔만 관찰되었다. 경생엽 중 하부엽은 난형으로 5개의 열편으로 깊게 갈라지며 개화 직전에 시들었다. 뒷면에 백선선점이 다수 분포하여 다른 쑥속 식물과 구별되었으며 흰털이 밀생하는 특성을 보였다. 잎은 호생하며 2회 우상으로 열편이 갈라지며 탁엽이 있는 엽병이 관찰되었다. 하부엽의 평균 길이는 8.3cm 및 폭 7.9cm로 엽맥은 망상맥으로 관찰되었으며, 엽수는 개체당 평균 54.6개로 조사되었다(Table 1).
줄기(stem)는 수직으로 곧게 자라는 직립상의 형태로 초장이 길어짐에 따라 마디 간격이 넓어지는 것이 관찰되었다. 줄기표면에 백색털이 매우 조밀하게 분포하며, 단면은 유관속이 환상(環狀)으로 배치되어 있었다.
지하부(underground part)는 지표면을 따라 수평으로 포복하는 줄기[지하경, stoloniferous rhizome type]가 발달하였으며, 지하경은 마디사이에서 눈이 형성되어 각 식물체로 발달하여 영양번식 종근으로 이용하기도 한다.
화서(inflorescence)는 아래에서 위로 향해 개화하는 무한화서이며, 소화경이 여러 차례로 갈라져서 전체적으로 보면 원뿔 모양이 되는 원추화서의 형태를 나타낸다. 두화형(capitulum shape)은 반종형으로, 총포는 2열∼4열로 배열하였다. 총포의 외편 모양은 모두 난형으로 털이 빽빽한 유모 비막질형으로 관찰되었다. 내편은 장타원형으로 좁은 관 모양의 화형에 화탁은 무모형(無毛形)이었다.
꽃(flower)은 주변화(marginal floret)와 중앙화(central floret)로 구성되어 있다. 주변화는 암술만 존재하는 단성화로 암술머리는 2개로 갈라져 화관 밖으로 나왔으며, 중앙화보다 일찍 개화하였다. 주변화의 화관 표면에는 선모가 존재하는데 유두형으로 관찰되었다. 중앙화는 암술과 수술이 함께 존재하는 양성화였으며, 자방은 임성형이었다. 수술은 약이 모여 통상을 이루는 취약웅예(聚药雄蕊)로 수술이 화주를 둘러싼 관상을 이루었다.
두상화(capitulum)는 8월부터 10월까지 개화되며, 평균 길이 5.3mm와 폭 2.3mm로 관찰되었다. 열매는 털이 없는 수과(achene)로서 얇은 과피를 제거하면 갈색으로 된 타원형의 종자를 얻을 수 있었다. 종자의 평균 길이는 1.21mm, 폭은 0.49mm, 그리고 천립중은 0.07g으로 측정되었다.
종자 발아 특성
온도조건을 15, 20, 25와 30°C로 달리하였을 때 발아율은 각각 52.7%, 18.7%, 18.0% 및 16.0%로 온도가 높아질수록 발아율이 낮아졌다(Table 2). 발아온도 15°C에서 평균발아소요일수는 6.9일로 나타났으며, 20, 25와 30°C에서는 각각 4.6일, 2.8일과 2.4일이었다. 20°C 이상의 발아온도에서는 단기간에 발아가 시작되고 종료되었다. 채종 후 저장 기간 동안 충분한 휴면타파가 이루어지지 못한 상태로 고온에 노출될 경우 수분관리의 문제 등으로 이차휴면을 갖는 경우 있으며, 돼지풀(Ambrosia artemisiifolia L.) 종자는 기온이 상승되는 6월에는 광조건에서도 발아가 이루어지지 않는 결과가 보고된 바 있다(Baskin and Baskin, 1980). 이와 같은 유사한 결과로, 자연조건에서도 토양 내에 유입된 새포아풀(Poa annua L.) 종자의 경우 겨울 혹은 가을의 저온 습윤시기를 거치면서 광과 온도의 요구성이 극복되는 결과에 의한 것으로 보인다(Kim et al., 2001). 저온처리는 수분이 영향을 끼쳐 휴면타파가 빠르게 진행되지만(Kim et al., 1987), 본 연구에서는 채종 후 상온 보관한 종자를 사용하였으며, 이로 인해 보관과정에서 휴면타파와 수분 흡수가 이루어지지 못한 상태에서 고온에 노출되어 발아율이 저하된 것으로 판단된다.
Table 2. Effects of germination temperature on germination indices in Artemisia argyi 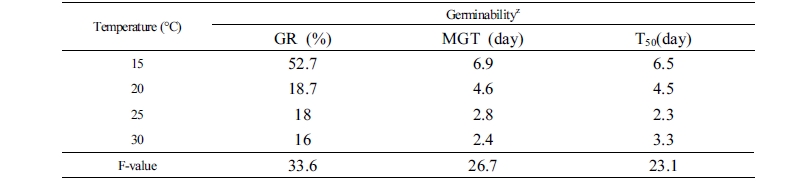 | |
zGR: germination rate; MGT: mean germination time; T50: 50% germination of final germination. | |
발아기는 15°C에서 12일이었으며, 15°C에서는 다소 늦은 발아시를 보였지만 지속적으로 발아하였고 다른 온도보다 발아율이 높았다. 종자발아는 유전성의 차이, 종자의 성숙도, 온도, 수분, 산소 및 광선 등의 환경조건과 깊은 상호관계를 가지며 이중 온도는 발아율과 발아속도에 가장 큰 영향을 주는 요인 중 하나이다(Hwang et al., 2012). 종자의 발아온도와 관련하여 나도생강(Pollia japonica Thunb.)의 종자발아 시 발아율이 특정온도에서 일정하게 유지되고 이 범위를 벗어나면 급격하게 감소되는 것이 보고된 바 있다(Ro et al., 2008). 쑥속 식물인 개똥쑥과 산쑥의 적정 발아온도는 각각 15-20°C와 20-25°C로 이 범위에서 90% 이상 발아한 것으로 보고되었다(Kim et al., 2013; Lee et al., 2013). 본 실험 결과와 비교하여 볼 때, 황해쑥은 개똥쑥 및 산쑥과 비교하여 다소 저온 조건인 15°C가 요구되는 것으로 나타났다. 또한 15°C 조건 하에서도 발아율이 50% 미만으로 개똥쑥(Artemisia annua L. )과 산쑥(Artemisia montana (Nakai) Pamp.)에 비하여 저조한 것으로 나타났다. 따라서 황해쑥 종자의 발아 적정 온도를 고려할 때 월평균 기온이 15°C로 상승하기 전인 4월 중순 이전 노지에 파종하는 것이 증식효율을 높일 수 있을 것으로 판단된다.
재식밀도별 생육 특성
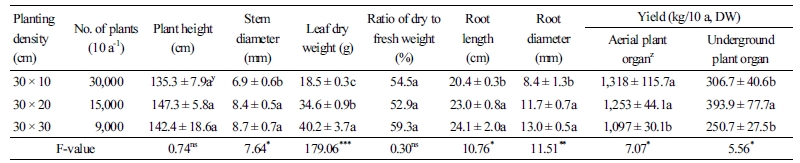
황해쑥의 초장은 135∼147cm의 범위로 조사되었으며, 다른 처리구와 재식거리에 따른 초장의 유의적인 차이는 없었다. 경경, 건엽중, 근장, 근경은 밀식보다 소식일수록 통계적으로 유의하게 증가되었다(Table 3). 개체의 생육특성은 30×20cm와 30×30cm 처리구에서 근장과 근경은 동일한 수준으로 높게 나타났지만 건엽중은 소식 처리구인 30×30cm에서 가장 높게 나타났다. 작물에 따라서 밀식재배는 개체 간의 영양분의 경쟁으로 소식재배에 비하여 생육형질이 낮은 값을 나타내기도 하는데(Byeon et al., 2004), 본 연구에서도 밀식 시 생육 경쟁으로 인하여 개체별 생육 특성이 상대적으로 저조하게 나타나는 것으로 여겨진다. 하지만 단위면적당 수확량은 밀식 처리구인 30×10cm와 30×20cm에서 지상부 수확량이 1,318kg/10a와 1,253kg/10a로 높게 나타났으며, 30×20cm 식재 시 지하부 수확량이 393.9kg/10a으로 가장 높게 나타났다. 동속 식물인 산쑥과 쑥(Artemisia indica Willd.)의 재배 시 밀식처리구에서 수량이 증수되는 것으로 보고하여 본 결과와 비슷한 경향을 나타내었다(Kim et al., 2010; Kim et al., 2013; Lee et al., 2013). 하지만 단위면적당 식재수량을 고려하면 30×10cm 간격으로 식재 시 30×20cm 처리구에 비하여 식재 수량이 2배가 요구되기 때문에, 30×20cm 간격으로 재배하는 것이 식재 수량 대비 높은 수확량을 얻을 수 있을 것으로 여겨진다. 단, 소식재배한 황해쑥은 밀식재배에 비하여 개체당 건엽중과 근경 등의 형질이 우수하게 나타나 수확량과는 별개로 고품질 황해쑥 생산을 위한 식재밀도로 고려해 볼 수 있을 것으로 판단된다.
수확시기별 생육 특성
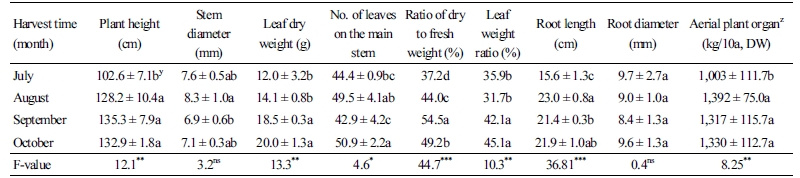
수확시기별 생육 특성과 수량은 재식밀도 30×10cm로 식재하여 7, 8, 9, 10월에 조사하였을 때, 초장, 경경, 건엽중, 엽수, 엽중량 비율, 근장 및 수확량에 있어 유의적인 차이를 나타내었다(Table 4). 초장은 8월에 128.2cm로 생장한 이후 유의적인 차이가 나타나지 않았다. 경경과 근장은 8월에 각각 8.3mm와 23.0cm로 가장 높았으며, 건엽중은 9월과 10월에 18.5와 20.0g으로 높게 나타났다. 이러한 결과는 식물체의 부피생육이 8-9월에 집중된 후 10월까지 유지되기 때문으로 여겨진다. 한편 근경은 생육기간 동안 유의적인 차이를 나타내지 않았다.
지상부 수확량은 1,392kg/10aDW로 8월 이후 동일한 수준으로 유지되었다. 이와 같은 생육은 7월 상순 이후 장마로 충분한 수분과 일조량이 생장에 영향을 주었기 때문으로 판단되며, 8월 하순 개화기 이후부터는 생장이 다소 정지된 것으로 판단된다. 개화기에는 하부엽의 고사가 일어나는 것이 관찰되었으며, 9월에 엽수의 감소는 이와 관련된 것으로 판단된다. 이와 같은 결과는 7월 하순에 화기가 형성된 사철쑥(Artemisia capillaris Thunb.)의 생체중과 건물중이 8월 하순에 가장 높게 나타난 결과와 같은 맥락으로 여겨진다(Choi et al., 2007). 10월 이후에는 잎의 고사가 빠르게 진행되어 이후 더 이상의 생육조사는 무의미하였다.
플라보노이드 함량
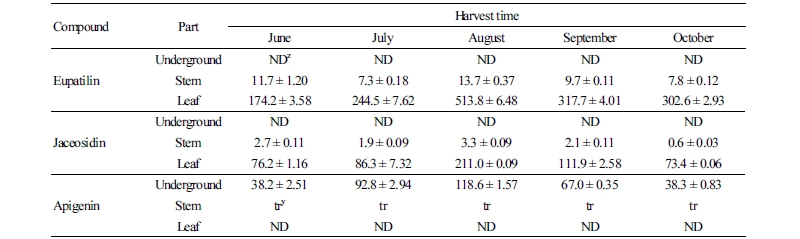
일반적으로 쑥은 다양한 플라보노이드를 함유하고 6-methoxy flavonoid의 공통 구조를 가지고 있다고 알려져 있으며, 에탄올로 추출한 황해쑥의 총 플라보노이드 함량은 3.6 mg·g-1로 보고된 바 있다(Choi et al., 2005). 유파티린(eupatilin)은 쑥류의 플라보노이드 성분 중 위궤양에 대한 치료효과로 알려져 있으며(Oh et al., 1997), 사자발쑥에서 추출·분리하기 위하여 LC-CE-MS로 정성분석을 통해 확인되었다(Jin et al., 2005). 자세오시딘(jaceosidin)은 항염증 효과로 보고된 바 있으며(Kim et al., 2008), 아피제닌(apigenin)과 함께 우리나라에 자생하는 쑥(Artemisia indica)에서 동정되었다(Lee et al., 1999). 아피제닌은 샐러리, 파슬리, 백리향, 피망, 양파, 상추, 베리류 등의 식물에 포함되어 있으며, 항암효과에 대한 연구가 수행된 바 있다(Patel et al., 2007). 본 연구에서도 3종의 플라보노이드 성분이 황해쑥으로부터 검출되었다(Fig. 2).
수확시기와 부위별 플라보노이드 3종의 함량을 비교한 결과, 시기별로는 8월에 가장 높은 성분함량을 보였다(Table 5). 지하부(지하줄기 및 뿌리)에서는 아피제닌 함량이 다른 시기에 비하여 8월에 높게 나타났으며, 잎과 줄기에서는 유파티린과 자세오시딘의 함량이 다른 시기에 비하여 높게 나타났다(Table 5). 아피제닌은 줄기와 잎에서는 검출되지 않으며 지하부(지하줄기 및 뿌리)에서만 검출되었는데, 6월 38.2, 7월 92.8 및 8월 118.6mg/100g DW으로 점차 함량이 증가한 후 감소하였다. 8월에 수확된 줄기에서 유파티린과 자세오시딘 함량은 각각 13.7과 3.3mg/100g DW으로 다른 시기에 비하여 높은 함량을 나타내었으며, 잎에서는 각각 513.8과 211.0mg/100g DW으로 시기별로 비교하였을 때 상대적으로 많은 양이 검출되었다. 이후 감소하여 10월에 수확한 줄기에서 유파티린과 자세오시딘 함량은 각각 7.8과 0.6mg/100g DW으로 최초 수확한 6월에 비하여 낮게 나타났다. 잎에서는 유파티린과 자세오시딘이 각각 302.6과 73.4mg/100g DW로 유파티린 함량은 최초 수확기에 비하여 높게 나타났으나 자세오시딘은 최초 수확기와 비슷한 수준으로 나타났다.
식물은 강수와 기온 등 기후적 환경조건이나 수확시기에 따라 유효성분의 변화를 가져온다(Lee et al., 2000; Ryu, 2008b). 본 연구에서 분석한 3종류의 플라보노이드 성분 중 유파티린의 함량을 증가시키기 위한 재배 조건에 대한 연구가 쑥속 식물에서 수행된 바 있다. 유파티린의 함량은 재배지역 간의 환경조건의 차이(Ahn et al., 2012; Ryu, 2008b) 및 약쑥의 상위엽과 하위엽 등 엽부착 부위별 함량의 차이가 존재하지만, 자세오시딘은 엽부착 부위에 따른 함량 차이가 없는 것으로 조사되었다(Ryu et al., 2005). 하지만 다양한 지역에서 재배하여 유파티린 고함량 황해쑥을 생산하기 위하여 유파티린이 고함유된 적정 수확시기를 제시할 필요가 있다.
본 연구에서 황해쑥의 주요 플라보노이드 성분들이 6월부터 8월까지 함량이 증가하였으며 개화 이후 감소하는 경향이 나타났다. 플라보노이드와 알테미신의 함량은 개화가 완전히 이루어지는 시기에 가장 높게 나타났다는 연구가 개똥쑥에서 보고(Baraldi et al., 2008)된 바 있으며, 사철쑥 연구에서도 capillarisin 함량이 개화시기까지 증가하였으며 이후 감소하였다는 연구 결과(Choi et al., 2007)와 같은 흐름으로 보인다. 이외에도 식물은 개화기를 기점으로 다양한 활성이 변화하기 때문에 시기를 고려하여 수확할 필요가 있다(Hwang et al., 2009).
본 연구에서 지상부가 주로 약용으로 이용되는 황해쑥의 지하부에서 플라보노이드 중 아피제닌 성분이 다른 부위에 비하여 높게 검출었으므로 뿌리 이용 가능성에 대한 구체적인 검토가 요구된다. 또한 이 연구에서 구명된 재식밀도, 수확시기 및 유효성분 함량의 관계를 기초로 황해쑥의 신규 소득작목화 가능성을 제시하였으며, 농가재배 시 유용한 정보로 활용될 것으로 판단된다.