서언
재료 및 방법
실험 재료
포자의 발아
전엽체의 증식
포자체의 형성
배양환경, 조사방법 및 통계처리
결과 및 고찰
포자의 발아조건
전엽체 증식을 위한 배지의 종류
전엽체 증식을 위한 sucrose의 농도
전엽체증식을 위한 질소급원의 농도 및 비율
포자체형성을 위한 배양토의 종류
서언
양치식물은 전세계적으로 10,000여 종 이상 자생하고, 국내에는 350종이 분포하여 식용, 약용 및 관상소재로 이용되고 있다 (Korea National Arboretum, 2008; Kang and Jung, 2012). 대부분의 양치식물은 내음성이 강하기 때문에 실내∙외 조경에서 녹 음을 연출하는 관상소재로 이용되며, 초화류 및 지피식물과 더불어 하부식재의 소재로 이용되고 있다Sh(im et al., 2011).
면마과(Dryopteridaceae) 관중속(Dryopteris)의 참지네고사리(D. nipponensis Koidz.)는 상록성으로 산지의 숲에 자생하고 잎이 풍성하며 표면에 광택이 나는 특성을 가지고 있어, 조경소재로의 개발가치가 높다(KBIS, 2016). 또한 참지네고사리의 추 출물은 항산화 및 항당뇨 활성을 보인다는 연구(Kim et al., 2012; Chi et al., 2015)가 진행된 바 있어, 기능성 생물소재로도 개 발가치가 높다
일반적으로 양치식물은 무성세대와 유성세대가 교번하는 특이한 생식습성을 가지고 있으며, 유성세대의 경우 성숙한 포자 엽(sporophyll)의 포자낭(sporangium)에서 형성된 포자가 방출되고 적합한 환경조건에서 발아되면 어린 전엽체(prothallium) 로 발달한다. 이후 성숙된 전엽체에는 생식기관인 장란기(archegonium)와 장정기(antheridium)가 형성되고, 생식세포인 정자 와 난자가 수정 후 접합체로 발달하면서 어린 포자체가 형성된다. 포자체(sporophyte)는 성숙한 식물체로 발달하면서 다시 포 자를 형성하여 반복되는 생활환을 가지고 있어, 종자식물문과 달리 식물체를 얻기까지 많은 시간이 요구된다(Lee, 2000; Moran, 2004; Korea Fern Society, 2005). 따라서 양치식물 재배농가에서는 봄과 가을에 근경을 분주하는 방법에 의존하여, 효 율적인 대량번식이 어려운 실정이다
최근에는 다양한 종에서 조직배양을 도입한 증식방법들이 연구되어 왔으며, Dryopteris crassirhizoma, D. varia, D. fragrans, Athyrium niponicum, Asplenium vidalii 및 Osmunda japonica 등에서 전엽체 증식 및 포자체 생산을 위한 방법을 제시하고 있다(Fernandez et al., 1997; Oh and Lee, 2002; Jeong and Lee, 2006; Shin and Lee, 2011; Cho et al., 2015; Jang et al., 2015). 따라서 본 연구는 차후 수요가 급증할 것으로 기대되는 참지네고사리의 기내 포자발아, 전엽체 증식 및 포자체 형성에 적합한 배지 및 배양토 등 생육단계별 증식조건을 구명하고 균일묘를 생산하고자 수행되었다.
재료 및 방법
실험 재료
2013년 1월 24일에 전라남도 완도군 신지면 일대에서 참지네고사리 식물체를 채집하여 청주시의 무가온 비닐하우스에 정 식한 다음 성숙기인 6월 중순에 포자엽을 수확하였다. 포자엽은 7일간 종이상자에 넣어 음건한 후 100μm의 sieve(Chunggye Co., Korea)로 포자만 분리한 다음 4±1°C의 저온저장고에 보관하면서 발아실험에 사용하였다. 이후 발아실험에서 획득한 전 엽체를 MS배지(Murashige and Skoog, 1962)에 8주 간격으로 계대배양하면서 전엽체 증식 및 포자체 형성의 실험재료로 사 용하였다.
포자의 발아
포자의 소독 및 접종방법은 Jeong and Lee(2006)와 Shin(2007)의 연구방법을 변형하여 수행하였다. 정선된 포자 50mg을 15mL 코니칼 튜브에 넣어 1차 증류수로 24시간 침지하였다. 이후 3분간 원심분리(HA-12, Hanil Sci. Ind. Korea)하여 상징액 을 150mm 파스퇴르 피펫(Hilgenberg, Germany)으로 제거한 다음 1.4% sodium hypochlorite를 첨가하여 13분간 소독하였다. 원심분리를 반복하여 소독액을 제거한 다음 무균작업대에서 멸균수로 3회 세척하였으며, 50mL 코니칼 튜브로 옮겨 멸균수 40mL를 첨가한 다음 희석 후 사용하였다. 배지는 변형 Knop(1865) 배지와 농도를 1/8, 1/4, 1/2, 1배로 달리한 MS배지를 각각 30mL씩 페트리접시(90×15mm, 10090, SPL Life Sciences Co. Ltd., Korea)에 분주하였으며, 포자 희석액과 멸균수를 각각 1mL씩 배지에 접종하였다. 포자발아의 조사는 접종일로부터 2일 간격으로 32일 동안 실시하였고, 실체현미경(Eclipce E600,Nikon, Japan)을 이용하여 가근이 돌출된 포자를 기준으로 계수하였으며, 발아율%()로 수치화 하였다.
전엽체의 증식
포자에서 획득한 전엽체를 실험의 재료로 사용하고자 8주 간격으로 MS배지에 계대배양하면서 전엽체를 증식하였다. 확보 된 전엽체를 재료로 전엽체 증식을 위한 배지를 선발하고자, 1/8, 1/4, 1/2, 1, 2배로 조절한 MS와 Knop배지를 재료로 하였으 며, 선발된 배지의 종류를 기본으로 sucrose를 각각 0, 1, 2, 3, 4%로 첨가하여 sucrose가 전엽체의 증식 및 형태형성에 미치는 영향을 알아보고자 하였다. 또한 배지의 구성물질 중 질소급원의 총 농도와 비율을 달리하여 전엽체에 질소급원이 미치는 영 향을 구명하였다. MS배지의 stock solution 조성 중 질소원으로 첨가되는 NH4NO3와 KNO3의 stock 용액을 조절하여 질소급 원의 총 농도(NH4+:NO3-=1:2)를 각각 30, 60, 120mM로 조절하였으며, 질소급원의 비율은 NH4Cl와 KNO3를 사용하여 각각 0:60, 20:40, 40:20, 60:0mM로 달리한 배지를 조성하였다. Sucrose의 농도별 실험을 제외한 모든 배지는 sucrose 3%를 첨가 하여 사용하였다. 모든 실험은 200mL 배양병에 각 배지를 30mL씩 분주한 다음 전엽체를 300mg씩 메스로 다져서 접종하였 으며 멸균수 1mL를 첨가하였다. 배양 8주 후 꺼내어 전엽체의 형태형성을 관찰하고, 생체 증가량을 분석하였다
포자체의 형성
기내 계대배양된 전엽체는 배지를 제거하고 다찌가렌(Hymexazol 30%, Dongbu Agrotech, Korea) 1,000배 희석액에 1시간 동안 침지하여 살균한 다음 5회 수세하였다. 수세한 전엽체 1.0g과 증류수 25mL를 플라스틱 비커에 넣고 핸드 블렌더(V- 8000, Boowon, Korea)로 10초간 분쇄하였다
배양토는 원예용 상토(Hanareum no. 2, Shinsung Mineral Co. Ltd., Korea), 피트모스(Sunshine, Sun Gro Hort., Canada), 펄 라이트(Newpershine no. 2, GFC. Co. Ltd., Korea), 마사토(2mm, Samgye Masato, Korea)의 비율을 달리한 8종류의 배양토를 사용하였다. 배양토를 75×75×83mm 사각화분(Cosmo Corporation, USA)에 담아 503×335×195mm 플라스틱상자 (SPC532, SH Plastic, Korea)에 배치하였다. 이후 분쇄한 전엽체를 토양표면에 균일하게 접종하였으며, 저면관수를 실시하고 상부에 유리판을 덮어 상대습도(72±2%)를 유지하였다. 또한 토양표면에 전엽체의 형성이 시작되면 접합체의 수정을 유도하 기 위하여 1일 1회 두상관수를 실시하였다
배양환경, 조사방법 및 통계처리
포자발아 및 전엽체 증식의 배양환경은 온도 25±1°C, 광량 30±1.0μmol·m-2·s-1, 광주기 16/8시간으로 조절되었으며, 발아 후 전엽체의 발달과정 및 형태형성은 실체현미경( SZ51, Olympus, Japan)을 이용하여 관찰하였다
포자체 형성의 배양환경은 온도 25±1°C, 광량 43±2.0μmol·m-2·s-1, 광주기 16/8(light/dark)시간으로 조절되었으며, 14주 간 재배하였다. 이후 처리별로 본엽과 뿌리가 정상적으로 형성된 포자체의 수를 계수하였으며, 균일한 포자체 10개체를 선발 하여, 생체중, 건체중, 초장, 초폭, 엽장, 엽폭, 엽수 및S PAD(SPAD-502, Minolta, Japan)의 값을 조사하였다.
모든 실험은 4반복으로 수행하였으며, 평균과 표준오차 범위를 구하고 SAS version 9.3(SAS institute Inc., USA)의 Duncan’s multiple range test를 이용하여 p<0.05 수준에서 유의성을 검정하였다.
결과 및 고찰
포자의 발아조건
참지네고사리 포자는 모든 배지조건에서 80% 이상 발아가 진행되어, 배지의 종류와 농도에 관계없이 발아력이 우수하였다 (Fig. 1A). 발아개시는 모든 배지에서 4일로 조사되었으며, 1/2MS와 Knop배지의 초기발아속도는 다른 배지에 비해 빠른 상 승세를 나타내었다. 발아된 포자는 전엽체로 발달하는데, Ramirez-Trejo et al.(2013)의 보고에서와 같이 포자의 발아는 가근 의 돌출과 함께 시작하여 초기분열조직인 원사체(protonema)로 발달하고, 이후 원사체의 세포는 지속적으로 종적분열하며 실 모양의 필라멘트형 전엽체로 발달하였다. 한편 필라멘트형 전엽체는 엽록체를 풍부하게 가지고 있으며, 전엽체의 정단세포에 서 횡적분열이 발생하여 넓은 판모양으로 발달하였다.
참지네고사리의 발아된 포자로부터 전엽체의 형태형성을 관찰한 결과, Knop배지에서는 전엽체로의 발달이 가장 빠르게 진 행되었으며, 필라멘트, 판 형태의 분열조직 및 다수의 가근이 관찰되었다(Fig. 2A). 반면 MS계통의 배지에서는 전엽체로의 형 태형성이 다소 억제되었는데, 특히 1/2MS배지에서는 가근의 길이가 짧고, 초기분열의 시작단계인 필라멘트형 원사체에 머물 러 동일기간 동안 Knop배지에 비해 전엽체로의 발달이 미진하였다(Fig. 2B).
Knop배지는 필수 다량원소를 포함하며, MS배지에 비해 구성물질이 낮은 농도로 조성되었다(George et al., 1987). 최근 연 구에 따르면, 동일 속인 D. crassirhizoma Nakai와 D. fragrans (L.) Schott의 포자를 Knop배지에 파종하였을 때 발아 및 초기 전엽체의 발달이 우수하였다는 보고(Cho et al., 2015; Jang et al., 2015)가 있으므로 참지네고사리는 포자발아 후 전엽체로의 발달 및 초기생육에 높은 농도의 구성물질을 요구하지는 않는 것으로 생각되었다. 따라서 참지네고사리의 포자는 Knop배지에 파종하는 것이 포자발아에 요구되는 기간을 단축하며, 형태형성이 우수한 전엽체를 획득할 것으로 생각되었다.
Fig. 1.
Effect of culture medium on spore germination ofD ryopteris nipponensis Koidz. Bars represent standard error (n=4). zMean separation within columns by Duncan's multiple range test (p < 0.05). Final germination percent (A) and germination rate by days after sowing (B). Abbreviations: MS, Murashige and Skoog medium.
Fig. 2.
Responses to different culture media and formation of sexual organs from prothallus of Dryopteris nipponensis Koidz. Knop medium (A) and ½ Murashige and Skoog (MS) medium (B). Abbreviations: mz, meristematic zone; p, plate; pr, protonema; rh, rhizoid.Scale bar = 250 μm.
전엽체 증식을 위한 배지의 종류
전엽체 증식에 적합한 배지를 선정하고자 종류 및 농도를 달리한 배지에 접종한 결과, Knop배지에서 생체중이 5.8g으로 초 기 접종량 대비 19.3배가 증가하였다(Fig. 3). 반면 MS 계열의 배지에서는 2MS 배지에서 생체중이 0.5g으로 가장 적었으며, 1, 1/2, 1/4 및 1/8 MS배지에서는 생체중이 1.2-3.0g으로 낮은 수준이었다. 한편 1/8MS 배지는 Knop 배지와 마찬가지로 구성 물질의 농도가 낮게 조성되었지만 생체중의 증가량은 상반된 결과를 보였는데, 이는 배지를 구성하는 물질의 종류에 따른 차 이로 생각되었다.
전엽체의 형태 및 기관의 발달을 관찰한 결과, 모든 처리구에서 판 형태의 분열조직으로 발달하였으며, 1/4, 1/2, 1MS 및 Knop배지에서는 가근의 돌출도 확인되었다(Fig. 4). 판 형태로 분열된 전엽체는 1MS를 제외한 모든 처리가 주걱형의 형태를 갖췄으며, 1MS는 심장형의 전엽체 형태가 관찰되었다. 또한M S 계열의 배지에서는 구성물질의 농도가 낮은 경우 전엽체가 갈변되는 경향이었으며, 특히 1/8MS배지에서 일부가 괴사반응을 보였다. 한편 1MS배지에서는 전엽체의 생식기관인 장정기 가 확인되어 성숙한 전엽체로의 발달이 진행되었으므로, 추후 포자체의 발생이 촉진될 수 있는 배지종류로 생각되었
동일 속의 D. varia (L.) Kuntze와 D. uniformis f. coreana H.lto는 MS배지에서 전엽체의 증식이 활발하였으며, Osmunda regalis의 전엽체는 무기물질의 농도가 적은 Knop배지에서 생육이 왕성하였다(Fernandez et al., 1997; Fernandez and Revilla, 2003; Jeong et al., 2006; Shin, 2007). 따라서 영양물질의 요구도는 종마다 다소 차이가 있는 것으로 생각되었다. 본 연구의 결 과, 참지네고사리 전엽체의 증식에 적합한 배지는 생식기관이 발생하여 포자체 형성에 유리할 것으로 생각되는 1MS배지로 판 단되었다.
전엽체 증식을 위한 sucrose의 농도
선행 연구에서 선발된 1MS 배지의 sucrose의 농도를 달리한 다음 전엽체를 300mg씩 접종하여 8주간 배양하였다. 연구의 결과, 1%와 2% 처리구에서 생체중이 각각 6.0, 6.2g으로 무처리에 비해 현저히 높았으며, 3%와 4% 처리구에서는 무처리구와 유의미한 차이가 없었다(Fig. 5).
처리별 전엽체의 형태형성은 0-3% 처리구에서 가근이 돌출된 판 형태로 분열되었으며, 심장형(1, 3%)과 주걱형(0, 2%)의 전엽체로 발달되었다. 또한 1, 2 및 3% 처리구에서는 생식기관인 장정기의 형성이 확인되었다(S. 1). 특히 2% sucrose 처리구 에서는 다수의 장정기가 관찰되어 포자체로의 발달이 유리할 것으로 생각되었다. 한편 4% 처리구에서는 다수의 branch 구조가 확인되었으며, 전엽체의 비정상적인 발달이 관찰되었다. 이는 고농도의 sucrose가 원사체 세포의 분열 및 발달을 억제하였 으며, 분열이 억제된 세포들이 긴 branch 형태로 뭉쳐진 것으로 생각된다(Fernandez et al., 1997).
Fig. 3.
Effect of culture medium on prothallus growth of Dryopteris nipponensis Koidz. cultured for 8 weeks. Vertical bars represent standard error (n = 4). zMean separation within columns by Duncan's multiple range test (p < 0 05). Abbreviations: MS, Murashige and Skoog medium.
Fig. 4.
Responses to different culture media and formation of sexual organs from prothallus of Dryopteris nipponensis Koidz. Abbreviations: an, antheridium; br, browning; hg, heart-shaped gametophyte; rh, rhizoid; sg, spatulate gametophyte; ut,unicellular trichome. Scale bar = 0.5 mm.
Fig. 5.
Effect of sucrose concentration on prothallus fresh weight of Dryopteris nipponensis Koidz. cultured for 8 weeks. Vertical bars represent standard error (n = 4). zMean separation within columns by Duncan's multiple range test( p < 0.05).
Fig. 6.
Effect of total nitrogen concentration on prothallus fresh weight of Dryopteris nipponensis Koidz. after 8 weeks in culture. Vertical bars represent standard error (n = 4). zMean separation within columns by Duncan's multiple range test( p <0.05).
Sucrose는 콩과 및 난과 식물의 뿌리형성을 유도하고, 양치식물에서는 전엽체의 생육을 촉진하는 영양분으로 이용되어 왔 으며, Pteris tripartita Sw.의 전엽체는 sucrose의 농도가 증가할수록 생육이 촉진되었다고 보고된 바 있다(Dewir et al., 2015; Ravi et al., 2015; Dewir et al., 2016). 반면 Asplenium vidalii의 전엽체는 sucrose 1-2%를 첨가한 배지에서 생육이 증진되었 다(Oh and Lee, 2002). 본 연구에서 참지네고사리 전엽체는 배지 내에 sucrose를 첨가하지 않거나 고농도로 첨가하였을 때 생 육뿐만 아니라 생식기관의 형성까지 억제되는 것을 알 수 있었다. 따라서 배지 내 sucrose 농도는 2%로 조절하는 것이 참지네 고사리 전엽체의 생육 및 기관형성에 적합한 것으로 판단되었다 .
전엽체증식을 위한 질소급원의 농도 및 비율
MS배지의 구성물질 중 질소급원의 총 농도를 달리하여 전엽체를 접종한 결과, 30, 60 및 120mM 처리구에서 생체중이 초 기 접종량 대비 각각 17.0, 15.7 및 14.3배 증가하였으나, 농도 간의 유의적인 차이는 없었다(Fig. 6). 또한 모든 처리구에서 전엽 체가 판 형태로 분열한 다음 심장형(60, 120mM)과 주걱형(30mM)의 전엽체로 발달되었으나, 30과 60mM처리구에서만 생식 기관인 장정기가 관찰되었다(S. 2). 특히 60mM 처리구에서는 30mM 처리구에 비해 다수의 장정기를 확인할 수 있었으므로, 질소급원의 첨가가 참지네고사리 전엽체의 생육을 촉진하는 데 효과적이며 적정 질소급원의 총 농도는 60mM로 생각되었다.
Melan and Whittier (1990)의 연구에서도 Botrychium dissectum의 전엽체 배양에 질소급원(NaNO3, NH4Cl)을 처리하였을 때 무처리구에 비해 전엽체의 생육이 증진되었으나 높은 농도에서는 생육이 감소된 바 있어, 본 연구에서 확인된 질소급원의 효과와 유사하였다.
질소급원의 총 농도를 60mM로 고정한 다음 NH4 +와 NO3- 간의 농도 비율을 달리하여 전엽체를 배양한 결과, 질소급원을 20:40 및 40:20mM로 조절한 배지에서 전엽체의 생체중이 각각4 .7, 4.6g으로 가장 컸으나, 유의적인 차이는 없었다(Fig. 7).
반면 0:60 및 60:0mM로 한 가지 질소급원만 사용한 배지에서는 혼용한 배지에 비해 전엽체의 증식이 유의적으로 억제되었다. 처리별 전엽체의 발달을 관찰한 결과, 모든 처리에서 판 형태의 전엽체로 분열하였으며 주걱형(0:60mM), 심장형(20:40, 40:20, 60:0mM)의 전엽체로 발달되었다. 또한 질소급원을 20:40mM로 조절한 처리구에서는 장정기의 발달이 확인되었다(S. 3). 고란초 과(Polypodiaceae)의 Gymnogramme calomelanos 전엽체는 질소급원인 NH4 +를 단독으로 처리하였을 때 비정상적으로 발달하였 으며, D. erythrosora 전엽체는 NH4 +와 NO3-를 혼용하였을 때 정상적으로 발달하였다(Miller, 1968).
본 연구의 결과, 참지네고사리 전엽체의 정상적인 발달 및 생육을 위해서는 질소급원의 혼용이 효과적이며, 질소급원 중 NH4 +에 비해 NO3- -의 비율이 높을 때 생식기관의 발달에 긍정적인 영향을 미치는 것으로 생각되었다. 따라서 질소급원의 총 농 도를 60mM로 고정하고 질소급원의 비율을 20:40mM로 조절하는 것이 참지네고사리 전엽체의 생육 및 생식기관의 발달에 적합한 조건으로 판단되었다.
Fig. 7.
Effect of NH4+ and NO3-ratio on prothallus of Dryopteris nipponensis Koidz. after 8 weeks in culture. Vertical bars represent standard error (n = 4). zMean separation within columns by Duncan's multiple range test.( p <0.05).
포자체형성을 위한 배양토의 종류
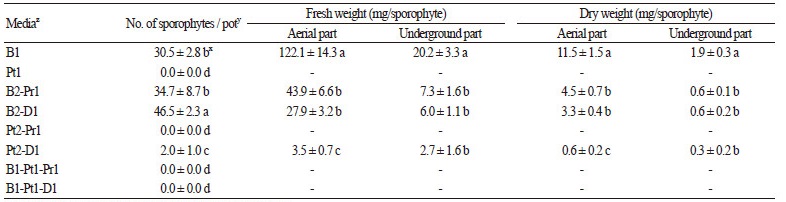
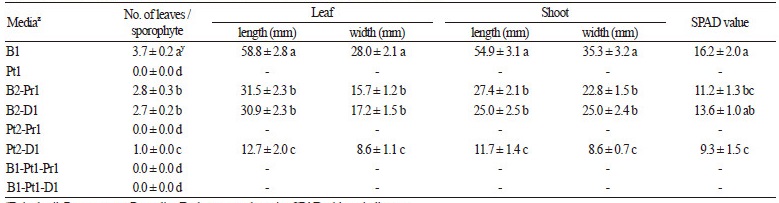
배양토의 종류를 달리하여 전엽체를 배양한 결과, 원예상토를 단용 또는 혼용한 처리구에서 포자체의 형성과 생육이 우수하 였으며, 특히 원예상토:마사토 2:1(v:v)의 혼용 처리구에서 포자체의 형성이 0.83개(cm2 당)로 가장 많았다. 다음으로 원예상 토:펄라이트2:1(v:v) 혼용 처리구와 상토를 단용한 순으로 각각 0.62, 0.54개(cm2 당) 발생하였으며, 두 처리구간의 유의적 차 이는 없었다(Table 1). 특히 원예상토를 단용한 처리구에서는 원예상토:마사토를 2:1(v:v)로 혼용한 것에 비해 지상부와 지하 부의 생체중 및 건체중이 유의적으로 우수하였으며, 초장, 초폭, 엽수, 엽장, 엽폭 및 SPAD의 측정값도 모두 높은 수치를 기록 하였다(Table 2).
본 연구에서 원예상토를 첨가한 처리구의 포자체 발생 및 생육의 촉진은 토양 내의 다양한 화학적 특성이 영향을 미친 것으 로 생각되었다. 그 중 원예상토와 마사토를 혼용한 처리구에서 포자체의 발생이 가장 우수하였는데, 이는 원예상토의 화학적 특성과 마사토 입자의 물리적 배수성이 포자체의 발생 및 생육에 유리한 기상환경을 제공한 것으로 생각되었다. 마찬가지로 펄 라이트도 마사토와 유사한 배수성을 제공한 것으로 보인다(Kim and Kim, 2011). 원예상토는 다양한 유기 및 무기성 재료를 혼 합한 것으로 다량원소, 미량원소, EC, pH, NH4-N, NO3-N 및 유효인산 등을 포함하고 있으며, 이와 같은 화학적 특성은 식물 생육에 적합한 영양상태를 결정한다고 알려져 있다( Gabriels et al., 1986; Lee et al., 2006).
Kim and Kim(2011)의 연구에서 피트모스의 함량이 높을수록 식물생육에 유리한 공극률을 유지한다고 보고된 바 있으나, 본 연구에서는 토양 내 피트모스의 비율이 높을수록 전엽체 형성 및 포자체의 발생이 현저히 억제되었다(Table 1). 이와 같은 결과는 높은 공극률과 보수력을 지닌 피트모스로 인하여 토양 내의 함수율이 증가하면서 기상률이 감소하여 전엽체와 포자체 의 생육에 부정적인 영향을 미쳤을 것으로 생각되었다. Gruda and Schnizler(2004)는 식물 생육에 적합한 토양조건으로 토양 내의 적정 공극률과 기상률의 수치는 각각 85% 및 20-30%, 20-30%이며, 통기성과 보수력의 적합한 균형이 요구된다고 보 고하였다.
따라서 참지네고사리의 포자체 형성에는 원예상토와 마사토를 2:1(v:v)로 혼용한 배양토가 적합하며, 추후 육묘 시 원예상 토의 비율을 높인다면 포자체의 생육을 촉진할 수 있을 것으로 생각되었다. 또한 재배의 편의성을 고려하여 본 연구에서와 같 이 저면관수를 실시할 경우 피트모스는 혼용하지 않는 것이 좋을 것으로 판단되었다.