서 언
재료 및 방법
실험재료
플러그 트레이 셀 크기와 파종 립 수에 따른 육묘기 생육
저면관수 간격에 따른 육묘기 생육
양액의 EC 수준에 따른 육묘기 생육
조사항목
통계분석
결과 및 고찰
플러그 트레이 셀 크기와 파종 립 수에 따른 황기의 생육
관수 간격과 관수 시간에 따른 황기의 생육
양액의 EC 수준에 따른 황기의 생육
서 언
황기는 콩과에 속하는 다년생 식물로 아시아, 유럽 및 아프리카 지역에 널리 분포하며, 우리나라에서는 전국에서 재배가 가능하다(Im et al., 2010). 황기는 서늘한 기후에서 잘 자라며, 강원도 정선과 삼척, 충청북도 제천 등 산간지방에서 주로 재배되어 왔지만, 최근 수요가 증가되어 경기도 포천, 여주 등 중북부 평야지에서도 활발히 재배가 이루어지고 있다(Kim et al., 1996a, Kim et al., 1996b). 예로부터 황기는 지한, 이뇨 및 혈압 강하 등의 효능이 있는 것으로 알려져 있으며, 한방에서는 대표적인 보기약으로 이용해 오고 있다(Lee et al., 2008). 황기의 뿌리에는 isoflavonoids와 saponin의 일종인 astragaloside가 함유되어 있으며, 특히 isoflavonoids 성분은 phytoestrogen의 일종으로 미백, 주름개선과 같은 노화방지 효과가 있어 화장품의 원료로 사용하기 위한 연구가 진행된 바 있다(Kim et al., 2002; Kim et al., 2004).
일반적으로 황기는 다년근의 뿌리를 한약재로 이용하지만, 점차 보양식으로 소비가 확대되어 수요를 맞추기 위해 1년근을 수확하는 사례가 증가하여 종자의 수요 또한 증가하고 있는 추세이다. 하지만 Kim et al.(2001)은 황기 종자의 저장기간이 길어질수록 경실종자의 수가 많아져 종자의 발아율 저하와 함께 활력이 낮아진다고 보고한 바 있다. 이러한 문제를 해결하기 위해 황기의 발아율 증대를 위한 파종시기, 종자의 저장기간 등에 관한 연구가 진행된 바 있지만(Song et al., 2010; Choi et al., 2013), 아직까지 많은 농가에서 황기의 직파재배를 이용하고 있으며, 약용작물 황기의 종자 사용 효율 증대, 균일하고 안정적인 황기의 생산을 위한 공정 육묘 방법에 대한 연구는 미비한 실정이다.
공정 육묘방법은 묘의 균일도와 생장속도를 높이고, 작물의 생산 시기를 조절할 수 있을 뿐만 아니라, 묘의 생장속도가 빠르고, 종자의 소모를 줄이며, 정식 효율성을 높일 수 있는 장점이 있다(Calson et al., 1992). 국내의 육묘산업은 1990년대에 들어 전문적으로 공정묘가 생산되기 시작하여 육묘산업이 확장되었고, 이후 시설재배의 면적이 증가하면서, 육묘 시설의 규모화, 자동화, 생력화 및 묘의 규격화로 산업의 크기가 확대되고 있다(Shin et al., 2000; Yeoung et al., 2002).
공정묘의 묘소질과 정식 후 생산성은 육묘일수, 플러그 셀의 크기, 관수 및 비배관리 방법 등의 다양한 요인에 영향을 받는다(Kim et al., 2001; Yu et al., 2002; Jeong et al., 2016). Oh et al.(2014)은 약용작물인 차조기, 산두근, 참당귀는 육묘 시 플러그 셀이 커질수록 생육이 우수하다고 보고하였으며, Mo et al.(2014)은 인삼의 하우스 직파 재배 시 단위 면적 당 파종 립 수가 많아질수록 입모율은 높아지지만, 지하부의 생육이 감소한다고 보고하였다. 뿐만 아니라, 관수 방법과 양액의 EC수준 또한 공정묘의 생육에 영향을 미치는 중요한 요인이며, Lee and Suh(2009)는 양파의 벤치육묘 시 1일 1회 관수를 하는 것이 양파 공정묘의 생육과 자구생산에 양호한 결과를 나타냈다고 보고하였다. 양액의 EC수준 또한 여러 작물을 이용하여 연구된 바 있다(Choi and Lee, 2001; Park et al., 2017; Kim et al., 2018). 이처럼 작물에 있어 적정 관수량과 양액의 EC수준에 따라 생육에 차이가 나타날 뿐만 아니라 적정 관리방법이 다르기 때문에 육묘 시 적절한 비배관리와 관수 방법이 필요 하지만, 약용작물 황기의 묘소질 향상을 위한 육묘방법에 관한 연구는 진행되지 않은 실정이다. 따라서 본 연구는 약용작물 황기의 육묘 시 플러그 트레이 셀 크기, 파종 립 수, 관수 간격과 양액의 EC수준을 구명하기 위해 수행 되었다.
재료 및 방법
실험재료
황기(Astraglus membranaceus, Danong Co., Seoul, Korea)종자를 128구(21mL/cell, 8 × 16cell), 200구(10mL/cell, 10 × 20cell), 288구(9mL/cell, 12 × 24cell) 플러그 트레이(Bumnong. Co., Ltd, Korea)에 각각 파종 하였다. 실험에 사용된 황기 종자의 발아율은 Table 1과 같다. 사용된 플러그 트레이의 규격은 54 × 28 × 4.8cm로 모두 동일 하였다. 모든 실험에서 배지는 상업적 공정육묘용 상토(Tosilee, ShinanGro. Ltd., Jinju, Korea, 코이어 50%, 피트모스 25%, 질석 10%, 펄라이트 10%, 제오라이트 5%)를 사용하였고, 양액은 온실다용도 액비[Ca(No3)2·4H2O 472.5mg·L-1, KNO3 252.5mg·L-1, KH2PO4 67.5mg·L-1, NH4NO3 40mg·L-1, MgSO4·7H2O 247.5mg·L-1, Fe-EDTA 11.1mg·L-1, H3BO3 1.3mg·L-1, MnSO4·H2O 1.0mg·L-1, CuSO4·5H2O 0.1mg·L-1, ZnSO4·7H2O 0.1mg·L-1, NaMoO4·2H2O 0.03mg·L-1]를 이용하였으며(Oh et al., 2014), 양액의 pH와 EC는 휴대용 pH/EC 측정기(HI 98130, HANNA Instruments Inc., Woonsocket, USA)를 이용하여 조절하였다. 플러그 셀 크기와 파종 립 수, 관수 간격, 그리고 양액의 EC 수준에 따른 3개의 실험이 각각 독립적으로 수행되었다.
Table 1. Germination characteristics of Astragalus membranaceus
| Initial germinationz (%) | Final germinationy (%) | MDGx |
| 31.0 | 51.8 | 3.7 |
yFinal germination: germination percentage at the 17th day after the sowing.
xMDG: mean daily germination (number of total germinations/total measuring days).
플러그 트레이 셀 크기와 파종 립 수에 따른 육묘기 생육
적정 플러그 트레이 셀 크기 구명을 위해 128구, 200구, 288구의 플러그 트레이에 각 1립씩을, 셀 당 적정 파종 립 수 구명을 위해 셀크기가 가장 컸던 128구 플러그 트레이에 각 1립, 2립, 3립씩을 파종하였다. 발아는 파종 후 17일간 실시하였으며, 실험은 경상대학교 시설원예학 연구실의 밀폐형 식물생산 시스템(CH1200H3, FC Poibe Co. Ltd., Seoul, Korea)에서 온도 25 ± 1°C, 상대습도 60 ± 10%, 광도 130 ± 10µmol·m-2·s-1 PPFD, 광주기 18/6시간(명기/암기)으로 관리하였다. 육묘기 동안 양액은 최종 발아가 이루어졌던 파종 후 17일째부터 19일간 온실다용도액비를 이용하여 EC 1.0dS·m-1 및 pH 6.5로 맞추어 저면관수 하였다.
저면관수 간격에 따른 육묘기 생육
저면관수 횟수와 관수시간에 따른 황기 묘의 생육을 확인하기 위해 플라스틱 상자(35 × 55 × 12.5cm)와 유체펌프(UP 500, Hyubshin Co. Ltd., Seoul, Korea)를 이용하여 간이 수경재배 장치를 제작한 후, 저면관수 방식으로 관수 하였으며, 관수간격을 1일, 2일, 그리고 3일 간격으로 1회 처리하였고, 관수시간을 1, 2, 3분으로 각각 처리하였다. 황기는 128구 트레이에 셀 당 1립씩 파종하여 밀폐형 식물공장(L 7.7m × W 2.5m × H 2.7m, Green Industry Co. Ltd., Changwon, Korea)에서 온도 20 ± 1°C와 광주기 0/24(명기/암기)으로 6일간 발아 시켰으며, 발아 후 유리온실에서 29일간 육묘 하였다. 육묘기 동안 양액은 최종 발아가 종료된 이후부터 온실 다용도 액비를 이용하여 EC 1.0dS·m-1 및 pH 6.5로 맞추어 관주 하였다.
양액의 EC 수준에 따른 육묘기 생육
양액의 EC 수준에 따른 황기의 육묘기 생육을 확인하기 위해 128구 플러그 트레이를 이용하여 셀 당 1립씩 파종 후 10일간 발아 시켰다. 양액은 최종 발아 이후 온실다용도 액비를 EC 1.0, 1.5, 2.0, 2.5, 3.0, 3.5dS·m-1의 6수준으로 맞추어 파종 후 10일째부터 23일간 2일간격으로 2분씩 저면관수 하였다.
조사항목
황기의 초기발아율(initial germination)과 최종발아율(final germination)은 각각 파종 후 5일과 17일 까지 발아된 종자수를 조사하여 계산하였으며, 평균 발아수(MDG, mean daily germination)는 발아된 종자수를 조사한 날의 수로 나누어 계산하였다. 묘의 생육은 초장, 엽장, 엽폭, 최대근장, 엽수, 엽면적, 지상부와 지하부의 생체중과 건물중, SPAD 값을 측정하였다. 초장은 지제부에서부터 식물체의 생장점까지의 높이를 측정하였으며, 엽장과 엽폭은 완전히 전개된 4번째 본 엽을, 최대근장은 가장 긴 뿌리의 길이를 측정하였다. 엽수는 떡잎을 제외한 모든 잎의 수를 측정하였다. 엽면적은 엽면적 측정기(LI-3000, LI-COR Inc., Lincoln, NE, USA)를, 지상부와 지하부의 생체중과 건물중은 전자저울(EW220-3NM, Kern&Sohn GmbH., Balingen, Germany)을 이용하여 측정하였다. 건물중은 시료를 70°C 항온 건조기(Venticell-222, MMM Medcenter Einrichtungen GmbH., Planegg, Germany)에서 72시간 건조한 후 측정하였다. SPAD 값은 엽록소 측정기(SPAD-502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 측정하였다. 엽록소 형광분석은 생장점으로부터 3번째 잎을 이용하여 각 실험의 최종생육조사와 같은 날짜에 처리별 6개체를 선발하여 30분간 암적응 후 엽록소 형광분석기(PAM-2100, Heinz Walz GmbH Co. Ltd., Effeltrich, Germany)를 이용하여 엽록소형광 값(Fv/Fm)을 측정하였다. 최소 형광 값(Fo)은 0.6kHz의 측정 광을 광섬유로 하여 0.1mol·m-2·s-1보다 낮은 PPFD로 LED광을 이용하여 조사하고 측정하였으며, 최대 형광 값(Fm)은 20kHz로 7,000µmol·m-2·s-1의 포화 광을 0.8초 동안 조사하여 측정하였다. Fv/Fm값은 Fv/Fm = (Fm-Fo)/Fm 공식으로 산출되었다(Genty et al., 1989).
통계분석
모든 실험의 시험구 배치는 난괴법으로 처리당 1트레이씩을 3반복으로 배치 하였으며, 묘의 생육은 처리당 12개체씩을 선발하여 조사하였다. 통계분석은 SAS 프로그램(SAS 9.1, SAS Institute Inc., USA)을 이용하여 분산분석(ANOVA)을 실시하였다. 그래프는 Sigma Plot 프로그램(Sigma Plot 12.0, Systat Software Inc., USA)을 이용하여 나타냈다.
결과 및 고찰
플러그 트레이 셀 크기와 파종 립 수에 따른 황기의 생육
파종 후 36일째의 황기의 초장, 경경, 엽면적, 최대근장, 그리고 지상부와 지하부의 생체중과 건물중은 200구와 288구에 비해 128구 육묘 트레이에서 가장 우수하였지만, 엽수와 SPAD 값은 플러그 트레이 셀 크기에 따른 유의적인 차이가 나타나지 않았다(Table 2). 이는 다른 처리구에 비해 128구 플러그 트레이에서 셀의 크기가 더 커, 상토의 충진량이 많아 상대적으로 부피가 크고 작은 셀에 비해 근권 용적이 커짐에 따라 양분이 많이 공급되어 뿌리의 발육에 긍정적인 영향을 미쳤고, 그 결과 지상부의 생육 또한 증진된 것으로 판단된다. 이러한 결과는 Oh et al.(2014)의 연구에서 3종류 약용작물인 차조기, 산두근, 참당귀가 플러그 트레이 셀 크기가 커질수록 육묘기 생육이 증가한다는 결과와 Shin et al.(2000)의 연구에서 고추 육묘 시 플러그 트레이 셀의 크기가 커질수록 묘의 생육이 증진된다는 결과와 일치하였다. 결과적으로, 본 연구 결과에서 황기 묘는 셀 크기가 클수록 생육이 증진되는 결과를 확인하였지만, 셀 크기가 큰 플러그 트레이를 사용하게 될 경우, 단위면적 당 생산되는 황기 묘의 수가 감소하게 되어 128구 플러그 트레이를 이용하는 것이 황기 묘 생산에 유리할 것으로 판단된다.
Table 2. Plug seedling quality of Astragalus membranaceus as affected by different plug cell size measured at 36 days after sowing
셀 당 파종 립 수에 따른 황기의 생육은 Table 3에 나타내었다. 황기 묘의 초장, 경경, 엽면적, SPAD 값, 지상부 생체중과 건물중, 지하부의 생체중은 모두 셀 당 1립 파종 처리에서 유의적으로 높은 수치를 보였지만, 엽수와 근장, 지하부의 건물중은 유의적인 차이가 나타나지 않았다. 본 결과는 셀 당 파종 립 수가 증가할수록 황기 육묘 시 개체간 양분 경합에 의해 생육이 감소한 것으로 판단되며, Lee et al.(1998)은 인삼 파종 시 파종 밀도가 높으면 개체간 경합이 일어나 뿌리 생장이 억제된다고 보고하였고, Mo et al.(2014)은 인삼의 직파 재배 시 파종 립 수가 많아질수록 근장이 짧아지고 근경이 얇아지며, 근중 또한 감소하는 경향을 보였다고 보고한 결과와 일치하였다. 그러므로 황기의 파종시 1셀당 1립씩 파종하는 것이 개체간의 경합이 일어나지 않아 지하부의 생육이 증가 하였으며, 이에 따라 지상부의 생육이 향상된 것으로 판단된다. 하지만 황기 종자는 발아율이 50%로 저조하기 때문에(Table 1), 1셀당 2립씩 파종하고 발아 후에 보식을 실시하여 결주가 없이 황기를 육묘 하는 것이 적절한 방법으로 판단된다.
Table 3. Plug seedling quality of Astragalus membranaceus as affected by number of seeds sown per cell of a tray measured at 36 days after sowing
관수 간격과 관수 시간에 따른 황기의 생육
관수 간격과 관수 시간에 따른 황기의 생육은 Table 4에 나타내었다. 황기의 초장, SPAD 값, 엽록소형광 값, 그리고 지하부의 건물중은 유의적인 차이를 나타내지 않았다. 엽면적과 지상부의 생체중은 관수간격 3일 1회 처리구에서 감소하는 경향을 보였으며, 관수간격 1일 1회, 관수시간 2분 처리에서 유의적으로 높은 값을 나타내었다. Lee and Suh(2009)는 양파의 플러그 묘 생산 시 1일 1회 관수 할 경우 묘의 생육이 우수하고, 자구 또한 비대해 진다고 보고한 바 있다. 본 연구 결과에서 128구 플러그 트레이를 이용하여 저면관수 하였을 때 1분에 비해 2분 동안 관수 해야 배지에 양액이 충분히 흡수되며, 3분 관수 시에는 근권이 과습해져 묘의 생육이 저조했던 것으로 판단된다. 본 연구는 온실내에서 황기 재배에 적절한 관수량과 관수시간을 확인하였지만, 광도와 광량의 변화 및 작물생육 변화에 따른 증발산 변화량을 고려하지 않았기 때문에 이에 대한 추가적인 연구가 필요할 것으로 판단된다.
Table 4. Plug seedling quality of Astragalus membranaceus as affected by irrigation intervals and irrigation times measured at 35 days after sowing
양액의 EC 수준에 따른 황기의 생육
황기 묘의 생육은 2.0dS·m-1의 EC수준에서 가장 우수 하였으며, 2.5dS·m-1이상의 EC수준에서 오히려 생육이 감소하는 경향을 보였다(Fig. 1). 배양액의 EC수준이 높아질수록 식물체 뿌리의 삼투 포텐셜이 낮아져 작물의 수분 흡수량이 적어진다. 또한 지상부의 생육은 광합성을 통해 생성된 동화산물과 뿌리를 통해 흡수된 양수분에 의해 조절되는데(Schonfeld et al., 1988), EC수준이 지나치게 높을 경우 잎의 수분함량, 광합성, 비엽면적 등이 감소한다고 알려져 있다(Lee et al., 1997; Choi and Lee, 2001). 본 연구 결과에서도 이상의 결과와 같이 2.5dS·m-1 이상의 EC수준은 근권부의 삼투압을 상승시켜 육묘기 황기의 생장요인에 영향을 미쳐 생육이 저조하게 나타난 것으로 판단된다. Zhou et al.(2012)의 연구에서 Hoagland 배양액 50%의 농도에서 황기의 생육이 증가한다고 보고 하였지만, 50% 이상의 수준에서의 황기의 생육은 보고되지 않아 황기의 육묘에 적합한 최적의 양액 농도는 제시되지 않았다. 본 연구에서는 황기의 육묘 시 적절한 양액의 EC수준을 제시 하였지만, 향후 황기의 육묘에 필요한 최적 양액 조성에 관한 추가적인 연구가 필요할 것으로 판단된다.
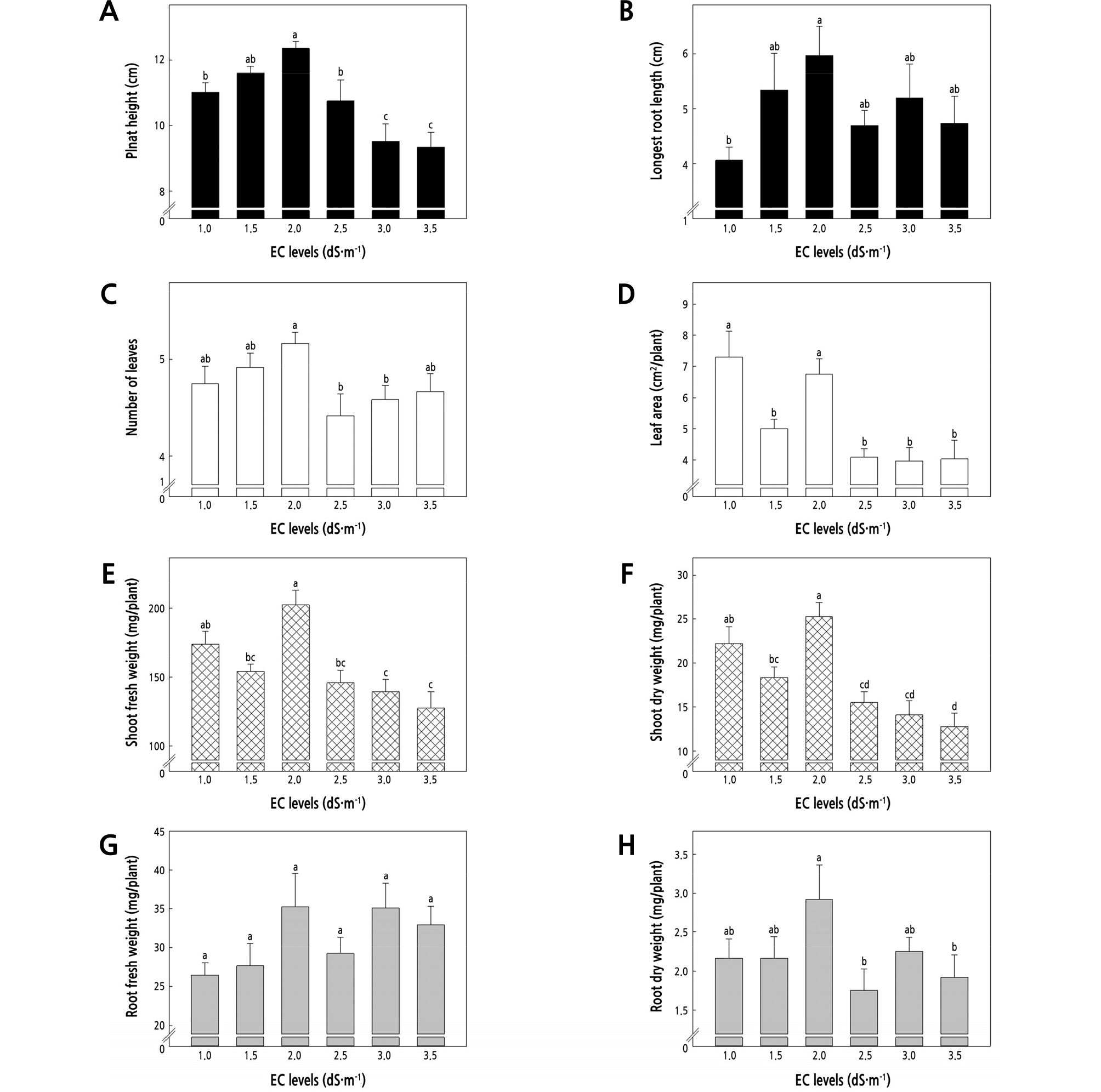
Fig. 1.
Plant height (A), longest root length (B), number of leaves (C), leaf area (D), shoot fresh weight (E), shoot dry weight (F), root fresh weight (G), and root dry weight (H) of Astragalus membranaceus as affected by different EC levels measured at 33 days after sowing. Vertical bars represent the standard error of the mean (n = 12). Different letters in the same column indicate significant differences based on Duncan’s multiple range test (p ≤ 0.05).
본 연구결과를 종합해볼 때, 황기의 육묘 시 적정 플러그 셀 크기와 파종 립 수는 128구 플러그 트레이와 셀 당 2립 파종 후 보식을 실시하며, 양액의 EC를 2.0dS·m-1 수준으로 1일 1회, 2분간 저면관수 하는 것이 묘의 생육증진과 황기 우량묘 생산을 위해 적절할 것으로 판단된다.




