서 언
재료 및 방법
식물 재료
식물생장조정제 처리
과실 생장 및 품질 특성
상온 저장 및 품질 특성
세포 크기와 수
전분 및 가용성 당 분석
통계분석
결과 및 고찰
식물생장조정제 살포 횟수가 과실 생장 및 품질 특성에 미치는 영향
식물생장조정제 살포 횟수가 과실 조직의 확대와 세포 수 및 크기에 미치는 영향
식물생장조정제 살포 횟수가 상온저장 시 후숙 품질에 미치는 영향
식물생장조정제 살포 횟수가 전분 및 가용성 당에 미치는 영향
서 언
키위프루트(kiwifruit)는 중국 양자강 유역이 원산지이며 중국을 비롯하여 뉴질랜드, 이탈리아 등을 중심으로 널리 재배되고 있는 다래나무과(Actinidiaceae) 다래나무속(Actinidia)에 속하는 다년생 자웅이주의 낙엽과수이다(Oh et al., 2011). 키위프루트는 탄수화물, 비타민 A, C, E 및 K, 엽산, 폴리페놀, 마그네슘, 칼슘 등 다양한 영양소를 동반하는 기능성 과실로 알려져 소비가 지속적으로 증가하고 있다(Iwasawa et al., 2011). 키위프루트에는 녹색과육, 황색과육, 적색과육으로 구분되는데 최근 국내외적으로 황색과육 품종의 재배가 급격히 확대되고 있다(Kang et al., 2021). 국내외 시장에서 키위프루트 소비자는 대과를 선호하는 경향이 뚜렷하기 때문에, 과실 크기는 과실 품질에 영향하는 중요한 요인 중 하나이다(Flaishman et al., 2005). 과실 크기는 세포 수와 크기로 결정되는데(Hopping, 1976), 키위프루트의 경우 인공수분 및 종자수, 적과, 여름전정 등 다양한 요인이 작용한다(Malone, 2012). 이들 요인들은 식물호르몬과 관계되어 과실의 크기에 영향을 주게 된다. 그러나 키위프루트에서는 식물호르몬의 직접적인 사용보다는 식물생장조정제의 처리를 통한 대과 생산 연구가 최근 수행되어 왔다(Woolley and Cruz-Castillo, 2006; Childerhouse, 2009; Malone, 2012; Rana et al., 2023). 이들 연구에서는 동일한 제품이라도 품종에 따라 과실 크기 및 품질에 대한 영향이 다르게 나타남을 보고하고 있다.
제주 지역에서는 황색과육 품종으로 국내에서 육성된 ‘스위트골드’와 ‘제시골드’가 주요 품종으로 자리매김하고 있다. 이들 품종들은 제스프리 골드키위의 하나인 ‘선골드’에 비해 과실 크기가 작은 편이다. 그러므로 농가에서는 과실비대를 촉진하기 위해 Benefits®PZ를 널리 사용하고 있는 실정이다. Benefits®PZ 제품은 이탈리아에서 개발된 천연 식물추출물로 소량의 사이토키닌, 핵산, 아미노산, 비타민, 조효소 등을 포함하고 있다. 그러나 ‘Hort16A’의 경우 과실의 크기는 증가했지만 건물률은 저하했으며(Childerhouse, 2009), ‘AU Golden Sunshine’의 경우 과실의 착과 정도에 따라 과실의 크기와 품질에의 영향은 다르게 반응하여 그 효과가 불분명하다고 보고 된 바 있다(Malone, 2012). 현재 제주에서는 농가에 따라 과실비대 식물생장조정제의 처리 횟수가 1–3회로 다양하고, 일부 농가의 경우 과심의 확대, 건물률의 저하, 조기 연화 등에 대한 우려를 나타내고 있음에도 불구하고, 이에 대한 연구가 거의 없는 실정이다.
한편 과실의 세포수는 과실 발달 초기 단계의 세포 분열 횟수와 관계되며, 세포 크기는 과실비대기의 세포 비대와 관계된다(Sugiura and Honjo, 1995; Bohner and Bangerth, 1988). 그러나 키위프루트에서는 식물생장조정제 살포 횟수에 따른 세포 크기와 수에 대해 분석한 연구가 아직 보고된 바 없다. 또한 키위프루트 과실의 전분축적은 과실의 수용부위 활력과 관계되며 성숙 및 후숙 과정 동안 대부분 분해되어 가용성 당으로 전환되는 것으로 알려져 있다(Guixi et al., 1994). 그렇지만 키위프루트에서 식물생장조정제 살포에 따른 전분의 축적 및 성숙 후 가용성 당의 증가와 연화 정도에 대해서도 거의 알려져 있지 않다.
따라서 본 연구는 제주지역에서 주로 재배되고 있는 황색과육의 국내육성 키위프루트 품종인 ’스위트골드’와 ‘제시골드’에서 식물추출물인 식물생장조정제 살포 횟수에 따른 키위 과실의 생장과 품질, 세포 수와 크기, 전분 축적과 가용성 당, 그리고 상온저장에 따른 연화정도에 미치는 영향을 알아보고자 수행되었다.
재료 및 방법
식물 재료
제주특별자치도 제주시에 위치한 농가의 무가온 하우스에서 재배되고 있는 국내육성의 황색과육 키위프루트(A. chinensis var. chinensis) ‘스위트골드’(33º51’N, 126º59’E)와 ‘제시골드’(33º45’N, 126º34’E)를 식물재료로 사용하였다. ‘스위트골드’는 헤이워드 실생대목에 접목되어 6.0 × 4.8m로 재식되었으며 평덕식 2본 주지의 일문자형으로 재식 5년차에 해당된다. ‘제시골드’는 헤이워드 실생대목에 접목되어 6.0 × 5.5m로 재식되었으며 동일한 평덕식 수형으로 재식 12년차에 해당된다. 두 품종 모두 적화, 인공수분, 적과, 여름전정, 시비, 병해충 관리 등은 일반 재배 관리에 준하여 실시하였다.
식물생장조정제 처리
식물생장조정제 처리 농도를 500배액으로 고정하여 만개 후 2주부터 1주일 간격으로 1회 처리(14DAA), 2회 처리(21DAA), 3회 처리(28DAA) 하였고 식물 생장조정제를 처리하지 않은 무처리를 대조구로 두었다. 처리의 반복으로는 수세 및 착과가 비슷한 나무 3주를 임의 선정하여 설정하였다.
과실 생장 및 품질 특성
식물생장조정제 살포 횟수에 따른 과실의 생장 및 품질 특성은 종경, 횡경, 과중, 경도, 가용성 고형물 함량, 산 함량, 건물률, 과심 경도, 과육 색도(hue), 과심길이, 과피 안쪽 및 바깥 부위 길이를 대상으로 만개 후 30일부터 30일 간격으로 나무당 5개씩, 총 15개의 과실을 조사하였으며 수확기(180DAA) 전후에는 10일 간격의 조사를 추가하였다. 종경과 횡경의 측정은 버니어캘리퍼스(CD-20PSX, Mitutoyo Corp., Japan)를 이용하였고, 과중의 측정은 전자저울(EL-2000S, Setra Inc., USA)을 이용하였다. 건물률은 과실의 적도 부분을 2–3mm 두께로 절편을 내어 60°C에서 24시간 건조 후 계산하였다(Burdon et al., 2016). 가용성 고형물 함량과 산 함량은 수확 후 과즙을 이용하여 디지털당산분석기(GMK-707R, G-won Co., Korea)를 이용하여 측정하였고, 경도는 과실 중간 부위에서 1mm 두께를 벗긴 후 측정하였으며, 과심 경도는 과실 중간 부위를 자른 후 과심 부위를 Ø8mm plunger가 부착된 경도계(FHM-5, Takemura Co., Japan)로 측정하였다. 과육 색도(hue)는 과실 중간 부위에서 2–3mm 두께를 벗긴 후 색차계(CR-400 chroma meter, Minolta Co., Japan)를 이용하여 hue 값(h°)을 측정하였고 과심 길이, 과피 안쪽 및 바깥 부위의 길이는 버니어캘리퍼스(CD-20PSX, Mitutoyo Corp., Japan)를 이용하여 측정하였다.
상온 저장 및 품질 특성
‘스위트골드’ 나무당 8개씩, 총 24개의 수확 과실을 20ºC의 암 상태 인큐베이터(KMC-8480MX4, Vision scientific co., Korea)에 넣어 5일과 25일 동안 저장하였다. 저장 후 5일과 25일에 건물률, 가용성 고형물 함량, 산 함량, 경도, 과심경도, 색도(h°) 등의 품질변화를 조사하였다.
세포 크기와 수
과실의 횡단면을 3mm로 절단한 후, formalin:acetic acid:ethyl alcohol(70%) (1:1:18)에 고정시켜 4°C에 보관하였다. 일련의 에탄올 농도처리로 탈수하였으며 Technovit 7100(Kulzer & Co., Hanau, Germany)으로 점진적으로 충진한 후 마이크로톰(RM2165, Leica Co., CA, USA)을 사용하여 5µm로 절단하였다(Yeung and Chan, 2015). 절편은 0.1% aniline blue solution(0.1% aniline blue in 0.1N K3PO4)로 염색한 후 광학현미경(Leica DMRBE, Leica Co., Germany)을 사용하여 2.5배율로 관찰하였다. 과실의 횡단면에서 과심, 과피 안쪽 및 바깥 부위의 세포수는 각 처리 당 1.2 × 1.2mm의 조직 시료 10개를 무작위로 선정하여 계수하였으며, 각 조직의 폭을 평균 세포 수로 나누어 세포의 직경을 계산하였다(Currie, 1997).
전분 및 가용성 당 분석
전분 및 가용성 당 분석은 나무당 3개씩, 총 9개의 과실을 Witchaya et al. (2015)의 방법을 일부 변형하여 수행하였다. 수확 과실 전체를 72시간 동결건조 후에 분말로 마쇄하여 전분 및 가용성 당 분석 시료로 사용하였다. 동결건조 마쇄 분말 시료 1g을 80% 에탄올 10mL와 혼합하고 상온에서 진탕기(BR-30, Taitec Co., Japan)를 이용하여 30분동안 진탕하였다. 4°C에서 10분동안 2,000gn로 원심분리 한 후 70mm 여과지(Toyo Roshi Kaisha, LTD., Japan)로 상징액을 여과시켜 가용성 당 분석시료로 사용하였으며, 여과지에 남은 침전물은 60°C 에서 24시간 건조시킨 후 전분 분석시료로 사용하였다.
가용성 당 시료는 농축기(Laborota 4000, Heidolph, Germany)에서 농축한 후 3mL의 3차증류수로 현탁시켜 C-18 Sep-Pak cartridge(Waters 2695, MA, USA) 및 0.45µm syringe filter (Whatman 6784, Maidstone, UK)로 여과하였다. 여과한 시료는 Shim-pack GIST NH2(4.6 × 250mm, 5µm, Shimadzu, Japan) 컬럼과 RI dector(RID-10A, Shimadzu, Japan)가 부착된 HPLC(LC-20AT, shimadzu, Inc., Japan)를 이용하여 가용성 당을 분석하였다. 이동상으로는 85%(v/v) acetonitrile/DDW를 이용하였고 유속은 1.7mL·min-1로 조절하였다. 전분 정량을 위해 건조 전분시료 0.2g을 18% HCl의 4mL과 혼합한 후 상온에서 30분 동안 정치하였다. 그 후 36mL의 3차 증류수로 희석시킨 후 4°C, 2,000gn에서 10분간 원심분리한 다음, 상징액 25µL와 1.8% HCl 475µL를 섞어준 뒤 Lugol’s solution(0.25 I2, 0.5 KI)을 첨가하여 530nm와 630nm에서 비색계(UV-1900i, Shimadzu, Japan)로 정량하였다(Magel, 1991).
통계분석
통계분석은 SPSS프로그램(SPSS version 22.0; SPSS, Armonk, NY)을 이용하였다. 평균간 유의성 비교는 Duncan의 다중검정으로 실시하였다.
결과 및 고찰
식물생장조정제 살포 횟수가 과실 생장 및 품질 특성에 미치는 영향
식물생장조정제 살포 횟수에 따른 ‘스위트골드’와 ‘제시골드’의 과실 품질 특성을 2021년과 2022년 2년간 조사하였다. ‘스위트골드’와 ‘제시골드’의 종경, 횡경 및 과중 변화에 대한 2년간의 평균값을 Fig. 1에 제시하였다. 2021년과 2022년 수확 시 ‘스위트골드’와 ‘제시골드’는 처리 횟수가 증가할수록 과실 종경, 횡경 및 과중이 증가하는 경향을 나타냈다(Fig. 1). 과실의 생장 정도는 만개 30일 후부터 처리 간에 차이를 보이기 시작하였고, 60일 후에는 더욱 증폭되었으며, 90일 후부터는 그 정도가 어느 정도 정해져서 유지되는 경향을 나타내었다. 식물생장조정제 살포 횟수에 따른 ‘스위트골드’와 ‘제시골드’의 과실 품질 특성을 2021년과 2022년 2년간 조사한 결과를 Table 1과 Table 2에 제시하였다. ‘스위트골드’의 건물률은 2021년과 2022년에서 처리간 차이가 없었고, 수확 시 가용성 고형물 함량은 2021년에는 3회 처리에서 가장 높았으며, 2022년도에는 처리간 차이가 없었다. ‘제시골드’의 건물률과 가용성 고형물 함량은 2021년도, 2022년 모두 2회 처리에서 가장 높은 경향을 나타냈다. ‘스위트골드’의 산 함량은 2021년도에 차이가 없었지만 2022년도에 대조구에서 가장 높았다. ‘제시골드’의 산 함량은 2021년도에 처리간 차이가 없었지만 2022년도에 2회 처리에서 가장 높은 것으로 나타났다. ‘스위트골드’의 과육 경도는 2021년과 2022년 모두 처리간 차이가 없었고, ‘제시골드’의 경우 2021년도에 처리간 차이가 없었지만 2022년도에는 1회 처리에서 가장 높은 것으로 나타났다. ‘스위트골드’의 과심 경도는 2021년도에 대조구와 3회 처리에서 가장 높았으며, 2022년도에는 2회 처리와 3회 처리에서 가장 높았다. ‘제시골드’의 과심 경도는 대조구 와 3회 처리에서 가장 높았다. ‘스위트골드’의 과육 색도(hue)는 2021년에 2회 처리에서, 2022년에는 대조구에서 가장 낮았고, ‘제시골드’의 경우 2회 처리에서 가장 낮게 나타났다.
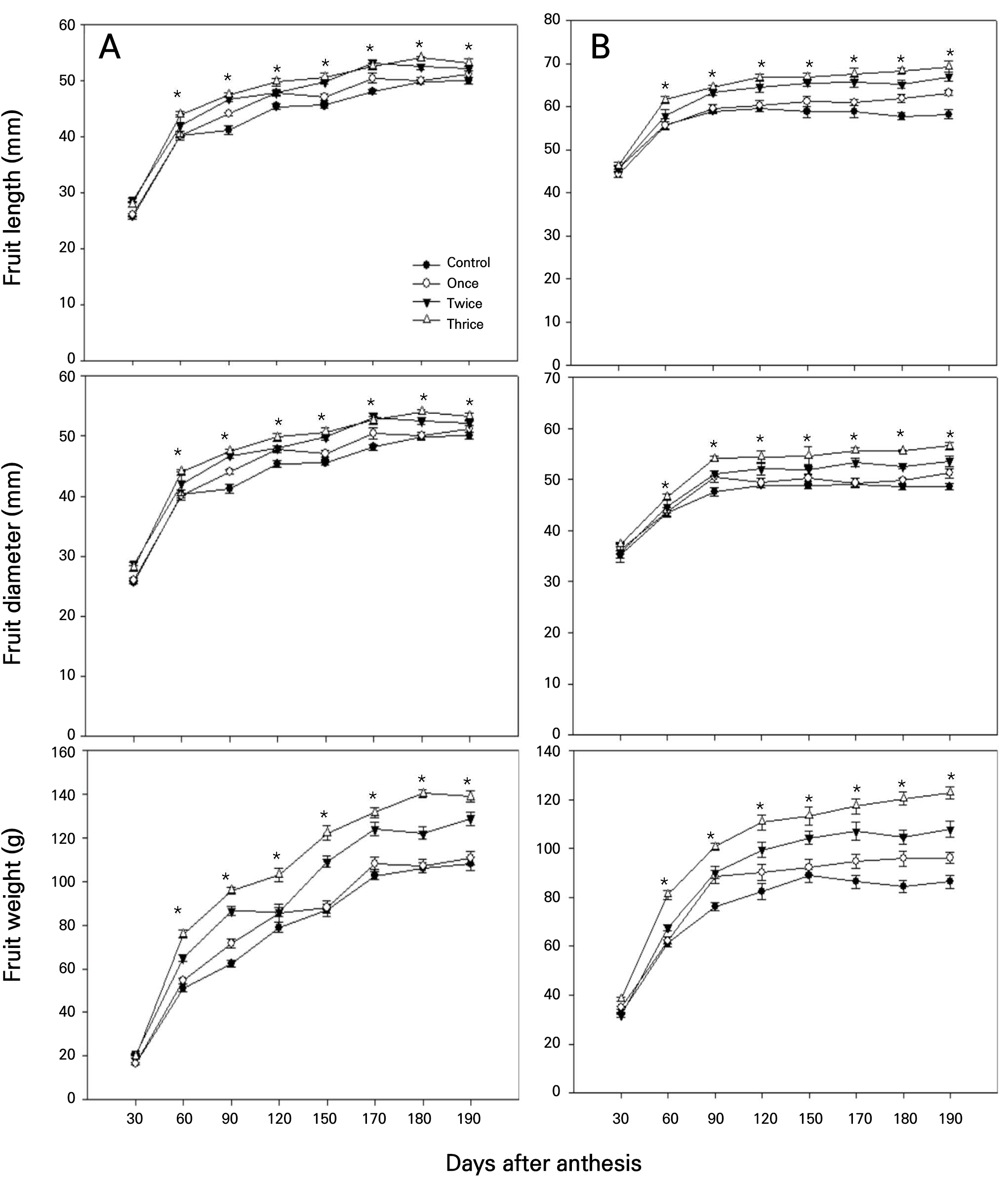
Fig. 1.
Changes of fruit length, diameter, and weight during fruit development in ‘Sweet Gold’ (A) and ‘Jecy Gold’ (B) kiwifruit with the spary of plant growth regulator for year of 2021 and 2022. Values are means of two years. Vertical bars indicate means ± SE (n=15) and statistical significance was analyzed at p = 0.05.
Table 1.
Fruit quality characteristics at harvest (180 days after anthesis) in ‘Sweet Gold’ kiwifruit with the spray of plant growth regulator
| Year |
Spray frequency |
Dry matter (%) |
TSSz (°Brix) |
Acidity (%) |
Flesh firmness (Kg / Ø8 mm) |
Core firmness (Kg / Ø8 mm) |
Flesh color (h°) |
| 2021 | Control | 15.8 ± 0.2y | 7.1 ± 0.3 cx | 1.5 ± 0.1 | 6.1 ± 0.2 | 15.7 ± 0.4 a | 114.1 ± 0.6 a |
| Once | 16.6 ± 0.1 | 9.0 ± 0.3 a | 1.5 ± 0.1 | 6.4 ± 0.2 | 13.4 ± 0.7 b | 111.2 ± 0.4 b | |
| Twice | 16.2 ± 0.3 | 8.0 ± 0.2 b | 1.4 ± 0.0 | 6.3 ± 0.2 | 14.8 ± 0.5 ab | 110.8 ± 0.3 b | |
| Thrice | 17.0 ± 0.1 | 9.1 ± 0.4 a | 1.4 ± 0.1 | 6.3 ± 0.2 | 15.6 ± 0.6 a | 111.4 ± 0.3 b | |
| Significance | ns | * | ns | ns | * | * | |
| 2022 | Control | 16.9 ± 0.2 | 8.8 ± 0.4 | 1.3 ± 0.0 a | 5.3 ± 0.2 | 10.4 ± 0.4 b | 111.6 ± 0.4 b |
| Once | 17.0 ± 0.1 | 9.9 ± 0.4 | 1.0 ± 0.1 b | 5.4 ± 0.2 | 13.0 ± 1.0 a | 112.3 ± 0.4 b | |
| Twice | 16.9 ± 0.2 | 9.2 ± 0.4 | 1.0 ± 0.0 bc | 5.3 ± 0.3 | 13.5 ± 0.7 a | 112.8 ± 0.5 ab | |
| Thrice | 16.7 ± 0.2 | 8.8 ± 0.4 | 0.9 ± 0.0 c | 5.1 ± 0.2 | 13.7 ± 0.7 a | 113.6 ± 0.3 a | |
| Significance | ns | ns | * | ns | * | * |
Table 2.
Fruit quality characteristics at harvest (180 days after anthesis) in ‘Jecy Gold’ kiwifruit with the spray of plant growth regulator
| Year |
Spray frequency |
Dry matter (%) |
TSSz (°Brix) |
Acidity (%) |
Flesh firmness (Kg / Ø8 mm) |
Core firmness (Kg / Ø8 mm) |
Flesh color (h°) |
| 2021 | Control | 13.1 ± 0.4ybx | 6.7 ± 0.5 b | 1.4 ± 0.0 | 4.7 ± 0.2 | 11.5 ± 0.2 a | 108.2 ± 0.8 a |
| Once | 13.6 ± 0.2 ab | 7.8 ± 0.4 a | 1.4 ± 0.1 | 4.7 ± 0.2 | 10.2 ± 0.8 b | 105.1 ± 0.7 b | |
| Twice | 14.1 ± 0.2 a | 8.2 ± 0.4 a | 1.2 ± 0.1 | 5.0 ± 0.3 | 11.4 ± 0.8 a | 103.8 ± 0.6 b | |
| Thrice | 13.5 ± 0.1 ab | 6.0 ± 0.4 b | 1.4 ± 0.1 | 5.0 ± 0.3 | 12.2 ± 0.8 a | 109.3 ± 0.6 a | |
| Significance | * | * | ns | ns | * | * | |
| 2022 | Control | 15.0 ± 0.2 ab | 8.5 ± 0.1 ab | 1.6 ± 0.0 ab | 5.6 ± 0.3 a | 13.0 ± 0.5 a | 102.5 ± 0.6 |
| Once | 14.7 ± 0.1 b | 7.1 ± 0.1 c | 1.6 ± 0.1 b | 5.7 ± 0.3 a | 11.6 ± 0.5 b | 102.8 ± 0.3 | |
| Twice | 15.3 ± 0.1 a | 8.7 ± 0.2 a | 1.7 ± 0.1 a | 5.3 ± 0.2 a | 11.5 ± 0.6 b | 101.4 ± 0.3 | |
| Thrice | 14.7 ± 0.1 b | 8.2 ± 0.2 b | 1.6 ± 0.0 ab | 4.7 ± 0.2 b | 11.9 ± 0.5 ab | 102.1 ± 0.5 | |
| Significance | * | * | * | * | * | ns |
과실 종경, 횡경 및 과중은 만개 후 30일부터 처리간 차이를 보이기 시작하여 60일까지 급격하게 증가하여 처리 간에 명확한 차이를 나타내었는데, 이는 세포분열기 및 과실비대 초기에 해당되고 있어서 과실의 세포 수 및 크기의 증대와 관계될 것으로 보였다. 황색과육 ‘Hort 16A’의 경우 Benefits®PZ의 400배액 3회 적용으로 과실 크기가 26g 정도 증가하였으나 건물률은 오히려 감소하였다(Childerhouse, 2009; Brown and Woolley, 2010). Malone (2012)에 의하면 황색과육 ‘Hort 16A’ , ‘AU Golden Dragon’ and ‘AU Golden Sunshine’ 의 경우 200배액 2회 처리에서 건물률 등 과실 품질 요인에 영향은 거의 없는 것으로 보고되었다. 그러나 300배액 3회 처리에서는 과실 크기를 증가시켰고 건물률 등 품질 요인의 개선에도 효과적이었다(Wall, 2006). 한편 녹색과육의 ‘Hayward’와 ‘AU Fitzgerald’의 경우 300배액 3회 처리에서 과중 및 건물률 등이 증가되었다(Costa et al., 2002; Wall, 2006). 본 연구에서는 ‘스위트골드’ 및 ‘제시골드’의 경우 2년간 살포 횟수가 많아질수록 과중이 증가한 반면, 건물률 등의 품질 요인에서는 처리간 차이에도 불구하고 저하하는 경향은 나타나지 않았다. 그러므로 Benefits®PZ의 처리에 대한 반응은 품종, 처리 농도 및 횟수 등에 따라 상이한 반응을 나타낼 수 있는 것으로 보아졌으며, 다른 품종으로의 적용 확대를 위해서는 반드시 이런 요인들에 대한 평가가 선행되어야 할 것이다.
식물생장조정제 살포 횟수가 과실 조직의 확대와 세포 수 및 크기에 미치는 영향
식물생장조정제 살포 횟수에 따른 과실 조직의 확대에 미치는 정도를 조사한 결과는 Table 3에 제시되었다. 키위 과실의 조직은 과심, 과피 안쪽 및 바깥 조직으로 구성되어 있는데(Fig. 2), 식물생장조정제 살포 횟수가 증가할수록 ‘스위트골드’의 과피 안쪽 조직을 제외한 과심과 과피 바깥 조직의 너비가 증가하는 경향이었다. 그러나 ‘제시골드’에서는 과심과 과피 바깥 조직은 처리 횟수가 증가할수록 증가하였으며, 과피 안쪽 조직은 2회 및 3회 처리에서 무처리와 1회 처리에 비해 증가하는 경향이었다.
Table 3.
Comparison of fruit tissue width (mm) measured in the central part of ‘Sweet Gold’ and ‘Jecy Gold’ kiwifruit with the spray of plant growth regulator
| Cultivar |
Spray frequency | Fruit tissue width (mm) | |||
| Core | Inner pericarp | Outer pericarp | Total | ||
| Sweet Gold | Control |
3.6 ± 1.2zcy (16.9 ± 0.3)x |
10.4 ± 1.2 (48.8 ± 0.5) |
7.3 ± 1.1 c (34.3 ± 0.7) |
21.3 ± 0.2 c (100) |
| Once |
3.8 ± 1.1 bc (17.1 ± 0.3) |
10.3 ± 1.8 (46.4 ± 0.7) |
8.1 ± 1.3 b (36.5 ± 0.8) |
22.2 ± 0.3 b (100) | |
| Twice |
4.2 ± 0.9 ab (18.1 ± 0.4) |
10.5 ± 1.5 (45.3 ± 0.4) |
8.5 ± 1.4 b (36.6 ± 0.7) |
23.2 ± 0.2 a (100) | |
| Thrice |
4.5 ± 0.9 a (18.7 ± 0.4) |
10.2 ± 1.1 (42.5 ± 0.5) |
9.3 ± 0.9 a (38.8 ± 0.6) |
24.0 ± 0.3 a (100) | |
| Significance | * | ns | * | * | |
| Jecy Gold | Control |
3.0 ± 0.8 b (14.5 ± 0.4) |
8.6 ± 1.2 b (41.5 ± 0.6) |
9.1 ± 0.9 d (44.0 ± 0.4) |
20.7 ± 0.1 d (100) |
| Once |
3.2 ± 1.2 ab (13.9 ± 0.4) |
8.6 ± 1.3 b (37.6 ± 0.6) |
11.1 ± 1.1 c (48.5 ± 0.4) |
22.9 ± 0.1 c (100) | |
| Twice |
3.3 ± 0.6 ab (13.6 ± 0.5) |
9.4 ± 1.5 a (38.8 ± 0.7) |
11.5 ± 0.6 b (47.5 ± 0.5) |
24.2 ± 0.1 b (100) | |
| Thrice |
3.6 ± 0.9 a (14.4 ± 0.5) |
9.5 ± 1.1 a (38.0 ± 0.8) |
11.9 ± 1.1 a (47.6 ± 0.3) |
25.0 ± 0.1 a (100) | |
| Significance | * | * | * | * | |
식물생장조정제 살포 횟수에 따른 ‘스위트골드’와 ‘제시골드’의 과실 조직의 세포 수와 크기는 Table 4와 Table 5에 제시되었다. ‘스위트골드’와 ‘제시골드’의 과심 세포 수는 3차 처리에서 가장 많고, 대조구에서 가장 적은 경향이었다. ‘스위트골드’와 ‘제시골드’의 과심 세포 크기는 3차 처리에서 가장 컸고, 대조구에서 가장 작은 경향이 나타났다. ‘스위트골드’ 과피 안쪽 조직에서 세포 수와 크기는 처리간 차이가 없었다. ‘제시골드’의 경우에는 세포 수는 무처리와 1차 처리에 비해 2차 및 3차 처리에서 증가하였으나 세포 크기는 처리간 차이가 없었다. 키위프루트 과실의 과피 바깥 조직은 소세포(크기 60µm 내외)와 대세포(크기 200µm 내외)로 구성되어 있는데, ‘스위트골드’와 ‘제시골드’에서 소세포 수는 처리 횟수에 따라 증가하였으나, 대세포 수에 있어서는 차이가 없었다. 과피 바깥 조직의 소세포 크기는 ‘스위트골드’에서는 처리간 차이가 없었으나, ‘제시골드’에서는 1회 처리에서 가장 컸고, 2–3회 처리에서는 무처리보다 크게 나타났다. 대세포 크기는 무처리에 비해 증가하였으나, 처리 횟수에 따른 반응은 일정한 경향을 나타냄없이 ‘스위트골드’에서는 1회 처리, 3회 처리, 2회 처리 순으로, ‘제시골드’에서는 2회 처리, 3회 처리, 1회 처리 순으로 높게 나타났다.
Table 4.
Effect of plant growth regulator spray on the number of fruit tissue cells in ‘Sweet Gold’ and ‘Jecy Gold’ kiwifruit
| Cultivar | Spray frequency | No. of fruit tissue cells | |||
| Core | Inner pericarp | Outer pericarp (small) | Outer pericarp (large) | ||
| Sweet Gold | Control | 76.1 ± 0.8zdy | 108.7 ± 0.9 | 142.1 ± 3.9 c | 24.2 ± 1.6 |
| Once | 78.0 ± 0.8 c | 109.0 ± 1.5 | 148.9 ± 3.1 bc | 23.6 ± 1.4 | |
| Twice | 86.7 ± 0.8 b | 110.2 ± 1.7 | 159.4 ± 3.6 b | 27.7 ± 1.1 | |
| Thrice | 90.1 ± 0.6 a | 109.6 ± 1.0 | 175.1 ± 3.9 a | 27.8 ± 1.2 | |
| Significance | * | ns | * | ns | |
| Jecy Gold | Control | 64.0 ± 0.6 d | 100.7 ± 1.0 b | 140.3 ± 1.3 c | 33.5 ± 2.0 |
| Once | 67.4 ± 0.6 c | 101.2 ± 0.7 b | 152.6 ± 2.8 b | 34.2 ± 1.9 | |
| Twice | 69.6 ± 0.6 b | 111.5 ± 0.6 a | 163.5 ± 2.7 a | 34.6 ± 1.5 | |
| Thrice | 71.7 ± 0.5 a | 113.3 ± 0.8 a | 170.1 ± 2.6 a | 35.8 ± .1.5 | |
| Significance | * | * | * | ns | |
Table 5.
Effect of plant growth regulator spray on cell size (µm) of flesh tissues in ‘Sweet Gold’ and ‘Jecy Gold’ kiwifruit
| Cultivar | Spray frequency | Cell size (µm) | |||
| Core | Inner pericarp | Outer pericarp (small) | Outer pericarp (large) | ||
| Sweet Gold | Control | 47.3 ± 0.2zcy | 95.9 ± 0.8 | 51.4 ± 1.4 | 164.6 ± 4.7 c |
| Once | 48.7 ± 0.3 b | 94.9 ± 1.4 | 54.5 ± 1.1 | 182.4 ± 4.3 a | |
| Twice | 48.4 ± 0.2 b | 95.1 ± 1.7 | 53.9 ± 1.3 | 167.2 ± 4.0b c | |
| Thrice | 49.9 ± 0.2 a | 93.9 ± 0.9 | 53.5 ± 1.2 | 177.3 ± 1.8 b | |
| Significance | * | ns | ns | * | |
| Jecy Gold | Control | 47.4 ± 0.2 c | 85.5 ± 0.9 | 65.3 ± 0.6 b | 181.5 ± 4.4 b |
| Once | 48.1 ± 0.2 b | 84.8 ± 0.6 | 73.0 ± 1.3 a | 203.8 ± 4.7 a | |
| Twice | 48.0 ± 0.2 b | 84.3 ± 0.5 | 70.8 ± 1.2 a | 216.4 ± 3.8 a | |
| Thrice | 49.9 ± 0.2 a | 84.1 ± 0.6 | 70.3 ± 1.0 a | 212.0 ± 3.8 a | |
| Significance | * | ns | * | * | |
전체적으로 보면 식물생장조정제 처리에 따른 과실 조직의 확대는 과심과 과피 바깥 조직 중심으로 이루어졌고, 이는 과심의 경우 세포 수와 크기 모두 증가하였으나, 과피 바깥 조직에서는 소세포의 수의 증가 및 대세포의 크기 증가와 연계되는 것으로 나타났다. Currie (1997)는 ‘헤이워드’에서 과피 바깥 조직의 소세포 크기는 약 60µm, 대세포 크기는 200µm로 보고하였는데, ‘스위트골드’와 ‘제시골드’에서와 비슷한 수준이었다. 또한 Cruz-Castillo et al. (2002)은 CPPU 처리로 인한 과중 증대가 과피 바깥 조직의 세포 수 증대와 관계된다고 하였으며, Patterson et al. (1993)은 세포 크기 확대와 관계된다고 하였는데, 본 연구결과와 유사하였다. 배와 멜론에서도 품종 간의 과실 크기 차이는 중과피의 세포 크기보다는 세포 수에 더 영향을 받는 것으로 보고된 바 있다(Higashi et al., 1999; Zhang et al., 2006). 그러므로 식물생장조정제 살포 횟수에 따른 과실의 크기 및 과중에의 반응은 과종과 품종에 따라 다르게 나타날 수 있는 것으로 판단되었다.
식물생장조정제 살포 횟수가 상온저장 시 후숙 품질에 미치는 영향
식물생장조정제 살포 횟수가 수확 5일, 25일 후 상온저장에 따른 ‘스위트골드’ 과실의 품질에 미치는 영향을 조사하였으며, 그 결과는 Table 6과 같다. 상온저장 5일 후 건물률은 가장 높았던 3회 처리와 유사한 수준으로 증가하여 처리 횟수에 따른 차이가 사라졌다. 가용성 고형물 함량은 상온저장 5일 후 서서히 증가하여 25일 후는 16.0°Brix 내외까지 급격히 증가하였는데, 처리 횟수에 상관없이 무처리보다 높은 가용성 고형물 함량을 나타내었다. 산 함량은 0.4% 수준까지 감소하였고, 과육 및 과심 경도는 각각 0.4Kg/Ø8mm 및 0.1Kg/Ø8mm 까지 감소하였는데, 처리간 차이는 없었다. 색도(hue)는 점차 감소하였으나, 상온저장 5일 및 25일 후에도 수확 시 무처리에 비해 처리구에서 황색발현은 높은 경향이 계속 유지되었다.
Table 6.
Effect of growth regulator sprays on fruit quality during room temperature storage in ‘Sweet Gold’ kiwifruit
| Storage day |
Spray frequency |
Dry matter (%) |
TSSz (°Brix) |
Acidity (%) |
Flesh firmness (Kg / Ø8 mm) |
Core firmness (Kg / Ø8 mm) |
Flesh color (h°) |
| 5 | Control | 16.9 ± 0.6y | 8.0 ± 0.2 cx | 1.3 ± 0.0 | 5.6 ± 0.3 a | 13.4 ± 0.6 | 113.4 ± 0.2 a |
| Once | 17.4 ± 0.1 | 11.6 ± 0.4 a | 1.2 ± 0.1 | 4.5 ± 0.3 b | 12.4 ± 1.0 | 109 ± 0.3 bc | |
| Twice | 17.3 ± 0.4 | 10.3 ± 0.4 b | 1.2 ± 0.0 | 5.1 ± 0.3 ab | 11.5 ± 0.6 | 108.3 ± 0.5 c | |
| Thrice | 16.5 ± 0.7 | 10.1 ± 0.3 b | 1.3 ± 0.1 | 5.6 ± 0.3 a | 13.7 ± 0.8 | 109.5 ± 0.4 b | |
| Significance | ns | * | ns | * | ns | * | |
| 25 | Control | 17.4 ± 0.2 | 15.8 ± 0.1 b | 0.4 ± 0.1 | 0.4 ± 0.1 a | 0.2 ± 0.1 | 110.1 ± 0.3 a |
| Once | 17.9 ± 0.2 | 16.5 ± 0.1 a | 0.4 ± 0.1 | 0.3 ± 0.0 | 0.1 ± 0.0 | 106.4 ± 0.4 b | |
| Twice | 17.6 ± 0.2 | 16.2 ± 0.2 a | 0.4 ± 0.1 | 0.4 ± 0.0 | 0.1 ± 0.0 | 106.4 ± 0.6 b | |
| Thrice | 17.3 ± 0.5 | 16.4 ± 0.1 a | 0.5 ± 0.0 | 0.4 ± 0.1 | 0.2 ± 0.1 | 106.8 ± 0.4 b | |
| Significance | ns | * | ns | ns | ns | * |
이러한 결과로 식물생장조정제 처리에 의한 상온저장에서 과육 및 과심의 후숙 연화 정도에 미치는 영향은 거의 없었으며, 색도(hue)를 제외하면 건물률, 가용성 고형물 함량 및 산 함량의 후숙 품질에 미치는 영향도 거의 없었다. Antognozzi (1996)의 연구에 따르면 CPPU를 처리한 과실은 처리하지 않은 과실과 비교하였을 때, 과중과 가용성 고형물 함량은 증가하나 숙성을 가속화하고 연화를 진행시킨다고 보고하였다. 배의 경우는 GA 도포제 처리에 의해 과중은 증가하나, 경도와 산 함량의 감소로 저장성이 떨어지는 단점이 보고된 바 있다(Choi, 2004; Yoo et al., 2022). 그러므로 키위의 저장성 및 후숙 품질 변화에 대해서는 추가적으로 보다 상세히 연구할 필요가 있다고 생각된다.
식물생장조정제 살포 횟수가 전분 및 가용성 당에 미치는 영향
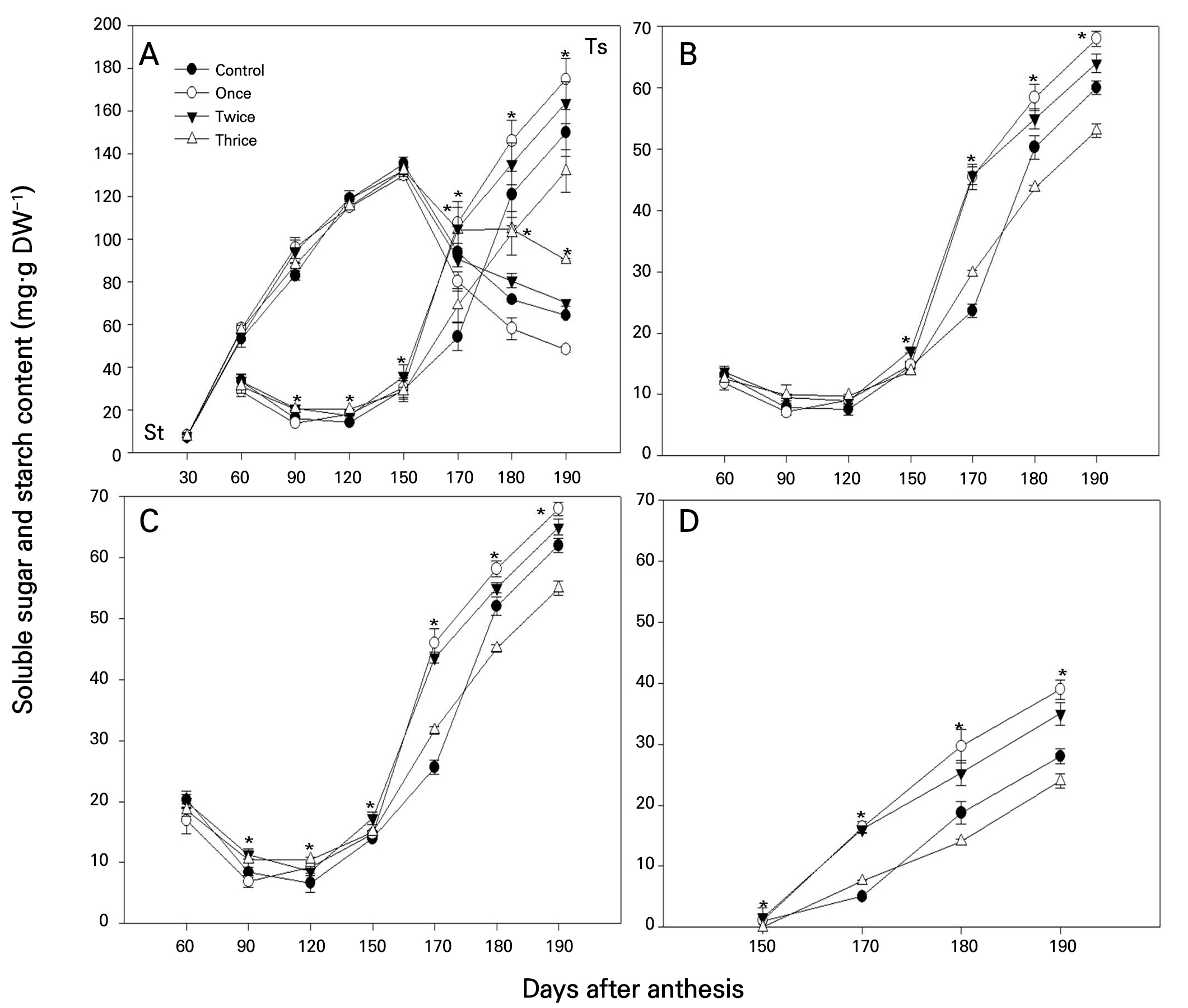
식물생장조정제 살포 횟수에 따른 ‘스위트골드’와 ‘제시골드’의 전분 및 가용성 당 함량을 조사한 결과는 Fig. 3과 같다. ‘스위트골드’와 ‘제시골드’ 전분 함량은 만개 후 150일에 가장 높았고, 이후 190일까지 감소하는 경향이었다(Figs.3 and 4). 전분 축적이 이루어지는 만개 후 150일까지의 전분 함량은 두 품종 모두 처리간에 차이가 없었으나, 만개 170일 후부터 함량 차이를 보이기 시작하여 점차 확대되는 경향을 나타내었다. 전분 함량은 1회 처리에서 가장 낮았고, 무처리보다는 2회 및 3회 처리에서 높게 나타났다. 가용성 당의 함량은 만개 120일 이후 급격히 증가하기 시작하였고, 만개 170–180일 경에는 처리간 함량 차이가 커지는 경향이었다. 포도당, 과당, 자당의 변화는 총 가용성 당의 변화와 비슷한 양상이었다. 가용성 당 함량의 경우, ‘스위트골드’에서는 무처리에서 가장 낮았고, 3회 처리에서 가장 높았으며, ‘제시골드’에서는 3회 처리에서 가장 낮았고, 1회 처리에서 가장 높게 나타나, 품종 간에 반응이 다르게 나타났다.
키위는 과실 비대기에서 전분을 축적하지만 성숙기에는 전분을 빠르게 분해한다(Stevenson et al., 2006). 전분이 분해되어 당으로 전환되면 가용성 당 함량이 증가하게 된다(Wegrzyn and MacRae, 1995; Antognozzi et al., 1996). 전분과 가용성 당의 변화를 고려할 때 ‘스위트골드’ 및 ‘제시골드’의 적숙기는 각각 만개 180일 및 170일로 나타났으며, 이는 Kang et al. (2021)의 보고와 일치하였다. 키위 과실에서 전분은 대부분 과피 바깥 조직의 소세포에 저장되는 것으로 알려져 있다(Gould et al., 1992). 식물생장조정제의 처리 횟수가 증가할수록 과실 과피 바깥 조직의 세포 수는 증가하고 세포 크기는 처리 횟수에 관계없이 무처리에 비해 증가하는 경향이었다(Tables 4 and 5). 그러나 처리 횟수에 따른 수확기 전분의 함량과는 일치하지 않았다. 또한 전분의 함량과 가용성 당의 함량 간에도 분명한 연관성을 보이지는 않았다. 아직까지 식물생장조정제 처리에 따른 과실 전분 함량의 변화에 대해서는 보고된 바 없다. 그러므로 식물생장조정제 살포에 따른 조직의 변화와 전분 및 가용성 당 함량의 변화에 대해서는 추가적인 연구를 통해서 보다 명확한 이해가 필요하다고 보였다.