서 언
재료 및 방법
식물 재배
접종원 준비
접종 및 병조사
결과 및 고찰
FOR 8개 균주의 병원력
FOR KR1 균주에 대한 무 60개 품종의 저항성
FOR 7개 균주에 의한 무 24개 품종의 시들음병 발생
서 언
Fusarium oxysporum은 토양전염성 병원균으로 다양한 작물에 시들음병을 일으키며, 기주식물에 대한 병원성에 따라 150개 이상의 분화형(formae speciales)을 가진다고 알려져 있다(Snyder and Hansen, 1940). 그리고 일부 분화형은 기주의 병 저항성 반응에 따라 다시 레이스로 구분한다(Armstrong and Armstrong, 1952, 1966). 배추과 작물에 시들음병을 일으키는 병원균은 F. oxysporum f. sp. conglutinans, F. oxysporum f. sp. matthioli, F. oxysporum f. sp. raphani 3종이 알려져 있으며, 이 중 무의 시들음병은 F. oxysporum f. sp. raphani에 의해서 발생한다(Kendrick and Snyder, 1942; Baker, 1948; Snyder, 1949; Bosland and Williams, 1987).
무 시들음병은 1934년 미국 캘리포니아 San Benito에 있는 White Chinese Winter Radish 채종포에서 처음 보고된 이래 현재는 미국 각지에서 발생하고 있다(Pound and Fowler, 1953; du Toit and Pelter, 2003). 우리나라에서도 주요 무 재배지에서의 연작으로 인하여 시들음병 발생이 점차 증가하고 있다(Moon et al., 2001). 무시들음병균인 F. oxysporum f. sp. raphani는 불완전 균류로 토양 내에서 후벽포자를 형성하여 수년간 생존할 수 있으며, 시들음병 발생에 유리한 환경이 되면 후벽포자가 발아하여 기주 식물의 뿌리를 침입하여 병을 일으킨다(van Peer et al., 1988). 무시들음병균에 감염된 무는 뿌리 도관 조직이 검게 변하거나 갈변되고, 잎이 황화되어 위황병(yellows)라고도 불린다(Bosland et al., 1988).
무 시들음병은 지구 온난화와 이어짓기(연작)로 발생이 증가하고 있지만 현재까지 무 시들음병 방제용으로 등록된 살균제가 없으며(Baik et al., 2010), 윤작, 석회 시비, 토양 소독 등의 방제 방법은 경제성이 낮고 방제에 한계가 있기 때문에 저항성 품종을 재배하는 것이 가장 환경친화적이고 효과적인 방제 방법으로 인식되고 있다(Abebe et al., 2016; Jayaraman et al., 2016; Kim et al., 2019). 국내에서 이미 시들음병에 저항성인 무 품종이 시판 중에 있지만, 무의 시들음병균 저항성 유전자 규명과 저항성 유전양식 그리고 분자마커 개발에 대해서는 거의 보고된 바 없다.
병원균에 대한 작물의 저항성의 특성에 따라 병 저항성 품종 개발을 위한 병리검정 방법은 달라지게 된다. 그리고 포장에서 저항성 품종을 이용하여 시들음병을 효과적으로 방제하기 위해서도 반드시 병 저항성과 관련된 병원균의 레이스 분화 연구가 필요하다. 병 저항성과 관련된 식물병원균의 레이스 분화는 기주 식물의 저항성이 질적 저항성인 경우에 존재하며, 멜론의 덩굴쪼김병 저항성은 Fom-1과 Fom-2 유전자에 의해 결정되며, 이에 따라 병원균 F. oxysporum f. sp. melonis는 두 저항성이 없는 경우에만 감염할 수 있는 레이스 0, Fom-1 유전자가 도입된 멜론을 감염할 수 있는 레이스 1, Fom-2를 감염할 수 있는 레이스 2, 두 저항성 유전자 모두가 도입된 멜론을 감염할 수 있는 레이스 1,2로 구분한다(Risser et al., 1976). 이외에도 고추의 세균점무늬병균에 대한 저항성(Hibberd et al., 1987), 배추의 뿌리혹병(James and Williams, 1980; Yoshikawa, 1983, 1993; Kuginuki et al., 1999; Hirai, 2006), 양배추의 시들음병(Ramirez-Villupadua et al., 1985)에 대한 저항성도 질적 저항성을 하며 기주의 저항성 유전자에 대한 병원균의 반응에 따른 레이스 분화가 알려져 있다.
하지만 양적 저항성의 경우에는 질적 저항성과 달리 저항성 유전자에 대한 반응으로 레이스를 구분할 수 없고, 작물은 병원균의 병원력에 반비례하여 저항성을 나타낸다는 보고들이 있다(Jo et al., 2014; Jo et al., 2016). 고추 역병의 경우에는 시판되고 있는 고추 품종들에 몇몇의 역병 저항성 유전자가 도입되어 있어, 이 저항성 유전자의 수나 종류에 따라서 고추 품종들에 저항성 반응 차이가 존재하고, 각 고추 품종은 고추역병균(Phytophthora capsici) 균주들의 병원력에 반비례하여 저항성을 보인다고 보고되었다(Jo et al., 2014). 하지만 무의 시들음병균인 F. oxysporum, f. sp. raphani의 경우에는 멜론의 덩굴쪼김병균과 같은 레이스 분화가 보고되지 않았다.
따라서 본 연구에서는 F. oxysporum, f. sp. raphani 8개 균주의 병원력 정도를 조사하고, 중간 정도의 병원력을 나타내는 시들음병균 FOR KR1 균주를 선발하여 이 균주에 대한 무 시판품종 60개의 저항성을 조사하였다. 그리고 이들 결과로부터 저항성 반응을 나타내거나 종자회사에서 저항성으로 판매하고 있는 24개 저항성 품종을 선발하고, 병원력에 차이를 보이는 F. oxysporum, f. sp. raphani 7개 균주에 대한 이들 품종의 저항성 정도를 조사하였다. 이들 결과로부터 무 시들음병균의 레이스 분화 여부를 분석하였다.
재료 및 방법
식물 재배
F. oxysporum f. sp. raphani(FOR) 8개 균주(57A, 59A, 60A, 147A, KR1, NW1, HN, JHW)의 병원력을 비교하기 위해서 감수성 품종인 ‘백춘’을 구입하여 실험에 사용하였다.
그리고 무 시판품종들의 FOR KR1 균주에 대한 시들음병 저항성 정도를 조사하기 위해서는, 시판 중인 무 60개 품종(‘대평여름’, ‘금봉’, ‘백춘’, ‘가을김장’, ‘새롬’, ‘전무후무’, ‘하우스청옥’, ‘백동’, ‘명산’, ‘장생’, ‘보석알타리’, ‘태창’, ‘청풍명월’, ‘한농알타리’, ‘강성’, ‘알파인’, ‘극동’, ‘빛고은열무’, ‘명가가을1호’, ‘제일슈퍼시래기’, ‘아우리월동’, ‘슈퍼길조’, ‘우정알타리’, ‘평강김장’, ‘백옥’, ‘초롱’, ‘YR챔피온열무’, ‘비바리월동’, ‘태광’, ‘백자’, ‘산나리열무’, ‘백세1호’, ‘청운플러스’, ‘참조아열무’, ‘슈퍼모델’, ‘제일건강시래기1호’, ‘송백’, ‘제일보라’, ‘미농조생’, ‘선봉알타리’, ‘초비’, ‘길조’, ‘시래기’, ‘만사형통’, ‘동하’, ‘박자’, ‘대박’, ‘청일품’, ‘아시아가을저장’, ‘관동여름’, ‘토광’, ‘여름춘향이열무’, ‘대들보’, ‘청두’, ‘청수궁중’, ‘태청’, ‘청운’, ‘대동’, ‘탐스런’, ‘강추’, ‘장형봄’)을 구입하여 실험에 사용하였다.
저항성 무 품종들의 FOR 7개 균주(57A, 59A, 60A, 147A, NW1, HN, JHW)에 대한 저항성 정도를 조사하고자, 저항성을 나타내거나 종자회사에서 저항성으로 판매하고 있는 24개 품종(‘명산’, ‘슈퍼모델’, ‘장형봄’, ‘대들보’, ‘초비’, ‘청일품’, ‘슈퍼길조’, ‘알파인골드’, ‘청운플러스’, ‘YR챔피온열무’, ‘빛고은열무’, ‘아우리월동’과 ‘평강김장’, ‘비바리월동’, ‘태창’, ‘장생’, ‘길조’, ‘토광’, ‘알파인’, ‘청운’, ‘청두’, ‘한농알타리’, ‘대박’, ‘태광’)를 선발하여 실험에 사용하였다. 그리고 모든 실험에는 감수성 대조품종인 ‘백춘’ 포함하여 실험하였다.
무시들음병균을 접종할 무 유묘를 준비하기 위하여, 각 무 품종의 종자를 8 × 16 플러그 포트(포트 당 토양 15mL, Bumnong, Jeongup, Korea)에 원예용상토 5호(Punong, Gyeongju, Korea)를 채운 뒤, 각 품종의 종자를 포트 당 1립씩 파종하여 온실(25 ± 5°C)에서 8일간 재배하였다.
접종원 준비
본 실험에 사용한 무시들음병균 FOR 8개 균주(KR1, 57A, 59A, 60A, 147A, NW1, HN, JHW)는 다양한 지역에서 채집한 시들음병에 걸린 무로부터 분리한 57A, 59A, 60A 및 147A 균주와 강릉원주대로부터 분양 받은 KR1 균주, 그리고 충남대로부터 분양 받은 NW1, HN 및 JHW 균주를 실험에 사용하였다(Kim et al., 2017).
무시들음병균 FOR 8개 균주의 접종원은 다음과 같은 방법으로 준비하였다(Baik et al., 2011). Potato dextrose agar(PDA; Becton, Dickinson and Co., Sparks, MD, USA) 배지 중앙에 FOR 균주의 균사 조각을 올려놓아 접종하고, 이를 25°C 인큐베이터에서 7일간 배양하였다. 형성된 균총에 직경 5mm cork borer를 사용하여 균사 조각(disc)을 만들고 이것을 malt extract broth(MEB; Becton, Dickinson and Co., Sparks, MD, USA) 배지에 접종하고, 25°C 암 상태에서 7일 동안 150rpm으로 진탕배양 하였다. 배양한 FOR을 4겹의 거즈로 걸러 균사체를 제거하고, 원심분리(9,820g, 4°C, 10분; Beckman Coulter Inc., Brea, CA, USA)한 후 상징액(배양여액)을 제거한 후에, 침전물(포자)에 멸균수를 첨가하고 흔들어 포자현탁액을 준비하였다. 광학현미경(Nikon Instruments Inc., Melville, NY, USA) 하에서 hemocytometer(Paul Marienfeld GmbH & Co. KG, Lauda-Konighofen, Germany)를 이용하여 포자현탁액의 포자(소형분생포자) 농도를 조사하고, 멸균수로 희석하여 3.0 × 106 conidia/mL로 조정하였다.
접종 및 병조사
온실에서 8일 동안 재배한 무 유묘를 포트 밑에서 위로 눌러 토양과 함께 꺼내고, 무 유묘 뿌리의 흙을 충분히 제거한 뒤 물로 3회 세척한 후에 접종할 때까지 시들지 않도록 물에 담가두었다.
그리고 병원균을 접종하기 위하여, 무시들음병균 균주의 포자현탁액을 50mL 비커에 40mL씩 넣고 준비한 무 유묘를 품종 당 10주씩 뿌리가 잠기도록 비이커에 넣고 30분간 배양하였다. 5 × 8 연결포트(포트 당 토양 70mL, Bumnong, Jeongup, Korea)에 원예용상토 5호(Punong, Gyeongju, Korea)를 채워넣고 접종한 무 유묘를 뿌리가 꺾이지 않도록 주의하여 심었다. 이식한 후에 충분히 물을 살포하고 25°C 습실상에서 넣고 24시간 동안 재배한 후에 25°C 항온실로 이동하고, 하루에 12시간씩 광을 조사하면서 토양이 너무 습하거나 건조하지 않도록 수분을 공급하며 재배하였다.
감수성 대조품종 ‘백춘’에서 시들음병이 충분히 발생하였을 때, 다음과 같은 방법으로 병조사를 실시하였다(Lee et al., 2016). 발병 정도에 따라 0 = 건전, 1 = 지하부는 갈변되나 지상부는 병징이 없는 것, 2 = 지하부는 갈변되고, 지상부는 약간 생육이 억제되는 것, 3 = 지하부는 갈변되고, 지상부는 생육이 억제되며 약간 황화된 것, 4 = 지하부는 갈변되고, 지하부와 지상부 모두 생육이 억제되며 심하게 황화된 것, 5 = 고사로 0 ‑ 5까지 총 6단계로 나누어 조사하였다.
FOR 8개 균주들의 병원력 조사 실험에서는 접종 7일 후부터 병조사하기 시작하여 접종 10일, 11일, 12일, 13일, 14일, 16일 후에 시들음병 발생을 조사하였다. 이들 결과로부터 다음과 같은 식에 따라 병진전곡선하면적(AUDPC)를 계산하였다.
| $$AUDPC\;=\sum_{i=1}^n\lbrack t(i+1)-ti\rbrack\times\lbrack DS(i+1)+DSi\rbrack/2$$ | (1) |
n = 병조사 수, = i 병조사 일의 접종 후 경과 일 수, = i 병조사 일의 발병도
모든 실험은 처리 당 10개 식물체를 접종하였으며 실험은 2회 반복 수행하였다. 그리고 이들 결과는 SAS(SAS 9.1, SAS Institute Inc., Cary, NC) 프로그램을 이용하여 ANOVA 분석을 하고 처리 평균간 비교를 위하여 Duncan’s multiple range test(p = 0.05)를 실시하였다.
결과 및 고찰
FOR 8개 균주의 병원력
감수성 품종인 ‘백춘‘ 유묘에 FOR 8개 균주(KR1, 57A, 59A, 60A, 147A, NW1, HN, JHW)를 각각 접종하고 시들음병 발생을 조사한 결과, 균주에 따른 무의 시들음병 발생은 접종 7일 후부터 크게 차이가 났다. FOR HN과 JHW 균주를 접종한 무 유묘들은 접종 7일 후에 황화되는 증상을 보이거나, 생육이 지연되는 것을 관찰할 수 있었으며, 접종 11일 후에는 접종한 식물체들이 대부분 고사하거나 심하게 황화되었다(Fig. 1). 한편, FOR 60A과 59A 균주를 접종한 식물은 접종 11일 후에도 황화되거나 시들음 증상을 확인할 수 없었다. 접종 16일 후에는 FOR 60A 균주를 제외한 나머지 7개 균주를 접종한 무 유묘는 대부분 심하게 황화되거나 고사하였다(Fig. 1).
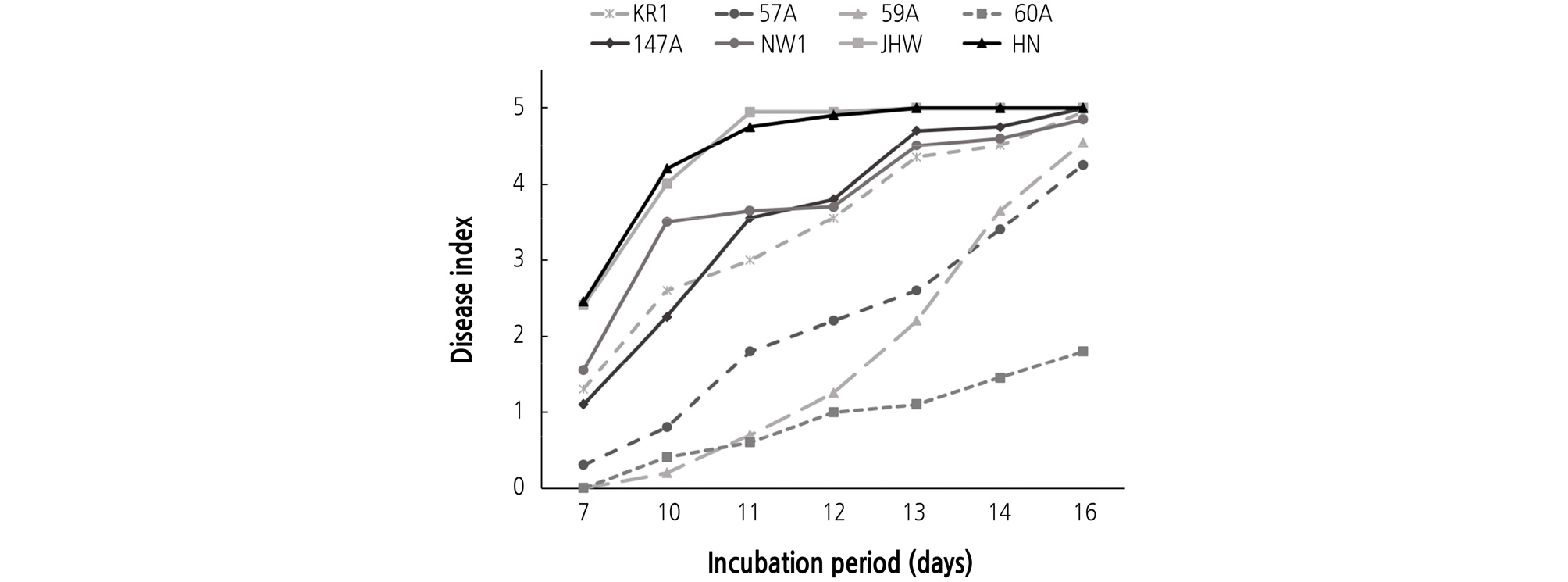
Fig. 1.
Development of Fusarium wilt on radish seedlings (‘Baekchun’) caused by eight isolates of Fusarium oxysporum f. sp. raphani. Eight-day-old seedlings were inoculated with spore suspension (3.0 × 106 conidia/mL) for 0.5 hour. The inoculated plants were incubated in a humidity chamber at 25°C for 24 hours and then transferred to a growth chamber at 25°C. After 7, 10, 11, 12, 13, 14, and 16 days, disease severity of the seedlings was investigated. Each value represents the mean disease index of two runs with 10 replicates each.
FOR 8개 균주를 각각 접종한 후에 재배 기간(7일, 10일, 11일, 12일, 13일, 14일, 16일)에 따른 무 시들음병 발병도 값으로 즉, 그림 1의 결과로부터 병진전곡선하면적(AUDPC)을 구한 결과, FOR HN과 JHW는 35로 가장 높은 AUDPC 값을 보였고, 그 다음은 FOR NW1이 30, FOR 147A과 FOR KR1이 27, FOR 57A이 16 그리고 FOR 59A가 14였다. 시들음병 발생이 가장 적었던 FOR 60A 균주의 경우에는 AUDPC 값은 가장 낮은 7이었다. 이들 결과로부터 FOR 8개 균주들은 병원력에 차이가 있었으며, FOR 균주들의 병원력에 따라 크게 3개 그룹으로 나눌 수 있었다(Fig. 2). 병원력이 가장 강한 균주는 FOR HN과 JHW 이었으며, 그 다음 그룹은 FOR NW1, 147A 및 KR1 균주, 그리고 병원력이 낮은 그룹은 FOR 57A, 59A 및 60A 균주 이었다.
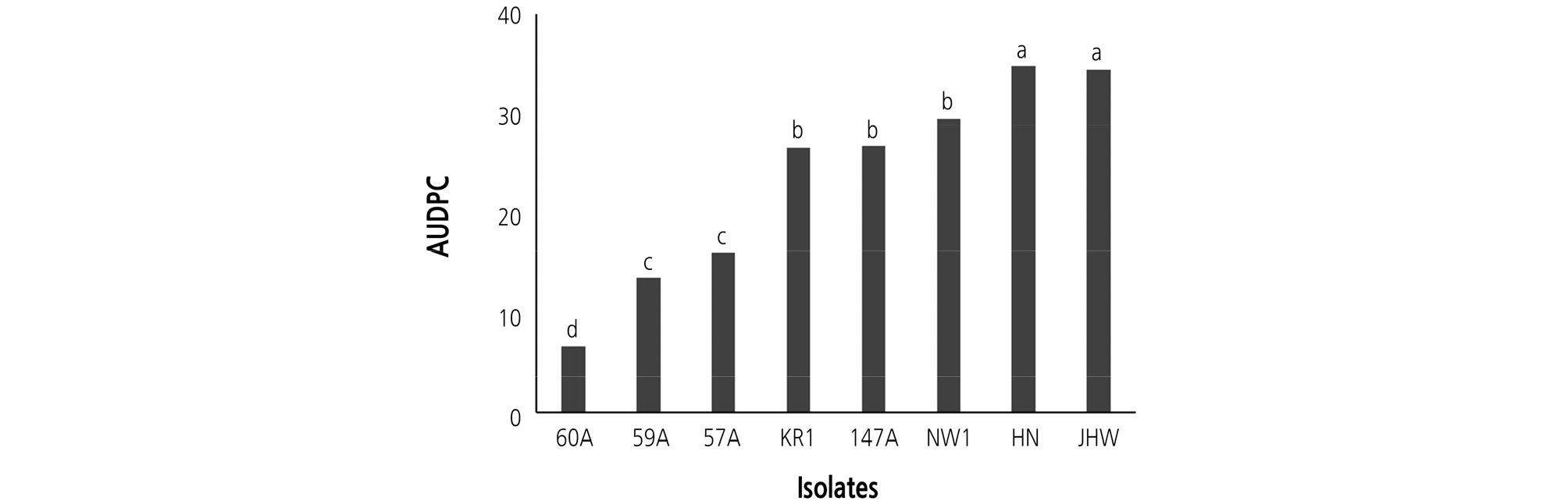
Fig. 2.
Area under disease progress curve (AUDPC) of Fusarium wilt on radish seedlings (‘Baekchun’) caused by eight isolates of Fusarium oxysporum f. sp. raphani. Values labeled with the same letter are not significantly different based on Duncan’s multiple range test at p = 0.05. AUDPC = ; n = number of assessments, = number of days after inoculation on assessment date , = disease severity on assessment date .
Jo et al.(2016)은 양배추뿌리혹병균(Plasmodiophora brassicae)의 경우에도 뿌리혹병균 4개 균주를 일반 양배추 16개 품종에 접종하였을 때, YC, GN1, HN1, DJ 균주 순으로 뿌리혹병 발생이 많아서 P. brassicae도 균주에 따라 병원력에 차이가 있다고 보고하였다. 그리고 고추역병균(Phytophthora capsici) 경우에도 많은 연구자들이 균주 간에 병원력에 차이가 있음을 보고하였다(Yang et al., 1989; Foster and Hausbeck, 2010; Jo et al., 2014). 고추 역병균 및 뿌리혹병균 외에도 많은 식물병원균은 균주들 간에 병원력 차이가 있음이 알려져 있다.
FOR KR1 균주에 대한 무 60개 품종의 저항성
FOR 8개 균주 중 중간 정도의 병원력을 보이는 FOR KR1 균주(Fig. 1)를 무 시판품종 60개의 유묘에 접종하여 시들음병 발생 정도를 조사한 결과, 실험한 품종 중 저항성 반응을 보인 품종은 10개(17%)였으며 중도저항성 반응을 나타내 품종은 13개(22%)였다(Table 1). 그리고 나머지 37개(61%) 품종은 시들음병균 KR1 균주에 대해 감수성 반응을 보여 시판되고 있는 많은 무 품종은 시들음병에 대하여 감수성임을 알 수 있었다.
Table 1. Development of Fusarium wilt on 60 radish cultivars caused by Fusarium oxysporum f. sp. raphani KR1z
yResistant cultivar to Fusarium wilt commercialized by each seed company.
xDI, disease index; Each value represents the mean disease index (± standard deviation) of two runs with 10 replicates each.
wRS, response; R, resistant, DI ≤ 1.0; MR, moderately resistant, 1.1 < DI ≤ 2.0; S, susceptible, DI > 2.0
실험한 60개 품종 중 시들음병에 대한 저항성 품종으로 판매 중인 11개 무 품종의 FOR KR1 균주에 대한 저항성 여부를 살펴보면, ‘명산’, ‘슈퍼모델’, ‘장형봄’, ‘대들보’, ‘초비’ 및 ‘청일품’의 발병도는 각각 0.2, 0.5, 0.5, 0.7, 0.7, 0.8로 저항성 반응을 보였다(Table 1). 그리고 ‘슈퍼길조’, ‘청운플러스’, ‘YR챔피온열무’는 각각 1.2, 1.8, 2.0의 발병도 즉 중도저항성 반응을 나타냈다. 하지만 ‘빛고은열무’과 ‘아우리월동’은 모두 발병도 2.7을 보였으며, 감수성 대조품종인 ‘백춘’이 4.4의 발병도를 보인 것과 비교하면 시들음병 발생이 더 적으나 감수성 반응을 나타냈다(Table 1).
이와 달리 시들음병균에 대해 저항성 품종으로 알려져 있지 않은 49개 품종 중 ‘가을김장’, ‘평강김장’, ‘비바리월동’ 및 ‘태창’ 4개 품종은 시들음병 발병도가 각각 0.5, 0.9, 1.0, 1.0으로 저항성 반응을 보였다(Table 1). 그리고 ‘장생’, ‘길조’, ‘토광’, ‘알파인’, ‘청운’, ‘청두’, ‘한농알타리’, ‘전무후무’, ‘대박’ 및 ‘태광’ 10개 품종은 1.1 ‑ 2.0의 발병도 즉 중도저항성 반응을 나타냈다. 나머지 35개 품종은 발병도가 2.1 이상으로 감수성 반응을 보였다(Table 1).
이들 결과로부터, 무시들음병균 FOR의 레이스 분화여부를 조사하기 위한 실험을 위해 24개 품종을 선발하였다. 여기에는 종자회사에서 시들음병 저항성으로 공시한 12개 품종(‘명산’, ‘슈퍼모델’, ‘장형봄’, ‘대들보’, ‘초비’, ‘청일품’, ‘슈퍼길조’, ‘알파인골드’, ‘청운플러스’, ‘YR챔피온열무’, ‘빛고은열무’, ‘아우리월동’)과 종자회사에서 일반 품종으로 판매하고 있으나 Table 1의 결과에서 저항성 혹은 중도저항성을 나타낸 12개 품종(‘평강김장’, ‘비바리월동’, ‘태창’, ‘장생’, ‘길조’, ‘토광’, ‘알파인’, ‘청운’, ‘청두’, ‘한농알타리’, ‘대박’, ‘태광’)이 포함되었다.
FOR 7개 균주에 의한 무 24개 품종의 시들음병 발생
FOR KR1 균주를 제외한 FOR 7개 균주(57A, 59A, 60A, 147A, NW1, HN, JHW)에 의한 선발한 24개 품종과 감수성 대조 품종 ‘백춘’ 품종의 시들음병 발생을 조사한 결과, 품종과 균주 간에 특이적인 반응은 존재하지 않았다(Table 2). 그리고 FOR JHW 균주에 의한 25개 품종의 무 시들음병 발생이 가장 많았으며 반대로 FOR 59A 균주에 의한 시들음병 발생이 가장 적었는데, 25개 무 품종의 시들음병 평균 발병도는 FOR 60A, 59A, 57A, 147A, NW1, HN, JHW 균주에 대해 각각 0.5, 0.7, 1.2, 2.3, 2.8, 3.7, 3.9 이었다(Table 2). 이들 25개 품종의 FOR 7개 균주의 평균 발병도 순서는 감수성 대조 품종 ‘백춘’에서의 FOR 7개 균주의 AUDPC 즉 병원력 순서와 일치하였다(Fig. 1).
Table 2. Occurrence of Fusarium wilt on 25 radish cultivars caused by 7 isolates of Fusarium oxysporum f. sp. raphani z
yResistant cultivar to Fusarium wilt commercialized by each seed company.
xEach value represents the mean disease index (± standard deviation) of two runs with 10 replicates each.
wValues labeled with the same letter within each line are not significantly different based on Duncan's multiple range test at p = 0.05.
선발한 24개 품종 중 FOR 7개 균주 모두에 저항성을 보인 품종은 ‘명산’뿐 이었으며, 병원력이 가장 강한 FOR HN과 JHW 균주를 제외한 5개 균주에 저항성을 보인 품종은 ‘YR 챔피언열무’ 였다(Table 3). 그리고 FOR 4개 균주에 저항성을 보인 품종은 ‘슈퍼모델’, ‘평강김장’, ‘청일품’ 및 ‘청운’ 4개 품종이었다. 나머지 15개 품종들은 품종에 따라 1개부터 3개 FOR 균주에 대하여 저항성을 나타냈다(Table 2). 하지만 3개 품종 ‘청운플러스’, ‘아우리월동’ 및 ‘한농알타리’는 FOR 7개 균주 모두에 대해 저항성 반응을 보이지 않았다.
Table 3. Resistance of 24 radish cultivars to 7 isolates of Fusarium oxysporum f. sp. raphani z
yResistant cultivar to Fusarium wilt commercialized by each seed company.
실험한 24개 품종 중 FOR 60A, 59A, 57A, 147A, NW1, HN, JHW 균주 각각에 대해 저항성을 보인 품종의 수는 각각 21개, 20개, 13개, 7개, 2개, 1개, 1개 이었으며, 이와 반대로 감수성 품종의 수는 각각 0개, 2개, 4개, 11개, 17개, 23개, 23개 이었다. 즉, 저항성 품종의 수는 균주의 병원력에 반비례하여 증가하였고, 감수성 품종의 수는 균주의 병원력과 비례하여 증가하였다.
고추 품종들의 P. capsici에 대한 역병 저항성은 P. capsici 균주와 고추 품종간의 특이적인 저항성 반응이 존재하지 않고, P. capsici 균주의 병원력에 반비례하여 고추 품종들의 저항성에 차이를 보인다고 하였다(Yang et al., 1989; Foster and Hausbeck, 2010; Jo et al., 2014)은. 그리고 Lee et al.(2018)도 Ralstonia solanacearum 균주 14개에 대한 저항성 및 감수성 고추 품종 12개의 저항성을 조사한 결과, 14개 풋마름병균은 병원력에 따라 6개 그룹으로 나뉘고 품종들의 저항성은 병원력에 반비례하고 크게 4개의 그룹으로 구분할 수 있다고 하였다.
이상의 결과를 정리하면, FOR 7개 균주에 대한 무 24개 품종 각각의 발병도 및 저항성을 살펴보면(Tables 2 and 3) 질적 저항성에서 발견되는 품종과 균주 간에 특이적 관계가 존재하지 않으며(Risser et al., 1976; Ramirez-Villupadua et al., 1985; Hibberd et al., 1987; Kuginuki et al., 1999; Kim et al., 2016), 품종에 따라 발병도 차이는 존재하나 모든 품종은 실험한 균주의 병원력에 비례하여 시들음병이 발생하였다. 따라서 무의 FOR 균주에 대한 저항성은 질적 저항성이 아닌 양적 저항성이며, 무 품종은 접종한 FOR 균주의 병원력에 반비례하여 저항성을 나타냄을 알 수 있었다.
이를 바탕으로 무 시들음병 저항성 품종 개발을 위한 병리검정 전략을 다음과 같이 수립하였다. 시들음병 저항성 계통을 만들기 위한 교배 집단의 병 저항성 개체 선발은 세대가 진전됨에 따라 저항성이 약해지는 점을 고려하여 초기 세대 선발에서는 FOR HN와 JHW 균주와 같이 강한 병원력을 가지는 균주를 사용하여 실험하고, 후기 세대 선발이나 F1 품종의 저항성 정도를 확인하기 위해서는 중간 정도의 병원력을 나타내는 FOR 147A, NW1, KR1 균주를 사용하여 병 저항성 검정을 실험하는 것이 효과적이라고 생각되었다.




