서 언
재료 및 방법
실험재료
유기농 채소종자의 곰팡이와 세균 감염 정도 조사
초음파 및 베이킹 소다 처리
초음파 및 베이킹 소다 처리에 따른 종자 소독효과 및 발아율 조사
통계처리
결과 및 고찰
종자감염균 조사
초음파 및 2% 베이킹 소다 처리에 따른 근채류 유기종자의 소독효과 및 발아율
초음파 및 2% 베이킹 소다 처리에 따른 엽채류 유기종자의 소독효과 및 발아율
초음파 및 베이킹 소다 처리에 따른 박과류 유기종자의 소독효과 및 발아율
서 언
최근 저농약 인증폐지로 2012년 이후 국내 친환경농산물 인증면적은 지속적으로 감소하여 2013년에서 2015년까지 연평균 12.3%로 감소하였다. 그러나 최근(2016 ‑ 2018년) 국내 친환경농산물 전체 인증면적 중 유기농산물 인증면적은 연평균 약 11.3% 증가하였고, 인증 농가 수도 9.7% 증가한 것으로 보고되었다(Jung et al., 2019).
유기농업의 실천에 있어 유기종자의 사용은 기본이며, 유기종자에 대해 “유기종자․묘는 최소한 1세대 또는 다년생인 경우 두 번의 성장기 동안 규정에 따라 재배한 식물에서 유래된 종자”라고 우리나라 친환경농축산물 및 유기식품 등의 인증에 관한 법률의 시행령 시행규칙 별표 1에 명시하고 있다(MAFRA, 2017). 또한 농촌진흥청에서는 상추, 당근, 고추 등 7개 작물에 대한 유기종자생산 매뉴얼을 발간하여 보급한 바 있다(RDA, 2011). 그러나 대부분의 유기재배 농가에서는 유기종자를 구할 수 없기 때문에 화학농약이 분의(seed dressing) 된 상업용 종자를 사용해 오고 있다.
종자는 재배기간 중에 다양한 미생물에 의해 감염 또는 오염되어 있을 수 있기 때문에 식물병원균에 감염 또는 오염된 종자의 비율이 낮아도 포장에서 빠른 전염원의 역할을 하기 때문에 농작물 생산에 큰 피해를 줄 수 있다(Yoo et al., 1994; Gitaitis and Walcott, 2007).
1973년과 2006년 사이에 여러 국가에서 채소나 새싹으로부터 유래한 것으로 추정되는 위생 관련 병이 발생한 사례가 최소 40건 이상인 것으로 보고된 바 있다(Waje and Kwon, 2007). 이러한 발병의 원인은 대부분은 살모넬라 또는 대장균 O157:H7로 오염된 알팔파, 무, 녹두 및 브로콜리 새싹과 관련이 있는 것으로 알려졌다(Scouten and Beuchat 2002; Kim et al., 2016). 또한 병원성 박테리아가 있는 씨앗은 콩나물의 오염원이 될 가능성이 가장 높은 것으로 보고한 바 있다(NACMCF, 1999).
유기농업에서 활용할 수 있는 종자소독 방법은 물리적인 방법으로 온탕침지법, 냉수온탕침지법, 건열처리 등이 있는데, 온탕침지법과 냉수온탕침지법은 주로 식량작물 종자에 이용되었고 건열처리는 주로 채소작물 종자에 이용되었다(Choi et al., 2001).
온탕침지법은 가장 오래된 물리적인 종자소독 방법으로 19세기말부터 귀리 겉깜부기병(Ustilago avenae)와 보리, 밀의 비린깜부기병(Ustilago nuda)을 방제하기 위하여 개발되었으며, 미국에서는 1920년대에 배추뿌리썩음병(Phoma lingam) 방제기술로도 개발되었다(Gabrielson, 1983; Jensen, 1988). 최근에 식량작물뿐만 아니라 다양한 채소종자의 종자전염성 병원균 방제 및 생육 촉진을 위한 온탕침지법 적용에 대한 연구 결과가 보고되었다(Nega et al., 2003; Fukushima et al., 2015; Michalczyk et al., 2019). 국내에서는 오래 전부터 온탕침지법은 벼 키다리병(Gibberella fujikuroi) 방제, 맥류 깜부기병(U. nuda) 방제를 위해 널리 활용되어 왔다(Park et al., 2003; Park et al., 2008; Roh et al., 2011). 그러나 국내에서 온탕침지법을 이용한 채소 종자 소독에 적용한 연구 사례는 매우 적은 것으로 알려져 있다(Lee et al., 2007; Kim et al., 2018).
초음파 처리기술은 의학, 생물학(Timonin, 1966; Rapuntean et al., 2005; Wang et al., 2012), 식품 기술 특성 (Soria and Villamiel, 2010)의 향상뿐만 아니라 소독(Miano, 2015), 균질화, 추출(Balachandran et al., 2006), 점도 변경, 결정화, 건조(Patero and Augusto, 2015) 및 소포와 같은 다양한 응용 분야에 널리 적용되었다.
자연 저장 조건에서 각각 약 9.5년과 11.5년 저장한 톨페스큐와 러시아 야생 호밀 씨앗의 발아율 및 유묘 생육을 증진하기 위한 초음파 최적 처리조건은 367W의 출력, 36.7의 초음파 처리 시간, 35°C의 초음파 처리 온도 및 종자 침지 4.1시간인 것으로 보고하였다(Liu et al., 2016).
초음파 처리는 종자의 발아율을 개선(Yaldagard et al., 2008; Goussous et al., 2010)할 뿐만 아니라 새싹에서 총 호기성 세균수를 2.21 log10 CFU·g-1으로 줄이는 것으로 연구되었다. 초음파 처리는 또한 씨앗 10g당 콩나물 생산량을 301.83g으로 증가시켰다. 따라서, 완두콩 새싹 생산을 위한 미생물 제어 처리로서 초음파 처리가 사용될 수 있다(Chiu and Sung, 2013). 알팔파 종자에 대한 살모넬라 및 대장균 O157:H7 살균 또는 제거에서 화학, 열 및 초음파 복합 처리가 효과적인 것으로 보고하였다(Scouten and Beuchat, 2002).
베이킹 소다(sodium bicabonate)는 식품의 pH, 맛 및 질감을 제어하고 광범위한 항진균 활성을 나타내는 것으로 보고되었다(Miyasaki et al., 1986; Corral et al., 1988). 그래서 베이킹 소다는 치약, 화장품 등을 제조하는 데 사용되어 왔으며, 항균작용은 제한적이지만 여러 곰팡이의 생장을 억제하는 것으로 보고되었다(Gamagae et al., 2003; UNEP, 2020). 그러나 베이킹 소다의 항균작용 메커니즘은 불분명한 것으로 보고되었다(Hang and Woodams, 2003; Arslan et al., 2009).
베이킹 소다를 농산물에 처리한 연구 사례는 파파야(Gamagae et al., 2003), 체리(Karabulut et al., 2001), 감귤(Palou et al., 2001) 등이 있다. 베이킹 소다는 농산물의 곰팡이 성장을 억제하는 다른 약제의 효과를 향상시키는 것으로 나타났지만, 항진균 스펙트럼은 제한적인 것으로 보고되었다(Yao et al., 2004; Palou et al., 2009; Letscher-Bru et al., 2013). 핵과류 열매를 저장하는 동안, 잿빛곰팡이병(Monilinia spp)을 제어하기 위해 온수, 길항균 및 베이킹 소다의 단독 또는 조합처리로 잿빛곰팡이 제어가 가능한 것으로 보고하였다(Casals et al., 2010).
본 연구는 채소 유기종자를 대상으로 유기농업에서 활용 가능한 유기농업자재인 베이킹 소다와 초음파의 단독 또는 혼용처리에 따른 유기종자의 소독효과를 구명하여 유기종자 생산 및 유기농업 실천농가에 보급하고자 수행되었다.
재료 및 방법
실험재료
본 실험에서 사용한 과채류(참외, 수박) 유기종자는 경상북도농업기술원 유기농업연구소, 근채류(무, 비트, 순무)와 엽채류(배추, 양배추) 유기종자는 세종대학교 유기재배 포장에서 유기농으로 재배한 후 채종하여 소독하지 않고 보관 중인 것을 분양 받아 사용하였다.
종자소독용 2% 베이킹 소다 희석액을 제조하기 위해 필요한 순도 100% 베이킹 소다(NaHCO3, Sigma-Alderich, USA)를 시중에서 구입하여 사용하였다. 2% 베이킹 소다 용액은 베이킹 소다 분을 계량한 후 멸균 증류수에 녹인 후, 멸균된 0.25µm 셀룰로스 멤브레인 필터(cellulose membrane filter)에 걸러서 실험에 사용하였다.
또한, 유기종자 소독효과 검정을 위해 사용된 초음파세척기(Power Sonic 410, Hashin Instr. Co. Ltd., Seoul, Korea)는 실험용 초자세척기기로써 온도 조절(25 ‑ 65°C)이 가능하며 40kHz의 초음파를 출력하였다.
유기농 채소종자의 곰팡이와 세균 감염 정도 조사
무소독 채소 유기종자에 감염된 미생물의 종류와 감염 정도를 파악하고자 유기농업연구소와 세종대학교로부터 분양 받은 채소 유기종자에서 임의적으로 50립씩 3반복으로 추출한 다음, 무균상자에서 직경 14cm의 물한천배지(water agar)에 종자별로 25립씩 3반복으로 균일하게 치상하여 근채류와 엽채류 채소 종자는 25°C, 과채류 종자는 30°C 항온기에 7일간 배양하였다. 작물별로 종자의 표면에 발생하는 곰팡이와 세균을 육안으로 관찰하고 광학현미경으로 검경하였으며, 곰팡이와 세균의 종류별로 감염된 종자의 수를 조사하였다.
초음파 및 베이킹 소다 처리
초음파와 2% 베이킹 소다 처리에 의한 채소류 유기종자 소독효과를 검정하기 위하여 Lee et al.(2007)의 방법을 병행하여 사용하였다. 2% 베이킹 소다 단독으로 채소류 유기종자를 소독처리할 경우는 150mL 2% 베이킹 소다를 멸균된 250mL 유리 비이커에 붓고, 작물별로 종자를 25립씩 멸균 티백에 넣어 3반복으로 10분간 처리하였다. 초음파와 2% 베이킹 소다를 병행 처리할 경우, 작물별로 종자를 25립씩 멸균 티백에 넣어 2% 베이킹 소다 용액인 250mL 유리 비이커에 넣고, 멸균수로 채운 초음파 세척기에 흔들리지 않도록 고정한 다음, 처리시간을 30초, 1분, 2분, 3분, 4분 및 5분 간격으로 하여 3반복으로 처리하였다. 이 때, 초음파 세척기의 온도는 상온인 25°C로 설정하였다. 초음파와 2% 베이킹 소다 단독 또는 혼합처리 후, 처리한 종자를 건져내어 무균상자 안에서 멸균된 직경 11cm filter paper(Whatman No. 3) 위에 펼쳐놓고 풍건하여 종자 표면의 물기를 제거한 다음, 채소 유기종자의 소독효과와 발아율 검정에 사용하였다.
초음파 및 베이킹 소다 처리에 따른 종자 소독효과 및 발아율 조사
위와 같은 방법으로 초음파와 2% 베이킹 소다 단독 또는 혼합 처리에 의한 채소 유기종자의 소독 효과와 발아율 검정하고자, 처리별로 25립씩 3반복으로 무균상자에서 직경 14cm의 물한천배지(water agar)에 균일하게 치상하여 근채류와 엽채류 종자는 25°C, 과채류 종자는 30°C 항온기에 7일간 배양하였다. 처리별 종자의 소독 효과는 표면에 발생하는 곰팡이와 세균을 육안으로 관찰하고 광학현미경으로 검경하였으며, 감염된 종자의 수를 조사하였다.
초음파와 2% 베이킹 소다 단독 또는 혼합 처리에 의한 채소 유기종자의 발아율 검정은 국립농업과학원 유기농업과 유리온실에서 수행하였다. 육묘용 상토는 ‘원예용 바로커’를 사용하였으며 원예용 원형포트(Ф20.5 × 16.0cm)에 25립씩 3반복으로 파종한 후 21일까지 항온항습(28°C, RH 85 ‑ 90%)을 자동으로 조절하면서 처리별로 종자의 발아율을 조사하였다.
통계처리
초음파와 2% 베이킹 소다 단독 또는 혼합처리에 따른 채소 유기종자의 곰팡이와 세균의 살균효과와 온실에서 발아율의 조사는 각 처리마다 3반복으로 이루어졌으며 조사한 자료는 엑셀(Microsoft, 2016)로 정리한 후 통계분석은 SAS 프로그램(SAA 9.1, SAS Institute, USA)을 이용하여 던컨의 다중범위검정(Duncan’s multiple range test)으로 분석하였다.
결과 및 고찰
종자감염균 조사
근채류, 엽채류 및 과채류 유기종자의 곰팡이 오염도를 조사하였더니, 우점된 곰팡이는 Alternaria sp.(23.1 ‑ 85.5%) > Aspergillus sp.(14.5 ‑ 80.5%) > Penicillium sp.(35.5 ‑ 75.4%) 순으로 나타났으며 양배추 종자에서는 3종(Penicillium sp., Aspergillus sp., Alternaria sp.)의 곰팡이가 모두 검출되었다(Table 1).
Table 1.
The contamination percentage of seed borne fungus and bacterium in organic watermelon seed
또한 근채류, 엽채류 및 과채류 유기종자의 세균 오염도를 조사하였더니, Pseudomonas sp.(19.2 ‑ 69.8%) 단일종이 검출되었으며 엽채류의 종류에 따라 세균의 오염도는 다양하게 나타났다. 배추가 평균 19.2%로 가장 낮게 나타났으며 수박이 평균 69.8%로 가장 높게 검출되었다(Table 1).
시중에서 유통되고 있는 무, 양배추, 토마토, 당근, 가지, 고추 등의 채소 종자에서 전염되는 식물성 병원균을 검출한 결과, Alternaria sp., Aspergillus sp., Penicillium sp. 등 11종의 진균이 감염되어 있으며 작물에 따라 차이는 있으나 Alternaria sp.가 우점하는 것으로 보고 된 바 있다(Yoo et al., 1994).
본 연구 결과에서도 유기재배로 생산한 채소 유기종자로부터 분리한 진균은 Alternaria sp., Aspergillus sp. 및 Penicillium sp., 등 3종의 곰팡이가 모두 검출되었으며 Alternaria sp.가 우점종인 것으로 나타나, Yoo et al.(1994)의 보고와 유사한 결과를 보여 종자소독에 관한 기술개발이 필요할 것으로 생각된다.
초음파 및 2% 베이킹 소다 처리에 따른 근채류 유기종자의 소독효과 및 발아율
초음파와 베이킹 소다 단독 또는 병행 처리에 따른 무, 순무, 비트 유기종자의 곰팡이와 세균의 소독효과에 미치는 영향을 조사하였더니, 2% 베이킹 소다 단독처리보다 2% 베이킹 소다와 초음파 병행 처리한 것이 무, 순무, 비트 유기종자의 발아율 및 곰팡이와 세균의 살균 효과가 우수한 것으로 나타났다(Table 2). 무 유기종자의 무처리에서는 곰팡이와 세균이 각각 25%, 20%로 전체적인 감염 정도가 높았으나 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이와 세균이 각각 15%씩 감소한 것으로 나타났다(Table 2). 무 유기종자를 2% 베이킹 소다와 초음파를 1분간 병행 처리하였을 때 다른 처리에 비해 발아율 및 곰팡이와 세균의 소독효과가 각각 100%로 가장 우수한 결과를 나타났다(Table 2).
Table 2.
Effect of a single- or combined treatment with 2% NaOCl2 and ultrasonication on seed germination and disinfection rate of fungi bacteria in organic radish, turnip, and beet seeds under difference treatment time
무처리 순무 유기종자의 경우, 곰팡이와 세균이 각각 15%, 35%로, 곰팡이에 비해 세균의 감염 정도가 높았다. 순무 유기종자에 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이와 세균이 각각 10%, 20% 감소하였다. 또한 순무 유기종자에 2% 베이킹 소다와 초음파를 1분간 병행 처리할 경우 때, 2% 베이킹 소다를 단독으로 처리할 때보다 순무 종자의 발아율은 90%, 곰팡이와 세균의 소독 효과는 각각 100%로 가장 유의한 결과를 보였다(Table 2).
무처리 비트 유기종자의 경우, 곰팡이와 세균이 각각 30%, 20%로 곰팡이뿐만 아니라 세균의 오염 정도가 높은 것으로 나타났다. 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이와 세균이 각각 18%, 11% 감소한 것으로 나타났다. 순무 유기종자에 2% 베이킹 소다와 초음파를 2분간 병행 처리할 때, 2% 베이킹 소다 단독 처리에 비해 발아율 및 곰팡이와 세균의 소독 효과가 각각 100%로 가장 유의적인 결과를 나타났다(Table 2).
초음파 처리는 물리적으로 미생물의 세포조직을 단락 및 파괴시키는 작용을 하는 것으로 알려져 있다(Kim et al., 2010). 또한 베이킹 소다는 광범위한 항진균 활성을 나타내지만(Miyasaki et al., 1986; Corral et al.,1988), 항균작용 메커니즘은 불분명한 것으로 보고된 바 있다(Hang and Woodams, 2003; Arslan et al., 2009).
본 연구에서는 2% 베이킹 소다의 단독 처리만으로는 무, 순무, 비트 등 근채류 유기종자의 살균 효과가 낮았지만, 초음파와 병행 처리할 경우 종자의 발아율과 소독 효과가 유의적으로 높아지는 것으로 나타나, 2% 베이킹 소다 단독으로 처리하는 것보다 초음파와 병행 처리하는 것이 좋을 것으로 생각된다.
초음파 및 2% 베이킹 소다 처리에 따른 엽채류 유기종자의 소독효과 및 발아율
초음파와 2% 베이킹 소다 단독 또는 혼합처리에 따른 배추와 양배추 유기종자의 발아율 및 곰팡이와 세균의 소독효과에 미치는 영향을 조사하였더니, 2% 베이킹 소다 단독처리보다 2% 베이킹 소다와 초음파의 병행 처리가 엽채류 유기종자의 발아율이 높이고 곰팡이와 세균의 살균 효과를 향상시켰다(Table 3).
Table 3.
Effect of a single- or combined treatment with 2% NaOCl2 and ultrasonication on seed germination and disinfection rate of fungi bacteria in organic Chinese cabbage and cabbage seeds under difference treatment time
무처리 배추 유기종자의 경우, 곰팡이와 세균이 각각 20%, 30%로 높은 감염 정도를 보였다. 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이와 세균이 각각 15%, 10% 감소한 것으로 보였다. 배추 유기종자에 2% 베이킹 소다와 초음파를 1분간 병행 처리하였을 때, 2% 베이킹 소다 단독처리에 비해 발아율 및 곰팡이와 세균의 소독효과는 각각 100%로 가장 유의한 결과를 나타났다(Table 3).
무처리 양배추 유기종자의 경우, 곰팡이와 세균이 각각 15%, 30%로 곰팡이에 비해 세균의 감염 정도가 높았다. 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이는 15% 감소하였으며 세균은 전혀 나타나지 않았다(Table 3). 양배추 유기종자에 2% 베이킹 소다와 초음파를 1분간 병행 처리하였을 때, 2% 베이킹 소다 단독 처리에 비해 발아율은 95%, 곰팡이와 세균의 소독 효과는 각각 100%로 가장 높은 결과를 나타났다(Table 3).
베이킹 소다는 농산물의 곰팡이 성장을 억제하는 다른 약제의 효과를 향상시키는 것으로 나타났지만, 항진균 스펙트럼은 제한적인 것으로 보고되었다(Yao et al., 2004; Palou et al., 2009). 그 중에서 가장 설득력이 있는 기작으로는 대부분의 박테리아는 세포막을 파열시키는 높은 내부 삼투압을 가지고 있지만, 이 막은 단단한 펩티도글리칸(peptidoglican)으로 둘러싸여 있다. 그람 음성 박테리아의 외막은 펩티도글리칸 외부에 있지만, 지질다당류(LPS)는 인접한 LPS 분자 또는 단백질에 염다리 및 중성 반발력을 형성하는 2가 양이온에 의해 안정화되어 있다(Marvin et al. 1989). 따라서, 베이킹 소다로부터 유래한 탄삼염(HCO3-)이 2가 양이온과 잘 결합하는 성질이 있기 때문에 종자를 살균하기 위하여 베이킹 소다 용액을 처리할 경우, 세균의 세포벽에 존재하는 양이온들과 브릿지를 형성하여 세포벽이 불안정화되고 LPS는 구조적 완전성을 상실하고 세포질 단백질이 세포로부터 방출되어 세균이 죽게 될 것이라 가정할 수 있다.
베이킹 소다는 의료용 소독재료로 사용되고 있으며 살균 효과에 대한 연구결과 중, Streptococcus mutans와 Candida albicans 세균에 대한 항균력은 시료의 표면으로부터 칸디다균의 고착을 유의하게 감소시킨다는 실현 가능한 가설도 보고된 바 있다(Shihacek and Taake, 2005; Cevantes et al., 2009).
본 연구에서는 2% 베이킹 소다 처리만으로는 배추와 양배추 유기종자의 발아율이 90% 이상 이었지만 곰팡이와 세균을 완전히 소독하지 못하였다. 그러나 2% 베이킹 소다와 초음파를 혼합처리를 할 경우 발아율과 소독 효과가 동시에 상승하는 것으로 나타나 배추와 양배추 유기종자도 살균에는 2% 베이킹 소다와 초음파와 혼합 처리하는 것이 좋을 것으로 생각한다.
초음파 및 베이킹 소다 처리에 따른 박과류 유기종자의 소독효과 및 발아율
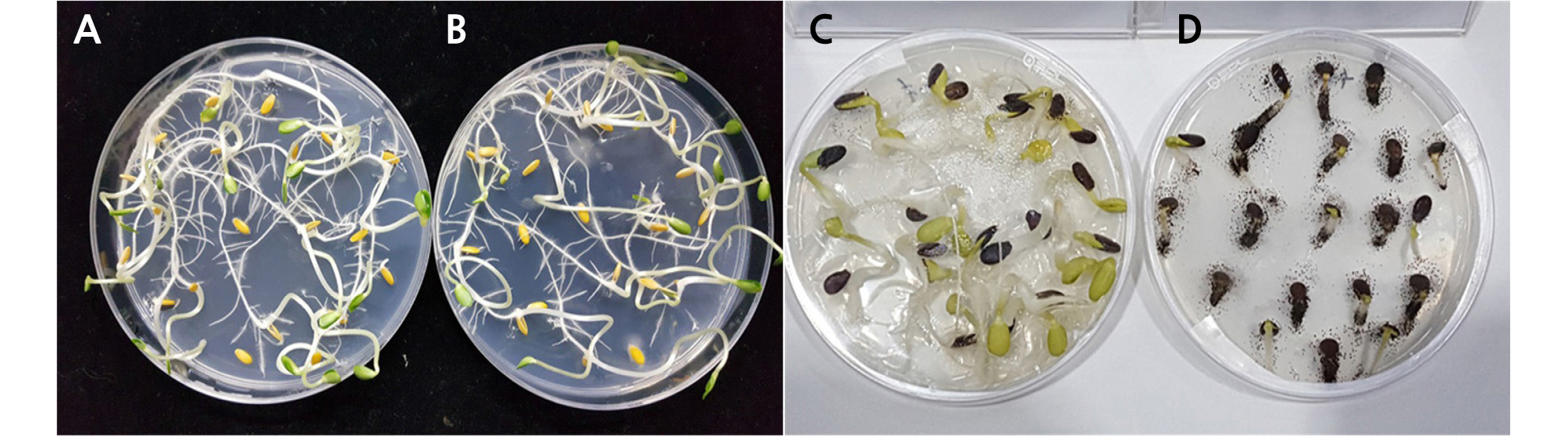
초음파와 베이킹 소다 단독 또는 혼합처리에 따른 참외와 수박 유기종자의 발아율 및 곰팡이와 세균의 소독 효과에 미치는 영향을 조사한 결과, 2% 베이킹 소다 단독처리보다 2% 베이킹 소다와 초음파를 병행처리가 엽채류 유기종자의 발아율 및 곰팡이와 세균의 살균 효과를 유의적으로 높이는 것으로 나타났다(Table 4, Fig. 1).
Table 4.
Effect of a single- or combined treatment with 2% NaOCl2 and ultrasonication on seed germination and disinfection rate of fungi bacteria in organic oriental melon and watermelon seeds under difference treatment time
무처리 참외 유기종자의 경우, 곰팡이와 세균이 각각 15%, 30%로 세균에 비해 곰팡이의 감염 정도가 높게 나타났다. 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이와 세균이 각각 10%, 15%씩 감소하였다. 참외 유기종자에 2% 베이킹 소다와 초음파를 2분간 병행 처리하였을 때, 2% 베이킹 소다 단독 처리에 비해 발아율 및 곰팡이와 세균의 소독효과는 각각 100%로 가장 우수한 결과를 나타났다(Table 4).
무처리 수박 유기종자의 경우, 곰팡이와 세균이 각각 10%, 45%로 세균의 발생이 매우 높게 나타났다. 2% 베이킹 소다를 단독으로 처리할 경우 무처리에 비해 곰팡이와 세균이 각각 5%씩 감소하는 것으로 나타났다. 수박 유기종자에 2% 베이킹 소다와 초음파를 혼합 처리할 경우 2% 베이킹 소다를 초음파에 2분간 처리하는 것이 다른 처리에 비해 발아율은 100%, 곰팡이와 세균의 소독 효과는 각각 100%로 가장 우수한 결과를 나타났다(Table 4).
Casals et al.(2010)은 온수, 길항균 및 베이킹 소다의 조합으로 처리할 경우 과일의 품질에 영향을 미치지 않고 잿빛곰팡이병의 제어가 가능한 것으로 단독처리에 비해 병행처리의 효과가 우수한 것으로 보고하였다. 그러나 참외와 수박 유기종자에 대한 베이킹 소다와 초음파를 이용한 소독기술의 개발 사례가 없으나, Miller et al.(2005)은 스쿼시, 호박 수박 등의 박과류를 온탕침지에 처리할 경우 온도에 민감하기 때문에 온탕침지 종자소독이 적합하지 않다고 보고한 바 있다. 국내에서는 박과류 종자의 발아 및 입묘율에 영향을 주는 몇 가지 요인에 대해 보고된 바 있다. 종자소독 조건(Kim and Lee, 2001), 발아과정의 온도와 빛(Kang et al., 2003), 온탕침지 온도와 시간(Lee et al., 2007), 질산칼슘[Ca(NO3)2] 노출에 따른 발아율(Fan et al., 2017) 등이 박과류 종자의 소독과 발아율에 영향을 주는 것으로 보고하였다. 따라서 본 연구에서도 베이킹 소다의 농도와 처리 시간 등이 참외와 수박 종자의 소독처리에 따른 소독 효과와 발아율에 영향을 줬을 것으로 생각한다.
단일 유형의 처리에 의한 종자 소독은 미생물 개체군을 현저히 감소시킬 수 있으나, 2가지 이상의 방법을 순차적으로 또는 동시에 적용함으로써 상승 효과를 달성할 수 있는 것으로 보고되었다(Kim et al., 2010; Bang et al., 2011; Ding et al., 2013).
본 연구에서는 2% 베이킹 소다 처리만으로는 참외와 수박 유기종자의 발아율이 75% 이상 이지만 세균의 소독 효과가 떨어지는 것으로 나타났다. 그러나 2% 베이킹 소다와 초음파를 혼합 처리할 경우 발아율과 소독 효과가 동시에 상승하는 것으로 나타났다.
이상의 결과를 미루어볼 때 2% 베이킹 소다 단독처리 보다는 2% 베이킹 소다와 초음파의 혼합처리가 근채류, 엽채류 및 박과류 종자의 발아율과 감염된 곰팡이나 세균의 살균효과를 유의적으로 상승하는 데 도움이 되는 것으로 생각한다.