서 언
재료 및 방법
실험재료
화분발아율 및 화분관 신장 조사
상대습도에 따른 화분관 신장
통계분석
결 과
온도에 따른 화분발아율 및 화분관 신장
온도에 따른 화분발아 특성
수분 후 상대습도에 따른 화분발아 특성
고 찰
서 언
사과(Malus domestica Borkh)는 타가수정 작물로서 타품종의 꽃가루(화분)가 수분되어야만 결실이 되는 특성이 있어 화합성이 있는 수분수를 혼식하고 있다(Dennis, 2003; Kweon et al., 2016). 일반적으로 사과원에서는 수분수의 혼식과 화분 매개충의 원활한 활동으로 인하여 수분이 이루어지고 수정되는데 큰 문제가 발생하지 않았다. 그러나 최근 국내 사과재배시스템은 소면적 재배의 경우는 단일품종을 재식하거나, 대면적일 경우 구획을 나누어 재배특성이 다른 품종들을 일정비율로 재식하도록 하는 방식을 유도하여 왔다(Kang et al., 2002). 그러나 이러한 재배형태는 수분수 배치의 부족으로 결실에 문제가 발생하기 때문에 국내외에서 꽃사과를 수분수로 활용하여 결실부족의 문제를 해결하여 왔다(Church and Williams, 1970; Paik, 1977; Crassweller et al., 1980; Williams and Church, 1983; Ha and Shim, 1995; Kang et al., 2002; Kang, 2004; Son et al., 2013). 그리고 국내 재배면적의 약 60% 이상을 차지하는 ‘후지(S1S9)’ 사과의 원활한 수정을 위하여 ‘쓰가루’는 S3S7, ‘홍로’는 S1S3, 꽃사과품종인 ‘Hopa-A’와 ‘Adam’s’는 각각 S20S?와 S20S26와 같이 자가불화합성 유전자를 분석하여 수분수로 이용하여 왔다(Son et al., 2013). 그럼에도 불구하고 최근에는 사과나무의 개화기 전·후 이상저온으로 인하여 개화가 불균일하고 개화시 온도에 따라 수분 후 화분관이 자방에 도달하는 시간이 2–8일 정도로 다르다고 보고되는 등 개화기에 저온이 사과의 수정율에 미치는 영향은 매우 크다고 알려져 있다(Dennis, 2003; Palmer et al., 2003; Wertheim and Schmidt, 2005). 또한 개화기 기상불안정으로 인해 화분 매개충의 수가 부족하거나 활동이 저조해짐에 따라 수정불량 문제가 빈번히 발생하고 있는 실정이다(Yim, 2015). 그리고 개화직후 높은 온도와 강한 바람 및 건조한 대기환경은 암술머리의 빠르게 건조시켜 화분의 수분과 발아를 저해시키기도 한다(Šírová et al., 2011; Ramírez and Davenport, 2013). 이러한 문제점을 해결하기 위하여 사과원에서는 인공수분을 실시하고 있으나 온도, 강우, 바람 등 주변 환경변화에 영향을 받음으로써 효과적인 결실을 유도하지 못하고 있다. 또한, 전년도 생산된 화분은 사용 전 화분의 발아력을 높이는 목적으로 상온에 노출시키고 수화처리(hydration)를 하고 있지만 이는 오히려 화분의 발아율이 저하되는 문제점이 발생되기도 한다(Visser and Oost, 1981). 이와 같이 화분발아 특성에 대한 연구가 일부 진행되어 왔지만 상대습도에 따른 화분관 신장에 미치는 영향에 대한 연구는 진행된 바가 없다.
따라서 본 연구는 ‘후지’ 사과에 수분이 가능한 사과재배 품종과 꽃사과 품종의 화분을 채취하여 다양한 온도 및 상대습도 조건에 따른 화분 발아율과 화분관 신장 정도를 구명함으로써 사과 결실률 향상을 위한 기초자료를 제공하고자 하였다.
재료 및 방법
실험재료
본 실험은 경상북도 사과농가에 재식되어 있는 재배품종들 중 ‘후지’ 사과의 수분수로 주로 이용되는 품종인 ‘쓰가루’와 ‘홍로’ 사과와 꽃사과인 ‘Hopa-A’와 ‘Adam’s’ 품종의 약(葯)을 채취하여 혼합한 후 개약시켜 순수 화분을 분리하였다(Kweon et al., 2016). 이들 화분의 특성 분석을 위하여 –80°C 초저온 냉동고에 보관하면서 사용하였다.
화분발아율 및 화분관 신장 조사
화분발아율 검정시 사용된 배지는 agarose 1%, sucrose 10%, boric acid 0.01%로 조성하여 멸균한 후 사용하였다. 온도에 따른 화분발아율은 품종별 화분을 배지상에서 골고루 치상한 후 0, 5, 10, 15, 20, 25, 30°C의 온도를 처리한 생장상에서 각각 1, 2, 3, 4, 5, 6시간 후에 측정하였다. 화분관 신장 정도는 cellSens dimension 프로그램을 설치한 실체현미경(Olympus Co., Ltd., Tokyo, Japan)을 이용하여 화분관의 길이를 측정하였다. 그리고 화분을 사용하기전 수화처리시 온도가 화분의 발아율에 미치는 영향을 조사하기 위하여 화분을 0, 15, 20, 25, 30, 35°C에 각각의 온도에서 5시간 습처리 후 25°C의 온도를 처리한 생장상에서 화분발아율을 조사하였다. 화분 특성은 각 품종별로 petri-dish 3개를 1반복, 총 3반복으로 하여 그 평균 값으로 나타냈다.
상대습도에 따른 화분관 신장
‘후지’와 ‘홍로’ 품종의 개화 직전의 가지(이미 개화된 꽃들은 제거)를 이용하여 25°C의 growth chamber에 넣고 상대습도를 30, 50, 80%로 처리하였다. 상대습도 처리전 각 처리구별로 12개의 중심화에 꽃사과의 화분으로 인공수분을 실시하였고, 3일후에 각각의 암술대를 채취한 다음 개개의 암술대 아래 2/3지점까지 화분관의 신장 정도와 수를 조사하였다.
화분관 신장조사는 암술만을 채취하여 Farmer's fixative solution(glacial acetic acid : ethyl alcohol = 0.24: 0.76)에서 고정하여 4°C에 저장한 후 분석하였다. 분석시에는 흐르는 물에 암술을 씻은 후 60°C 0.8N NaOH에서 약 1시간동안 softening 후 다시 증류수로 세척한 다음 0.1N K3PO4에 0.1% aniline blue를 녹인 염색시약으로 약 10분간 염색 후 UV 형광현미경(Nikon OPTIPHOT-2 Fluorescence Microscope, Tokyo, Japan)을 이용하여 370nm excitation peak에서 관찰하여 조사하였다.
통계분석
모든 측정 결과는 평균(mean) ± 표준오차(standard error, SE)로 나타났고, 통계분석은 SPSS 프로그램(IBM SPSS Statistics 26, SPSS Inc., Armonk, NY, USA)을 이용하여 온도, 습도 및 처리시간에 따른 평균값 차이를 one-way ANOVA test검증하였고 사후검정으로 Duncan’s multiple range test를 실시하였다(p < 0.05).
결 과
온도에 따른 화분발아율 및 화분관 신장
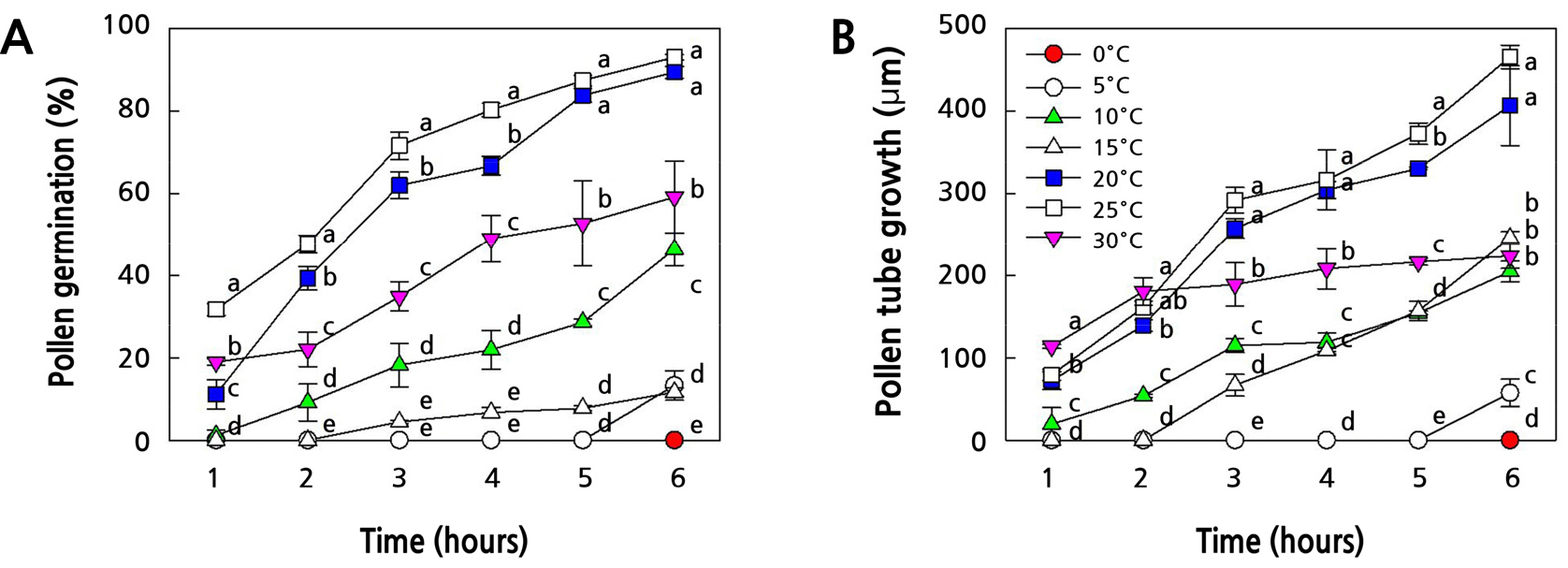
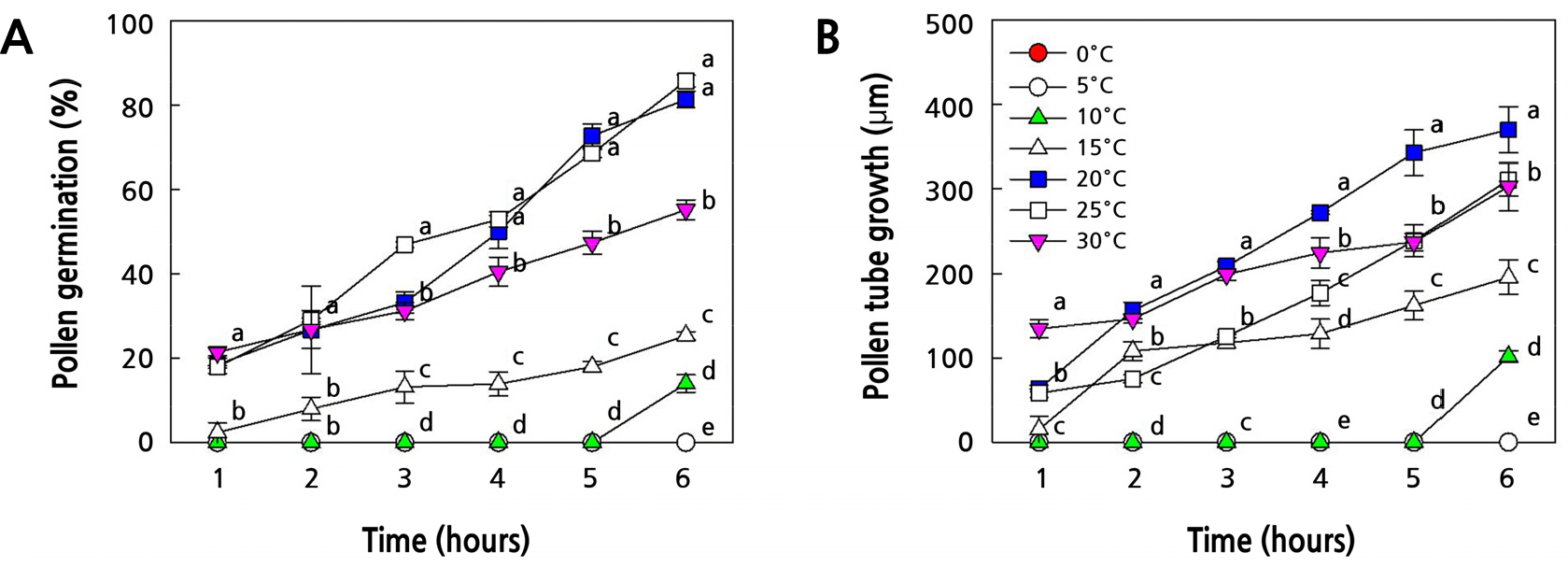
‘홍로’와 ‘쓰가루’ 사과의 화분 및 혼합한 ‘꽃사과’ 품종의 화분을 채취하여 온도처리(0, 5, 10, 15, 20, 25, 30°C)에 따른 화분발아율과 화분관 신장 정도를 측정하였다. ‘홍로’ 화분의 경우(Fig. 1), 15°C 이하와 30°C의 온도에서 화분발아율은 60% 이하였고, 화분관 신장도 240µm 이하로 낮았다. 그러나 20°C와 25°C의 온도에서 화분발아율은 각각89.4, 93.0%였고, 화분관 신장도 400µm이상으로 양호하였다. ‘쓰가루’ 화분의 경우(Fig. 2), 15°C 이하의 온도에서 화분발아율운 43% 이하였고, 화분관 신장도 200µm 이하로 낮았다. 그러나 20°C, 25°C 그리고 30°C의 온도에서 화분발아율은 각각 94.8, 88.8, 83.8%로 높은 발아율을 나타내었으나, 화분관 신장은 25°C의 온도에서 341.6µm를 보였고, 20°C와 30°C의 온도에서는 300µm 이하로 ‘홍로’ 품종의 화분에 비하여 화분관 신장이 낮은 결과를 보였다. 혼합한 ‘꽃사과’ 화분의 경우는(Fig. 3), 15°C 이하와 30°C의 온도에서 ‘홍로’ 화분의 특성과 유사하게 화분발아율이 50% 이하로 낮았고, 25°C의 온도에서만 75.6%의 화분발아율을 보였다. 그리고 화분관 신장은 20°C의 온도에서만 370.4µm를 보였고, 나머지 처리구들은 300µm 이하의 신장을 보였다. 따라서 3품종 모두에서 온도가 15°C 이하와 30°C에서는 화분발아율과 화분관 신장이 저조하였고, 20°C와 25°C의 온도 조건에서는 화분발아율과 화분관 신장이 품종간 다소 차이가 있었지만 양호한 결과를 보였다.
온도에 따른 화분발아 특성
최근 국내 사과농가들은 수입산 화분을 사용하고 있으며 인공수분 전에 화분발아율을 향상시키기 위하여 상온에서 수화처리(hydration)를 하므로서 화분발아율이 감소하는 현상이 발생하고 있다. 따라서 인공수분용 화분을 여러 온도에서 5시간 방치한 후 화분발아율을 조사하였다(Fig. 4). ‘쓰가루’와 ‘홍로’ 화분은 0°C에서는 각각 93.1%와 88.8%를 보였으나, 15–30°C 사이에서는 화분발아율이 58.2–72.4%로 감소하였고, 특히, 35°C에서는 각각 34.80%와 40.3%로 매우 낮은 발아율을 나타내었다. 그리고 ‘꽃사과’ 혼합 화분은 0°C에서는 85.7%, 15–30°C에서는 70.6–79.5%로 다소 감소하였고, 35°C 에서는 58.4%의 화분발아율을 보였다. 이는 재배품종인 ‘쓰가루’와 ‘홍로’ 사과의 화분에 비하여 ‘꽃사과’ 화분이 고온에 다소 강한 것을 확인하였다.

Fig. 4.
Pollen germination rate after pollen hydration pretreatment at different temperatures for 5 hours with pollen from three apple varieties. Data are presented as mean ± standard error (n = 9). Different letters within each cultivar indicate statistically significant differences at p < 0.05 based on Duncan’s multiple range test.
수분 후 상대습도에 따른 화분발아 특성
사과원의 상대습도에 따라 과실 수정율에 미치는 영향을 알아보기 위하여 ‘후지’와 ‘홍로’ 품종의 중심화에 상대적으로 고온에 적응하는 정도가 강한 것으로 확인된 ‘꽃사과’ 품종의 화분을 인공수분한 후 25°C의 growth chamber에서 각각 상대습도 30, 50, 80% 조건을 설정한 뒤 화분관 신장 정도를 측정하였다. 인공수분후 25°C에서 3일동안 암술대 아래 2/3부분까지 신장된 화분관의 신장 정도를 UV 형광현미경으로 측정한 결과, ‘후지’(Fig. 5A, 5B, and 5C)와 ‘홍로’(Fig. 5D, 5E, and 5F) 품종 모두에서 습도가 높을 수록 화분관 신장이 우수하였다. 그리고 습도에 따른 화분관 수를 측정한 결과(Fig. 6), ‘후지’ 사과는 습도 30%에서 평균 2.21개, 50%에서 3.38개, 80%에서 3.69개로 증가하였고, ‘홍로’ 사과의 경우도 습도 30%에서 평균 2.35개, 50%에서 4.78개, 80%에서 5.78개로 습도가 높을수록 화분관 신장이 증가하는 결과를 보였다.
고 찰
사과나무의 수정은 암술대의 암술머리 표면에 부착된 화분량과 화분관 신장정도가 중요하지만 수분에 대한 가장 중요한 매개변수는 암술대에 도달하는 화분관의 수가 중요하다(Jahed and Hirst, 2017). 그리고 수분시 대기온도(Petropoulou and Alston, 1998; Yoder et al., 2009)와 수분방법(Albuquerque et al., 2010)에 따라 수분과 수정에 중요한 영향을 미치게 된다. 그리고 사과의 수정율은 화분발아율이 매우 중요한 요인이고, 또한 인공수분시 많은 수의 화분이 암술머리에 부착되는 경우 암술대 하부까지 신장되는 화분관의 수를 증가시키는데 유리하다고 하였다(Albuquerque et al., 2010). 그러나 Shin and Kim(2010)은 사과에서 인공수분 후 저온조건에 노출되면 화분이 발아되지 않거나 화분관 신장이 저해되어 수정이 불량해진다고 하였다(Figs. 1, 2, and 3). 반면에 사과 화분의 발아율은 28–30°C에서 매우 우수한 결과를 보였지만(Petropoulou and Alston, 1998; Yoder et al., 2009), 사과 만개기에 인공수분 후 기온이 32°C 이상이 되었을 때는 수정률이 급격히 감소하여 착과불량이 발생된다고 하였다(Kweon et al., 2013). 본 결과에서 보면, ‘쓰가루’, ‘홍로’ 및 혼합된 ‘꽃사과’ 품종들의 화분은 온도가 15°C 이하와 30°C에서는 화분발아율과 화분관 신장이 저조하였으나, 20°C와 25°C 조건에서는 화분발아율과 화분관 신장이 양호한 결과를 보여(Figs. 1, 2, and 3) 사과나무의 개화기동안 대기온도에 따라 암술대 아래로 신장하는데 24–96시간 정도 소요되는 등(Yoder et al., 2009) 수정에 미치는 영향이 많은 차이를 보일 것으로 판단되었다. 최근 국내에서는 사과 개화기 이상저온에 따른 수정불량 현상이 빈번히 발생함에 따라 인공수분을 실시하고 있지만 대부분 수입산 화분에 의존하고 있는 실정이고, 이들 화분은 인공수분 전에 화분발아율을 향상시키기 위하여 상온에서 수화처리를 실시함으로써 화분발아율이 감소하는 현상이 발생하고 있다(data not shown). 그러므로 수화처리시 화분의 노출온도가 화분발아율에 미치는 영향을 구명할 필요가 있다고 판단되었다. 따라서 인공수분용 화분을 다양한 온도에서 각각 5시간 방치 후 ‘쓰가루’, ‘홍로’ 및 혼합된 ‘꽃사과’의 화분 모두에서 30°C 이하에서는 화분발아율이 미미한 감소를 보여 수정에 미치는 영향은 없을 것으로 판단되었지만, 35°C에서는 화분발아율이 급격히 저하되므로 화분을 고온에 장시간 노출시키는 것은 수정율 저하의 원인으로 작용할 것으로 판단되었다(Fig. 4).
사과의 수정율을 향상시키기 위해서는 화분발아율도 중요하지만, 화분관의 신장도 매우 중요한 요인이 된다(Petropoulou and Alston, 1998; Yoder et al., 2009; Albuquerque et al., 2010). 특히, 강한 바람과 건조한 대기환경은 화분이 암술머리에 부착되거나 혹은 수분후에도 화분 발아 및 화분관 신장이 저조하다고 하여(Šírová et al., 2011; Ramírez and Davenport, 2013) 본 연구에서 인공수분 후 상대습도를 높혔을 때 화분관 신장이 촉진되었고(Fig. 5C and 5F), 화분관 수도 증가하였으므로(Fig. 6) 사과원의 상대습도에 따라 수정율에 미치는 영향이 있는 것으로 판단되었다.

Fig. 6.
The number of crabapple pollen tubes on the lower part of the style in ‘Fuji’ (top) and ‘Hongro’ (bottom) flowers according to different relative humidities (30%, 50% and 80%) at three days after pollination. Data are presented as mean ± standard error (n = 12). Different letters between cultivars indicate statistically significant differences at p < 0.05 based on Duncan’s multiple range test.
이상의 결과를 종합해 보면, 사과나무 개화기에 15°C 이하의 저온이 지속되는 경우 화분발아율과 화분관 신장에 악영향을 주는 원인이 되므로 개화기에 온도변화를 잘 관찰할 필요가 있고, 또한 수분 후 화분관 신장 촉진을 위하여 과수원 주변의 상대습도를 높게 유지하는 것이 사과의 수정율을 향상시킬 수 있는 방안이라고 판단되었다.